调节性B细胞在吉兰-巴雷综合征患者外周血中的表达及意义*
郝晨光,王艳,马建华
[1.新疆医科大学第一附属医院昌吉分院(昌吉市第二人民医院)神经内科,新疆 昌吉 831100;2.新疆医科大学第一附属医院 神经内科,新疆 乌鲁木齐 830054]
吉兰- 巴雷综合征(Guillain-Barre syndrome,GBS)是一种自身免疫介导的周围神经疾病,是引起四肢急性对称迟缓性瘫痪的最常见致病因素之一。一旦发病可严重影响患者的生活质量,甚至出现呼吸肌麻痹,危及患者生命,给社会及家庭造成沉重的负 担[1]。但GBS 具体的发病机制及发病环节中具体的免疫作用机制仍不明确。调节性B细胞(regulatory B cells,Bregs)是新发现的B细胞亚群。有研究证实Bregs在免疫相关性疾病中具有负向免疫调节的作用,在神经免疫性疾病,如临床孤立综合征、多发性硬化等患者外周血中均存在Bregs 数量或功能的异常[2-4]。国内外鲜有针对GBS患者外周血中Bregs及相关细胞因子表达的研究报道,笔者旨在通过分析GBS患者外周血中Bregs 亚群的数量,探讨其在疾病发生过程中的临床意义及免疫学机制。
1 资料与方法
1.1 一般资料
选取2018年10月—2019年6月新疆医科大学第一附属医院昌吉分院收治的GBS患者50例作为GBS组。其中,男性33例,女性17例;年龄6 ~83岁,平均(45.12±20.54)岁;病程1 ~15 d,平均病程(7.9± 3.4)d。纳入标准:符合2010年《中国GBS 诊治指南》诊断标准[5]。排除标准:排除其他自身免疫性疾病、白血病、淋巴瘤、器官移植、甲状腺功能亢进症、桥本甲状腺炎、甲状腺功能减退症、乙型病毒性肝炎、人类免疫缺陷病毒感染等。选取同期本院健康体检者50例作为对照组。其中,男性30例,女性20例;年龄8 ~72岁,平均(46.78±16.87)岁。两组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。
1.2 试剂及仪器
PBS 无菌液体、红细胞裂解液、FITC-单克隆鼠抗人CD19 抗体、PE-单克隆鼠抗人CD24 抗体、APC-单克隆鼠抗人CD38 抗体及APC-单克隆鼠抗人CD27 抗体均购自美国Becton Dickinson公司,流式细胞仪(Apriall型)购自美国Becton Dickinson公司。
1.3 方法
将乙二胺四乙酸抗凝血70μl 置于2个试管,标记为Br1、Br2。Br1 中加入FITC-单克隆鼠抗人CD19 抗体、PE-单克隆鼠抗人CD24 抗体及APC-单克隆鼠抗人CD38 抗体。Br2 中加入FITC-单克隆鼠抗人CD19 抗体、PE-单克隆鼠抗人CD24 抗体及APC-单克隆鼠抗人CD27 抗体。Br1、Br2 混匀室温避光孵育18 min,加红细胞裂解液2 ml,室温避光5 min,2 000 r/min 离心5 min,弃上清,1 ml PBS 洗涤,再次2 000 r/min 离心5 min,弃上清,加入PBS 3 ml 重悬。室温避光孵育后用流式细胞仪检测CD19+CD24hiCD38hiBreg、CD19+CD24hiCD27+Breg细胞。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血CD19+CD24hiCD38hiBreg细胞表型比例比较
GBS组CD19+CD24hiCD38hiBreg细胞表型比例为(3.98±1.18)%,对照组为(6.88±2.20)%,经t检验,差异有统计学意义(t=-6.932,P=0.005),GBS组较对照组低。见图1。
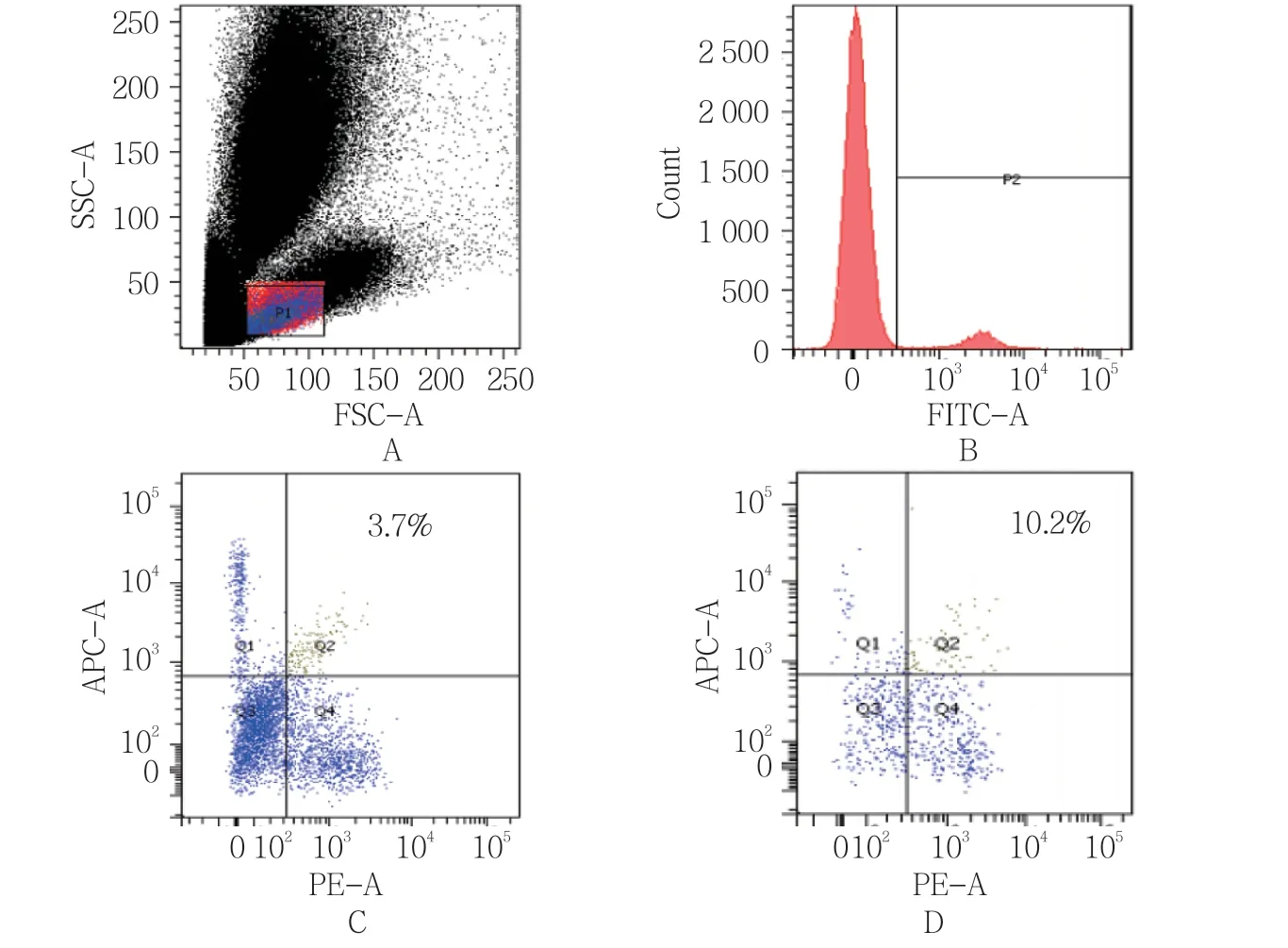
图1 外周血CD19+CD24hiCD38hiBreg细胞表型流式细胞图
2.2 两组外周血CD19+CD24hiCD27+Breg细胞表型比例比较
GBS组CD19+CD24hiCD27+Breg细胞表型比例为(13.67±3.79)%,对照组为(23.97±4.84)%,经t检验,差异有统计学意义(t=-11.853,P=0.007),GBS组较对照组低。见图2。

图2 外周血CD19+CD24hiCD27+Breg细胞表型流式细胞图
3 讨论
GBS是一种自身免疫性、感染后免疫介导疾病,其特点是自身抗体的产生、补体的激活,以及对神经节苷脂的T 反应活性。有研究发现,包括T1细胞、T2细胞和Treg细胞在内的几个免疫细胞亚群参与了GBS 自身抗体的产生[6]。通过产生IL-23/IL-17,滤泡T 辅助细胞的频率也与GBS 有关,然而Bregs细胞是否参与这一过程尚不清楚。
B细胞是体液免疫的核心成分之一。传统观念认为B细胞的主要作用在于产生抗体,直到后来发现其直接参与细胞免疫。B 淋巴细胞通过抗原呈递、共刺激和细胞因子产生参与T细胞活化;其影响机体组织中的抗菌保护机制和炎症过程,充当控制细胞和体液免疫反应的调节细胞。早在20 世纪70年代,人们就首次提出存在能够抑制免疫反应的B细胞。仅20年后,通过实验性自身免疫性脑炎(experimental autoimmune encephalomyelitis,EAE)这一多发性硬化的动物模型,首次可靠地描述了B细胞的调节特性[7]。在EAE小鼠模型的实验中发现,与有自愈倾向的野生型小鼠相比,EAE 可使B细胞缺陷的C57BL/6小鼠疾病进一步进展,表明小鼠体内可能存在抑制炎症反应的B细胞亚群,找到了Bregs 存在的有力证据[7]。2002年MIZOGUCHI 等[8]在炎症性肠病动物模型中找到了Bregs 存在的有力证据,并将这种发挥疾病抑制作用的B细胞亚群命名为Bregs。
Bregs是一小部分B细胞群,参与免疫调节和抑制免疫反应[9]。到目前为止,Bregs 究竟是起源于一个特定的祖细胞,还是起源于传统的B细胞亚群,还不清楚,因此很难确定Bregs的确切表型[10]。然而,有一种共识认为Bregs 主要通过分泌细胞因子发挥免疫调节作用[11]。在人类中,CD19+CD24hiCD38hi、CD19+CD24hiCD27+B细胞都通过分泌IL-10 来控制免疫反应[12-13]。然而,这2个亚群对T细胞有不同的影响。含有未成熟B细胞标志物CD38的Bregs 被认为能够诱导T 调控细胞的发育,同时限制T1和T17细胞的分化。而具有记忆B细胞标志CD27的Bregs主要负责抑制CD4+T细胞的活性。此前有研究认为CD19+IL-10 Bregs与人类CD24hiCD27+B细胞相对应[14]。因此,笔者重点研究CD19+CD24hiCD38hiBregs、CD19+CD24hiCD27+Bregs在GBS患者中的表达频率和免疫调节功能。
自身免疫性疾病的发生是机体免疫系统不能正确识别自体抗原和异体抗原,发生交叉免疫反应,出现免疫调节紊乱,导致自身免疫性疾病的发生。近年研究发现Bregs在维持机体内环境免疫稳态及调节免疫耐受中起到极其重要的作用,并与自身免疫性疾病发生、发展密切相关[9,15]。大量证据表明B细胞在多发性硬化症、系统性红斑狼疮、类风湿关节炎、皮肌炎等自身免疫性疾病的发病机制中起着重要作用[3,16-19]。
在自身免疫性疾病中,Bregs的频率仍然存在争议。本实验重点研究GBS患者Bregs的变化,发现与对照组相比,GBS组循环CD19+CD24hiCD38hi和CD19+CD24hiCD27+Bregs 均降低。有利于细胞毒性T细胞对宿主进行攻击,促进宿主免疫系统的下降,这与之前系统性红斑狼疮、血小板减少症的研究结果一致[20-21]。CD19+CD24hiCD27+Bregs 主要抑制T细胞的活化,这是B细胞自身抗体产生的必要条件[13]。笔者发现,GBS患者源性CD19+CD24hiCD27+Bregs在抑制CD4+T细胞增殖和原发性细胞因子分泌方面具有调节作用。这些发现提示,Bregs 通过控制CD4+T细胞活化的功能转变,参与GBS的发病。
当然,目前各种实验发现Bregs 存在许多不同的表型,本研究只研究了其中2种表型,尚不足以完全代表Bregs,且本实验的研究人群较少,患者来源群体单一,无法完全代表所有GBS患者,故本实验仅作为参考,仍需大样本随机对照实验进一步明确结论。而且本实验只是研究了GBS 急性期的CD19+CD24hiCD38+Bregs及CD19+CD24hiCD27+Bregs,限于资金及研究时间限制,未对GBS 恢复期患者进一步研究对照,所以实验相对单一。以后笔者将对患者恢复期的不同时机作进一步研究,以更加有效地证实研究结果。
综上所述,Bregs在维持免疫耐受和免疫平衡中有重要的作用。CD19+CD24hiCD38+Bregs及CD19+CD24hiCD27+Bregs 可能参与GBS的发病,但具体的机制尚不明确,有待进一步研究。

