血管活性肠肽在单眼视觉剥夺性弱视幼猫外侧膝状体中的表达*
(川北医学院附属医院 眼科,四川 南充 637100)
弱视是造成全世界儿童视力下降的主要疾病之一。近些年来,随着分子生物学、神经生物学等多学科在弱视研究上的广泛应用,其发病机制得到进一步揭示。目前,已知弱视的发生、发展主要与视觉神经系统(主要包括视网膜、外侧膝状体及视皮层)的异常改变紧密相关。弱视患者的视网膜和视皮层中多种神经递质的含量改变,如神经生长因子、脑源性神经营养因子、营养神经素及多巴胺等。血管活性肠肽(vasoactive intestinal polypeptide,VIP)作为一种神经递质,由28个氨基酸残基组成,属于分泌素-胰高血糖素家族,广泛分布于中枢神经和肠神经系统中,随后被发现也存在外侧膝状体中[1]。早前有研究表明,视觉剥夺性弱视幼猫视皮层17区的VIP 含量减少,但在外侧膝状体中的变化还未探究[2]。本实验通过观察视觉剥夺性弱视幼猫外侧膝状体中VIP的表达,探讨VIP 对视觉发育的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康3周龄幼猫30只(由川北医学院实验动物中心提供),雌雄、毛色不分,体重约290 ~360 g。排除屈光介质混浊及眼底异常,经检测所有幼猫屈光度约+1.0 ~+2.0D。饲养在光照充足环境中,室内温度维持在(27±1)℃。5周龄前幼猫不能自主摄取固态食物,每日定时喂养猫奶粉、饮用水共8 次。5周龄后保持室内存放充足食物及饮用水。本研究通过川北医学院实验动物伦理委员会批准并接受全程监督。
1.1.2 主要试剂及仪器 柠檬酸(pH=6.0)抗原修复液(武汉Servicebio公司),VIP抗体(美国Fitzgerald公司),辣根过氧化物酶标记的山羊抗兔抗体(武汉Servicebio公司),免疫组织化学试剂盒DAB 显色剂(武汉Servicebio公司),焦碳酸二乙酯(美国Amresco公司),兔抗地高辛抗体(美国Jackson公司),探针序列,正向引物:5’-DIGTGCATCCGAGTGGCGCTTGATTGG-DIG-3’;反向引物:5’-DIG-CTGGTTTCCATCTTTGTACC TTGCCAAGTAGTG-DIG-3’(武 汉Servicebio 公 司),动物针电极(北京高视远望科技有限责任公司),视觉电生理仪(重庆国特医疗设备有限公司),掌上离心机(武汉Servicebio公司),原位杂交用离心管(美国Axygen公司),成像系统(日本Nikon公司)。
1.2 方法
1.2.1 动物模型复制 30只幼猫随机分为对照组和剥夺组,每组15只。用戊巴比妥钠溶液腹腔注射麻醉剥夺组幼猫后,于右眼眶周边对称做4个皮肤固定缝线,每个缝线上做1个小套环(遮盖过程中套环一直存在),使用丝线穿过小套环,再穿过黑色眼罩的4个小孔,打结固定眼罩,保证眼罩不压迫眼球。每周剪断丝线行图形视觉诱发电位(pattern visual evoked potential,PVEP)检测。对所有幼猫行PVEP 检测时,3 根动物针电极分别刺入前额正中,双耳连线枕部正中及耳尖背部的皮下。相应镜片矫正屈光,调整头位使视网膜后极部中央与屏幕中央在同一水平线上,PVEP 采用棋盘格反转刺激,模式选用0.3 cpd,时间频率为1 Hz,叠加64 次,分别测量剥夺组剥夺眼和未剥夺眼、对照组右眼。6周龄时,通过比较PVEP的P100波潜伏期及振幅,证实视觉剥夺组中单眼弱视形成。用戊巴比妥钠深度麻醉剥夺组和对照组幼猫,分离出右侧外侧膝状体,石蜡包埋切片,行免疫组织化学及原位杂交实验研究。
1.2.2 实验方法 免疫组织化学:石蜡切片,常规脱蜡,抗原修复,阻断内源性过氧化物酶,血清封闭,分别加入一抗、二抗,DAB 显色,复染细胞核,脱水封片,显微镜镜检,图像采集分析阳性细胞和阳性细胞平均光密度值。原位杂交:石蜡切片,常规脱蜡,消化,阻断内源性过氧化物酶,预杂交,杂交,杂交后洗涤,滴加封闭液,滴加兔抗地高辛抗体,DAB 显色,复染细胞核,脱水封片,显微镜检,图像采集分析阳性细胞和阳性细胞平均光密度值。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步的两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 PVEP 结果
对照组幼猫随着年龄增加,P100波潜伏期逐渐缩短,振幅逐渐提高。测试时控制电阻,可见各组典型PVEP 波形(见图1)。6周龄时,对照组右眼、剥夺组右眼和剥夺组左眼潜伏期比较,经方差分析,差异有统计学意义(P<0.05);剥夺组右眼较对照组右眼及剥夺组左眼的潜伏期延长(P<0.05)。对照组右眼、剥夺组右眼和剥夺组左眼振幅比较,经方差分析,差异有统计学意义(P<0.05),剥夺组右眼较对照组右眼及剥夺组左眼振幅降低(P<0.05)。在进行单眼遮盖3周后(即6周龄时),剥夺组幼猫右眼已形成单眼视觉剥夺性弱视。见表1。

图1 各组幼猫PVEP 波形图
表1 各组P100 波潜伏期和振幅比较(n =15,±s)

表1 各组P100 波潜伏期和振幅比较(n =15,±s)
组别 P100 波潜伏期/ms P100 振幅/u对照组右眼 96.89±4.48 12.39±1.98剥夺组右眼 121.31±8.44 9.63±0.84剥夺组左眼 99.70±2.29 12.09±1.05 F 值 38.872 8.428 P 值 0.000 0.003
2.2 免疫组织化学结果
对每张切片随机选择5个视野进行统计分析。可见两组幼猫外侧膝状体神经元中VIP 呈阳性表达,位于细胞浆内,呈棕黄色-淡黄色,细胞核呈蓝色。对照组大部分呈强阳性,阳性细胞数较多,剥夺组大部分呈中等阳性到弱阳性,阳性细胞数较少,可见两组VIP 蛋白表达存在差异(见图2)。两组阳性细胞数比较,经t检验,差异有统计学意义(P<0.05),剥夺组较对照组少。两组阳性细胞平均光密度值比较,经t检验,差异有统计学意义(P<0.05),剥夺组较对照组低。视觉剥夺性弱视幼猫外侧膝状体中VIP 蛋白表达较正常幼猫降低。见表2。

图2 6周龄外侧膝状体神经元中VIP 蛋白的表达(DAB×200)
2.3 原位杂交结果
对每张切片随机选择5个视野进行统计分析。两组幼猫外侧膝状体神经元中均有VIP mRNA 阳性表达,位于细胞浆内,呈棕黄色-淡黄色,同时与蓝染的细胞核重叠。对照组大部分呈强阳性,阳性细胞数较多,剥夺组大部分呈中等阳性到弱阳性,阳性细胞数较少,可见两组VIP mRNA表达存在差异(见图3)。两组阳性细胞数比较,经t检验,差异有统计学意义(P<0.05),剥夺组较对照组少。两组平均光密度值比较,经t检验,差异有统计学意义(P<0.05),剥夺组较对照组低见表3。视觉剥夺性弱视幼猫外侧膝状体中VIPmRNA 转录水平较正常幼猫下降。见表3。
表2 两组外侧膝状体中VIP 免疫组织化学结果比较(n =15,±s)

表2 两组外侧膝状体中VIP 免疫组织化学结果比较(n =15,±s)
组别 阳性细胞数/个 光密度值对照组 121.78±13.32 4 116.47±1 122.24剥夺组 53.44±40.98 2 138.07±1 765.78 t 值 4.758 2.837 P 值 0.000 0.000
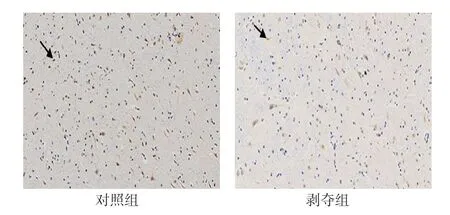
图3 6周龄外侧膝状体神经元中VIP mRNA的表达(DAB×200)
表3 两组外侧膝状体中VIP 原位杂交结果比较(n =15,±s)
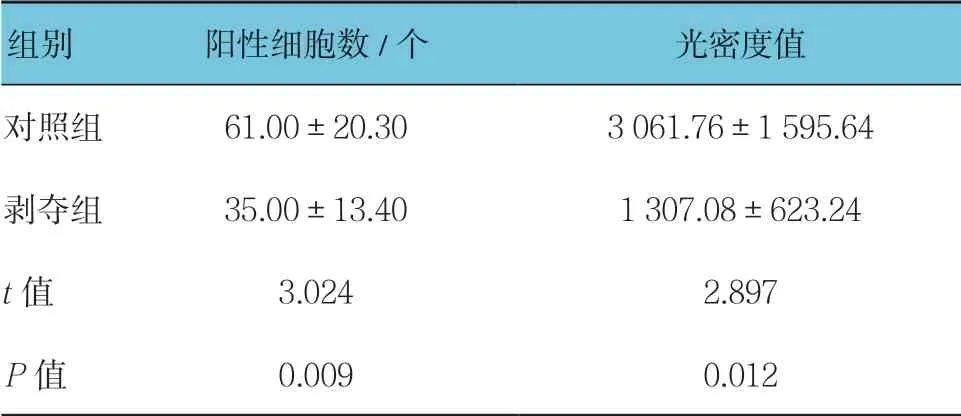
表3 两组外侧膝状体中VIP 原位杂交结果比较(n =15,±s)
组别 阳性细胞数/个 光密度值对照组 61.00±20.30 3 061.76±1 595.64剥夺组 35.00±13.40 1 307.08±623.24 t 值 3.024 2.897 P 值 0.009 0.012
3 讨论
本实验通过PEVP来确定剥夺组弱视的形成,然后用免疫组织化学和原位杂交来检测VIP在外侧膝状体中的表达变化。通过实验发现,幼猫在视觉发育敏感期内,由于双眼视觉信息的不对等输入,导致外侧膝状体中VIP表达降低;而VIP表达下降又对外侧膝状体正常表达的生理功能造成负面影响,从而影响视觉发育,促进弱视的发生、发展。
VIP 最早于1970年由猪小肠的甲醇抽提液中经过分离得到,其具有血管舒张活性,最初被认为是一种候选胃肠激素。后来发现其广泛分布于大脑皮质、眼内组织中[3-6],随后证明在外侧膝状体中也广泛存在[1]。VIP 主要作为神经递质起作用[7],能够促进神经细胞的有丝分裂,增加神经细胞突起的数量[8];同时促进前体细胞向神经元分化,提高成熟神经元的数量[9]。VIP 还影响血浆中胰多肽、脂联素及胰岛素等代谢调节激素的表达水平,进而影响细胞代谢[10]。以往学者认为,外侧膝状体仅仅作为视网膜神经传递的接受体,将来自视网膜的神经纤维束换能后传递至视皮层,其并不参与视觉功能的编码,视皮层才是弱视主要的神经系统受损部位。但后来发现外侧膝状体并不是单纯的神经传导中继站,其参与方向性等精细视觉的形成[11]。在单眼剥夺性弱视中,与剥夺眼同侧的外侧膝状体被观察到存在神经元活动减弱[12]和神经元萎缩[13]的现象,同时经弱视侧的外侧膝状体投射到视皮层17区、18区的神经元体积也减小[14]。而且单眼剥夺性弱视中,剥夺侧的外侧膝状体中细胞大小的改变与同侧视皮层第4 层中眼优势柱宽度的减少密切相关[15]。有研究发现,外侧膝状体与视皮层一样,在成年动物中仍然具有经验依赖的可塑性,其部分功能可以在弱视后得以恢复,提示外侧膝状体在弱视治疗中也应得到重点关注[16-18]。可见外侧膝状体在视觉神经系统的发育过程中不仅有神经传导作用,还有功能编辑作用。研究异常视觉体验对外侧膝状体中VIP表达的影响可以论证VIP在视觉发育中扮演的重要地位。
对于幼猫,视觉剥夺的影响程度在出生后1个月达到峰值,到3个月龄时,视觉剥夺对视觉发育的影响几乎为零[19]。本实验在视觉发育关键期内进行单眼视觉剥夺,通过PVEP 检测弱视的形成,这与目前普遍认为的弱视形成机制和诊断方式相一致。对照组右眼、剥夺组左眼与剥夺组右眼的P100波潜伏期和振幅比较有差异,说明实验组单眼弱视已形成,其中P100波潜伏期延长更能提示视路的传导存在问题;同时创新性的遮盖方式降低因传统眼睑缝合而增加皮损处感染的风险,避免定期PVEP 检测对眼睑皮肤的反复缝合造成诸如角膜刺激、缝线断裂等影响测试的不良后果。
本文分别从蛋白和基因层面证实视觉剥夺对外侧膝状体中VIP表达的影响。免疫组织化学结果表明,在幼猫视觉发育敏感期内的视觉剥夺,使外侧膝状体接受视网膜的视觉传入信号减弱,致使外侧膝状体中表达VIP的神经元得不到足够的视觉刺激信号,导致神经元的功能发育异常,蛋白表达能力降低。原位杂交实验结果则证明,视觉剥夺还影响外侧膝状体内源性VIP的产生,使神经元的细胞器编码、加工蛋白质的能力减弱。已知VIP 参与细胞内一系列磷酸化偶联反应,与受体结合后,通过环磷酸腺苷(cyclic adenosine mono phosphate,cAMP)依赖的蛋白激酶途径,促进葡萄糖的磷酸化和糖原分解,增强神经元的营养代谢。VIP 还可以促进腺苷酸环化酶的活化从而增加cAMP的作用[20]。在大脑皮层中,VIP和去甲肾上腺素相互协同,刺激皮层中cAMP的合成;同时VIP 还加速皮层神经元放电[21]。cAMP 作为细胞内重要的第二信使,是参与细胞内生物学功能和物质代谢的重要物质,其含量降低会影响细胞内磷酸化等多种胞内活动;同时VIP 缺乏导致视交叉上核神经元活动节律紊乱[22]。由此推测,视觉剥夺通过影响外侧膝状体中神经元的发育,致使VIP表达下降,而VIP 减少又使神经元的信号通路发生障碍,细胞内的能量代谢、糖代谢等活动均受到影响;同时神经元间的电传导受阻。所以VIP表达下降会导致外侧膝状体神经元功能发育不良,而代谢异常的神经元又影响外侧膝状体功能表达,从而促进弱视的形成。
综上所述,弱视的神经系统病理改变也发生在外侧膝状体;VIP在视觉发育中扮演着不可或缺的角色;异常视觉体验导致外侧膝状体中VIP表达下降是弱视的重要发病机制之一。此结果为下一步对VIP 外源性干预视觉剥夺性弱视幼猫,探索VIP 治疗弱视的药理效果提供实验基础。由于方法和实验条件的限制,本实验只研究VIP在外侧膝状体中表达的变化,而外侧膝状体中神经元的微观改变有待进一步观察。研究神经元相关细胞器的变化可以进一步明确VIP 对弱视形成的影响。

