循环肿瘤细胞在晚期食管鳞癌患者疗效评估中的临床价值*
李彦,胡正宇,李祥华,杨林
(安徽医科大学第一附属医院 1.肿瘤放疗科,2.普外科,安徽 合肥 230032)
中国是食管癌高发的国家,每年因肿瘤死亡的患者中,约有一半为食管癌患者[1]。食管癌是中国第5 大常见的肿瘤,也是病死率排名第4 的肿瘤[2]。对不具备手术指征的患者,同步放化疗为美国国立综合癌症网络(NCCN)指南中治疗的金标准[3]。患者的外周血中存在可自发扩散入血的肿瘤细胞,其已被定义为循环肿瘤细胞(circulating tumor cells, CTC)[4],2007年美国临床肿瘤学会(ASCO)将CTC 纳入肿瘤标志物,可用于证实肿瘤的存在、发病过程、评估患者的预后、识别患者接受治疗后的临床治疗效果;2010年美国癌症联合委员会(AJCC)将CTC 作为远端转移标准[M 分期,cM0(i+)]。本研究通过监测食管鳞癌患者外周血中CTC 的动态变化,评估CTC 与患者预后的相关性,进一步研究CTC 是否可作为食管鳞癌患者疗效评估的指标。
1 资料与方法
1.1 一般资料
选取2015年12月31 日—2016年12月31 日安徽 医科大学第一附属医院肿瘤放疗科的食管鳞癌患者38 例。其中,男性28 例,女性10 例;年龄46~90 岁,中位年龄72 岁。纳入标准:年龄≥20 岁的患者;经病 理或者细胞学确诊为食管鳞癌;患者自身情况不适宜手术,或术前评估病灶无法切除的Ⅲ期患者;出现远处寡转移的IV 期患者(任何T、N、M1、N3或T4b);具有临床易于观察的可测量病灶;ECOG 评分≤2,无严重合并症及放疗禁忌证;患者可自行理解且自愿参加并签署知情同意书。排除标准:合并其他恶性肿瘤的患者;放化疗不耐受的患者;有严重的心肺肝肾功能障碍。本研究经医院伦理委员会批准。
1.2 治疗方案
1.2.1 放疗方案 仪器设备采用6 MV X 射线,使用西门子直线加速器行单纯三维适行放疗;所有入组患者的放疗总剂量为DT:50 Gy/25 F(d1-33),1.8~ 2.0 Gy/次;GTV 包括食管癌原发病灶及肿大的淋巴结,CTV 包含GTV 及淋巴引流区;PTV:在CTV 的基础上各外放0.5 cm,以及勾画出需保护的周围重要脏器。
1.2.2 化疗方案 本研究中入组患者均采用TP 方案:紫杉醇135 mg/m2第1 天静脉滴注;顺铂20 mg/m2第1~ 5 天;放疗第1 天予以第1个周期化疗,放疗20 次左右行第2个周期化疗,放疗结束后继续行2个周期巩固化疗,28 d 为1个化疗周期。
1.3 CTC 的检测
本研究采用阴性富集法外周静脉血中筛检CTC,对每位研究对象,在放疗前7 d 内,同步放化疗疗程结束后的7 d 内均用真空采血管采集肘正中静脉血,采集3.2 ml 静脉血于ACD 抗凝管中,采血完毕后立即颠倒 混匀8 次。采集的血液在24 h 内去除血清,裂解液去除 红细胞,磁珠孵育混匀去除白细胞,分离液分离富集的肿瘤细胞。使用CD45 抗体进行细胞免疫荧光检测,8 F 着丝粒探针(CEP8)进行免疫荧光原位杂交(imFISH),CEP ≥3/DAPI+/CD45-,也即核内信号≥3 倍体,细胞核 DAPI 染色阳性,CD45 染色阴性定义为循环肿瘤细胞;CEP=2/DAPI+/CD45+为白细胞。见图1。

图1 CTC 镜下视野
1.4 CTC 值及CTC、CEA、CA125、CA199 差值 的定义
CTC>3个定义为CTC 阳性,CTC ≤3个定义为CTC 阴性[5-6]。放疗前后CTC 的差值dCTC=放疗前CTC-放疗后CTC,放疗前后CEA、CA125、CA199 的差值dCEA=放疗前CEA-放疗后CEA,dCA125=放疗前CA125-放疗后CA125,dCA199=放疗前CA199-放疗后CA199。
1.5 疗效评估
根据实体肿瘤的疗效评价标准RECIST 1.1 版,选取CT 所示食管病变最大层面的食管直径为靶病灶,评估食管癌患者同步放化疗前后靶病灶直径的变化[7]。
1.6 随访
对38 例患者进行放疗后维持2年的追踪随访。随访内容包括:体格检查,复查常规的血液学指标,颈、胸、腹部增强CT,依据检查结果评估患者是否复发。随访于2019年5月1 日截止。
1.7 统计学方法
数据分析采用SPSS 16.0 统计软件,计量资料以均数±标准差(±s)表示,符合正态分布的采用t检验,不符合正态分布的采用中位数和四分位数[M(P25,P75)]表示,比较采用秩和检验(Z检验),患者生存率比较用Kaplan-Meier 法及Log-rankχ2检验,运用Cox 回归模型筛选影响预后的独立影响因素,P< 0.05 为差异有统计学意义。
2 结果
2.1 放疗前后CTC 和随访指标的变化
本研究中38 例患者接受50 Gy 的放疗剂量联合同步化疗后,靶病灶直径均明显缩小(P<0.05),考虑50 Gy 的剂量即可达到临床缓解。放疗后的CTC、CEA、CA199、CA125 与放疗前比较,差异无统计学意义(P>0.05)。放疗前后白细胞,血红蛋白,白蛋白和血小板差异有统计学意义(P<0.05),肿瘤指标下降。见表1。
2.2 CTC 值与患者预后的生存分析
放疗前CTC 阴性患者与放疗前CTC 阳性的患者2年生存率比较,差异无统计学意义(χ2=2.743,P= 0.098)(见图2A);dCTC>0 与dCTC ≤0 患者生存曲 线提示两者2年生存率比较,差异有统计学意义(χ2= 10.844,P=0.001),即放疗后外周血CTC 数值未增加的 患者,预后较好(见图2B)。CEA、CA199、dCA125的取值对患者的预后无影响(见图2C、E、H)。放疗前CA125 值高于正常范围的患者预后明显优于CA125值低于正常范围的患者(χ2=15.989,P=0.000)(见图2G),dCTC、dCEA、dCA199、放疗前CA125 值对患者的2年生存率有影响。dCEA>0,dCA199>0 的患者生存期较dCEA ≤0,dCA199 ≤0 的患者生存期长(见图2D、F)。

表1 放化疗前后食管癌患者一般资料变化


图2 同步放化疗前后患者生存曲线比较
2.3 放化疗前后CTC 患者最大直径的比较
放化疗前后CTC 患者肿瘤最大直径比较,差异有统计学意义(P<0.05),放疗前后CTC 阳性患者靶病灶最大直径大于CTC 阴性患者。见表2。
2.4 多因素Cox 回归分析
将dCTC>0、CTC>3、dCEA>0、dCA199>0、放疗前 CA125>35 u/ml 值进行Cox 回归分析,结果显示dCTC>0 是食管癌患者同步放化疗后预后的独立影响因素[=3.970(95% CI:1.043,15.117),P=0.043],放疗前CA125>35 u/ml 也是入组患者预后的独立影响因素 [=31.642(95% CI:2.939,340.656),P=0.004]。见表3。
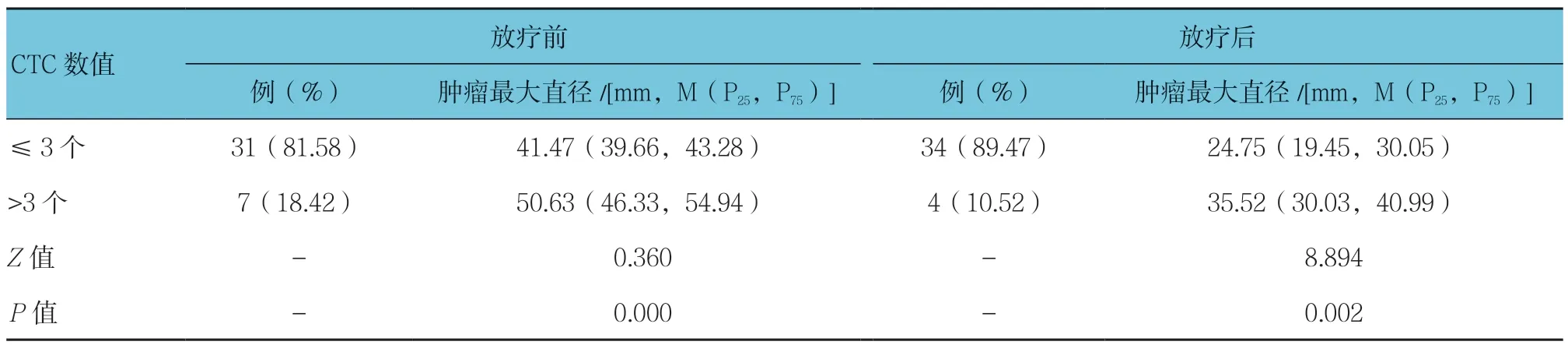
表2 放化疗前后CTC 患者最大直径的比较

表3 同步放化疗后食管癌患者预后的多因素分析参数
3 讨论
对不能手术的食管癌患者,同步放化疗是治疗的金标准,根据2018年NCCN 指南,50.0~50.4 Gy 剂量即可达到根治剂量。王玉芳等[8]指出,配合足够剂量的紫杉醇联合放疗,50 Gy 组和60 Gy 组无生存差异,且高剂量组副反应较大,难以耐受后续化疗,故本研究予以入组患者的放疗剂量为50 Gy,放疗后患者靶病灶最大直径与放疗前比较,差异有统计学意义,考虑50 Gy 即可达到有效局控,患者的CTC 值同样有差异,即50 Gy 剂量,患者血液循环中的肿瘤细胞较治疗前明显减少,认为该治疗方案有效。
本研究发现食管癌患者经过50 Gy 剂量放疗,联合TP 方案同步化疗后,CTC 值较治疗前总体降低,与许刚等[5]对食管癌患者同步放化疗后CTC 值变化相致,LIU 等[9]对食管癌手术患者也有相同发现,手术患者术后和术后3 天外周血中CTC 的含量较术前都下降。再次验证50 Gy 的剂量即可改善患者病情,局部控制肿瘤进展,为有效的治疗。
国内外已有多项研究表明,CTC 与胸部肿瘤预后具有明显相关性[10-12],对食管癌的患者,国内外相关文献提示CTC 可以作为判断食管癌预后的独立影响因素[13]。许刚等[5]认为,对食管癌患者放化疗前后的CTC 均与患者的预后密切相关,本研究结果提示食管癌放疗前CTC 与患者的预后相关性欠佳,经同步放化疗后,放疗前后CTC 的差值与患者预后明显相关,即食管癌局部晚期患者经同步放化疗后,CTC 值减少的患者预后较好,CTC 未见减少甚至增加的患者预后欠佳。经Cox 多因素分析显示,dCTC 为判断食管癌患者放化疗后预后的独立预后影响因素。CEA、CA199、dCA125 虽与患者的预后相关,但不能作为患者的预后独立影响因素,需结合其他指标共同判断。得到本结果的原因可能较放疗前CTC 的值,dCTC 更能体现治疗过程中CTC 值的动态变化,更能体现治疗在改善患者预后中的重要作用,即患者得到可改善预后的治疗后,CTC 值较前减少,预后得到改善。
本研究中的血清学指标CEA、CA125、CA199 均为消化道肿瘤的重要的肿瘤标志物,CA125 最早用于评估卵巢癌患者的复发及转移,同时也被多项研究指出可作为评估食管癌发生、发展的重要指标[14-15]。ZHAO 等[16]在其研究中指出CA125 可以预测食管鳞癌患者淋巴结的转移,血行转移,并是独立预后影响因素,且优于CA199 和CEA。在本研究中,通过对放疗前后肿瘤指标值的对比发现,放疗前CA125 值也可以作为食管癌患者同步放化疗后的患者预后的独立影响因素,与患者的预后密切相关。这可能与肿瘤细胞不仅可以合成CA125,且能主动将其分泌到细胞外相关[17],仍需更大样本量及专项的研究探讨。
综上所述,放疗前后CTC 的差值,放疗前CA125值可作为食管癌III、IV 期接受同步放化疗治疗患者预后的独立影响因素,本实验仍有许多不足,纳入患者的样本量尚有限,目前正在入组更多的患者,更大样本的实验正在设计中,同时将对患者进行更长时间的随访,日后将进行更深一步的探讨。

