涡虫神经再生相关基因及其调控通路
刘荣华,石晓宇,徐 风,赵东芹
(山东师范大学 生命科学学院,山东省动物抗性生物学重点实验室,山东 济南 250014)
神经系统在调节动物生理功能、控制动物行为上发挥着重要作用,因此解析动物生命活动过程和神经系统的再生是一个极具魅力又富有挑战性的问题。涡虫隶属于系统发育过程中最早具有由神经元组成的中枢神经系统(central nervous system,CNS)和两侧对称体制的扁形动物门[1-2]。组成其头部神经节——“脑”的神经元较其他高等无脊椎动物与脊椎动物具有更高的相似性[3-4],加上其独特的再生特性[5],已被用作研究神经、器官再生机制的模式生物[6-7]。目前,涡虫主要的模式种有地中海涡虫(Schmidteamediterranea)、日本三角涡虫(Dugesiajaponica)和Girardiatigrina三种[8]。国内对涡虫神经再生的研究起步较晚,可供参考的文献较少,最近的一篇综述是胡国安等[9]在2014年发表的。国外对涡虫神经再生的研究较深入,已经从分子水平上对涡虫神经再生的机制进行了探究,Ross等人[10]在2017年发表的综述中,总结了早期对涡虫神经系统的解剖和功能的研究,并讨论了目前对控制涡虫神经发生分子机制的认识。本文基于三种涡虫神经再生相关文献,着重对涡虫神经再生过程所涉及的基因及神经再生重要信号通路等内容进行论述,为探讨涡虫神经再生的分子机制和研究高等动物如人类神经系统的发育、神经相关疾病的治疗等提供背景资料。
1 涡虫神经系统解剖学结构
早期神经系统结构的染色方法主要包括Masson染色、H-E染色和Van Gieson染色,这三种方法均可清晰地显示涡虫神经系统结构[11]。随着基于神经特异性基因[12-13](如otd/otx相关基因)、神经特异性基因产物[14-15](如突触蛋白Ⅶ,乙酰胆碱受体)的原位杂交、抗原抗体组织学定位等技术对形态学分析的深入,学者不仅将涡虫的脑与神经索区分开来,还进一步将涡虫的脑分为多个不同的分子和功能区域。综合各种形态学研究结果,涡虫神经系统的形状是基本相同的,都由中枢神经系统(CNS)和外周神经系统(peripheral nervous system,PNS)两部分组成。CNS由神经元胞体和神经索构成,主要包括前部的一对“大脑”(或称为头部神经节,brain)、一对眼点(eyes)、两个贯穿身体全长的纵向腹神经索(ventral nerve cord,VNC)和连接左右的横神经(transverse commissures)。PNS由表皮下神经丛、肌下神经丛和胃胚层神经丛组成,表皮下神经丛是位于表皮和肌壁之间的稀疏网状结构。肌下神经丛位于肌壁下面,是由神经纤维束从交点向多个方向延伸形成的神经网络,较表皮神经丛更厚、更密集。胃胚层神经丛的解剖学还不太清楚,认为是由围绕肠的单根神经纤维的构成薄网[10]。
2 涡虫神经再生相关基因
涡虫的神经元较其他高等无脊椎动物与脊椎动物具有更高的相似性,因而从分子水平上研究其再生的机制可以为研究脊椎动物神经系统的发生提供依据。目前已发现20多个涡虫神经相关基因(表1),有趣的是,其中一些基因与已知的相同功能基因缺乏序列相似性[16],这些特异性基因的表达可以作为CNS神经标记来阐明神经再生的机制,有助于我们直接定义涡虫中枢神经系统再生中可能的功能域。
表1 表达于CNS的部分基因Tab.1 Some genes expressed within the planarian CNS

基因蛋白主要表达部位功能物种DjotxA[12]DjotxA protein脑中部建立和维持大脑离散区域D. japonicaDjotxB[12]DjotxB protein脑中部建立和维持大脑离散区域D. japonicaDjotp[12]脑前侧枝建立和维持大脑离散区域D. japonica944-HH[13]脑神经节;腹神经索D. japonica1008-HH[13,17]脑侧枝D. japonica1020-HH[13]1020HH脑神经节D. japonica721-HH[13]脑神经节;其他头部细胞D. japonicaEye53[13]Eye53脑神经节;视觉细胞;腹神经索周围细胞D. japonica4307HH[17-18]脑神经节;腹神经索D. japonicaDjCAM[17,19]Cell adhesion molecule脑神经节;腹神经索参与轴突的形成D. japonicaDjDSCAM[17,19]Down syndrome cell adhesion molecule脑神经节参与神经元细胞迁移,轴突生长、成束状和投射D. japonicaDjCHC[17,20]Clathrin heavy chain神经突起组成的海绵状区域参与头部的再生与维持D. japonicaDjeya[17,21]Eyes absent homolog, EC 3.1.3.48光感受器,脑神经节内侧和外侧参与眼部细胞再生D. japonicaDjsix-1[21]Djsix-1光感受器参与眼部细胞再生D. japonicaDjFoxG[17,22]Winged helix/forkhead tran-scription factor脑神经节D. japonicaDjFoxD[22]Winged helix/forkhead tran-scription factor头前部正中线部分D. japonicaDjPC2[17,22]脑神经节;腹神经索D. japonicaDjnlg[17,23]Noggin like protein脑侧枝背腹轴形成D. japonicaDjPsa[24]M1 zinc metallopeptidase family脑神经节;腹神经索参与脑原基分化和脑的形成D. japonica
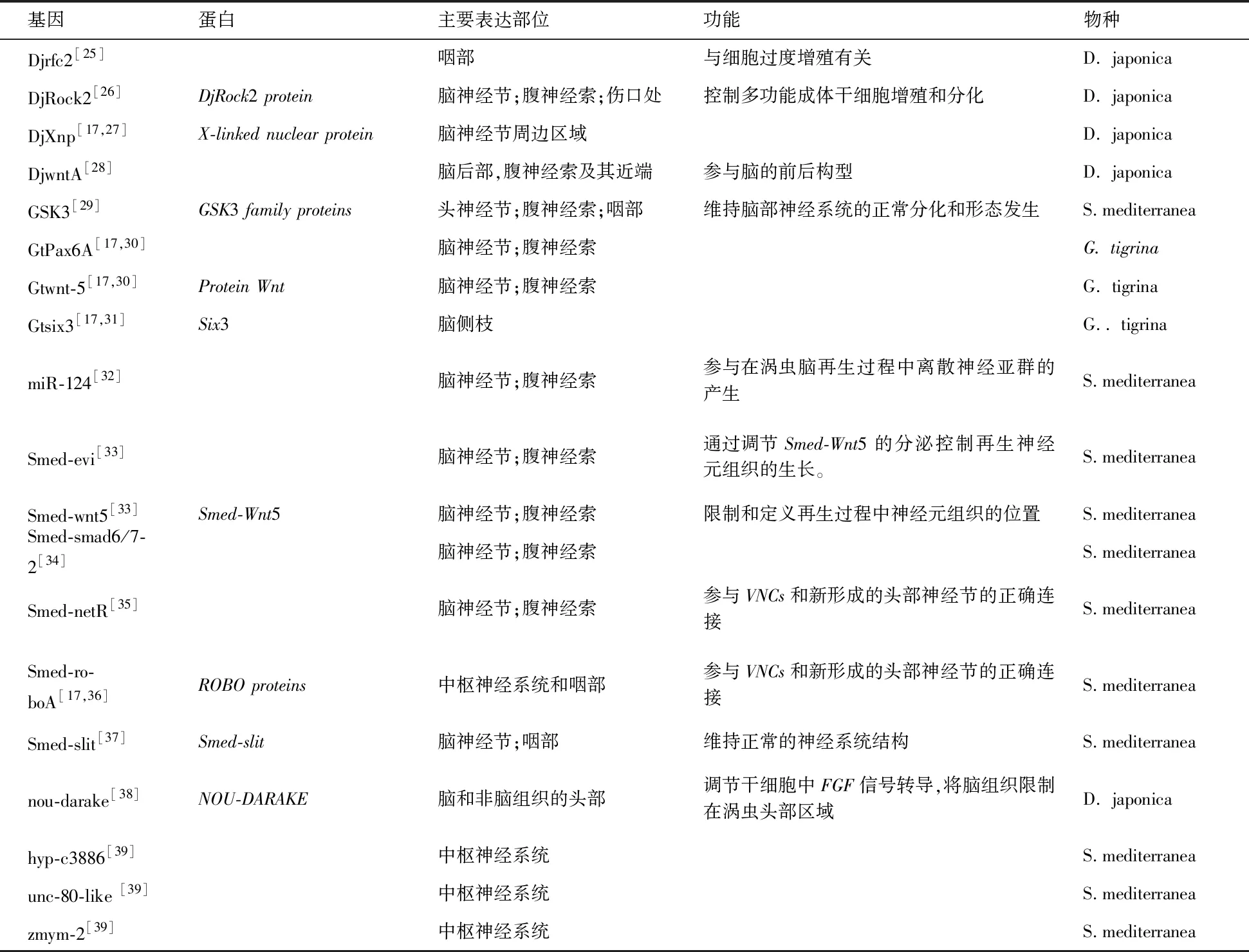
表1(续)
2.1 细胞调控基因
涡虫-网格蛋白重链基因(planarianclathrinheavychaingene, DjCHC)对于中枢神经系统的正常再生和内环境稳定是必需的。体外和体内分析结果显示DjCHCRNA干扰(RNAinterference,RNAi)会抑制神经元存活、神经突起生长,同时相关实验结果说明DjCHCRNAi引起的中枢神经系统萎缩是由于对分化神经元细胞的作用而不是对干细胞的影响[20]。
noggin样基因(noggin-likegene, Djnlg)参与涡虫再生期间背腹轴(dorsoventral,DV)信号系统的建立,通过与BMP相互作用刺激胚泡形成和DV图案化,这个过程也发生在脊椎动物胚胎发生过程中[23]。
涡虫截头后,脑再生的关键事件包括干细胞新生细胞增殖、脑原基形成以及脑细胞分化[40]。DjPsa沉默会抑制分化为新脑的初始神经元簇的形成,DjPsaRNAi处理的涡虫的再生脑区较正常再生脑薄,且10d时脑神经间U形仍未闭合[24]。这些结果表明DjPsa参与再生早期脑原基的形成,并与脑细胞的分化以及正常脑的形成有关。nou-darake(ndk)对头部的再生也有重要作用[38]。注射ndkdsRNA的再生涡虫,早期的再生阶段是正常的,分化产生新的脑样结构胚泡;但在再生的第4~5d,脑样结构胚泡在形成脑部位之外分化,并且随着再生的进行,异位脑逐渐扩大进入更多的后部区域。研究还发现注射ndkdsRNA后,在完整、非再生的涡虫中也观察到异位脑组织的分化。ndk可以限制脑诱导因子从涡虫头部到身体其他部位的扩散,ndk功能的丧失使限制脑诱导因子扩散到后部区域,从而触发异位脑的形成。
复制因子C(replicationfactorC,RFC)在DNA损伤反应和DNA修复过程中通过协助DNA精确复制确保了生物过程中基因组的稳定性。Rfc2是RFC的亚单位之一,在涡虫中由Djrfc2表达。通过蛋白质组学方法对完整和再生涡虫中差异表达蛋白鉴别和分析,发现Rfc2的分布倾向于受伤部位。对Djrfc2进行RNAi处理,发现分裂细胞的数量增加,涡虫新胚叶中标记基因的的表达水平升高,进而导致过度增生[25]。
Dj-Rho激酶2基因(Dj-Rhoassociatedproteinkinase2, DjRock2)存在于CNS中且特异表达,尤其是头部神经节处,主要作用是有助于视神经的形成及维持。推测可能是通过调节Rock经典信号通路,进一步调节肌球蛋白轻链(myosinlightchain,MLC)控制多功能成体干细胞增殖和分化,达到调节再生的目的[26]。
糖原合酶激酶-3基因(glycogenaseki-nase-3gene, GSK3)产物GSK3是已知参与神经元组织的几个信号级联中的关键元件。用GSK3抑制剂1-azaken-paullone处理涡虫后发现这些动物中的头部神经节比正常组小,并且中间连接断开,视觉轴突基因异位表达,但咽部能再生正常,说明GSK3基因的主要功能是维持脑部神经系统的正常分化和形态发生[29]。
2.2 神经再生轴突导向因子
轴突导向即为在神经发育过程中,神经元发出轴突并在正确位置形成突触,保守的轴突导向机制对于动物早期发育过程中神经系统的适当布局是必需的[36]。在中枢神经再生过程中,受损的轴突需要向其原始目标突起,从而重建正确的功能连接。
使用RNA干扰的功能分析表明,DjCAM部分参与轴突形成,DjDSCAM在神经元细胞迁移,轴突生长、成束状和投射中起着至关重要的作用[19]。在没有DjCAM或DjDSCAM表达的情况下,一些构成脑侧枝的神经元未能产生轴突束,脑侧枝数目明显减少,投射也出现了严重的异常[19]。
在中枢神经系统再生的轴突投射过程中,DjCHC可能也是需要的。DjCHC沉默不抑制视神经元的分化,但是左、右视神经元向相反视神经元的投射和视神经到大脑的连接被抑制[20]。
Smed-netR和Smed-roboA可能在建立头部神经节与VNC之间的正确关系中起重要作用[35-36]。在实施Smed-netRRNAi之后,再生涡虫大脑和VNC之间的关联有些丢失,新的大脑和VNCs的模式被破坏:VNCs在脑下形成了紊乱的神经网络,新的头部神经节更短、更宽并延伸到VNCs更旁侧[35]。此外,Smed-netR还在光感受器轴突靶向投射到大脑视觉中枢中起着重要作用[36]。在Smed-roboARNAi之后,VNCs和新形成的头部神经节没有正确连接,并且在前部再生过程中,观察到额外的咽的发育和在新再生的头部区域与已存在的咽之间的一个背部外露。Smed-roboA沉默还导致连接两个头神经节的前连合明显变少,并且在某些情况下前连合完全丧失[36]。
2.3 三种涡虫神经再生过程中相关基因比较
S.mediterranea中的Smed-wnt5与G.tigrina中的Gtwnt-5编码同源蛋白,Smed-wnt5限制和定义再生过程中神经元组织的位置;在再生5d时,在靠近伤口的神经索中发现Gtwnt-5表达增加,推测这可能与该区域重塑到新脑神经节的后部有关[30,33]。D.japonica中的DjwntA与S.mediterranea中的Smed-wntA不仅编码同源蛋白,而且沉默这两个基因在涡虫再生中导致相似的结果,即再生出的新脑与正常脑相比长度加长以及视觉中心的异常[28,33]。Pax6A和Pax6B在D.japonica和G.tigrina的再生过程中都有表达,在再生3-6 d后,可以在囊胚的弓形结构中检测到Pax6A的表达,可能是由于这两种动物的神经节形态不同,这种弓形表达模式在G.tigrina中更清楚[41]。
3 涡虫神经再生重要信号通路
鉴定启动和指导过程的信号可有助于更好地了解再生过程。
3.1 Wnt信号通路
Wnt信号通路包括经典Wnt信号通路和非经典Wnt信号通路。经典Wnt信号通路即Wnt/β-catenin信号通路,非经典Wnt信号通路主要包括Wnt-Ca2+信号通路、平面极细胞通路及调节纺锤体的方向和非对称细胞分裂的胞内通路[42]。涡虫Wnt/β-catenin信号在涡虫再生过程中,对再生极性的决定起着重要的作用[8]。wnt基因对涡虫的前后轴、中侧轴的建立、脑部以及神经系统的形成等有关,其中,wnt5和wnt11-6与神经系统发育有关,Smed-wnt5在中侧轴的建立中起作用,可以抑制神经系统和中间组织向两侧的扩展,RNAi该基因的涡虫出现偏离的头部神经节以及膨大的再生神经组织,wnt5家族与非经典Wnt信号途径有关,不依赖于β-catenin[8]。Smed-wnt11-6在脑前部的A-P轴的形成包括腹索神经索的形成中起作用,但不影响脑部中侧轴的形成[8]。
3.2 BMP信号通路
BMP信号传导作为一种典型信号通路,参与了众多发育事件。其中,有三种基因参与了涡虫左右不对称形状的再生,分别是BMP1/Tolloid-like基因(smedolloid-1)、SMAD4-like基因(smedsmad4-1)和BMP2/4/DPP-like基因(smedbmp4-1)[43]。smedolloid-1在背部背侧细胞中表达,smedbmp4-1在背中线细胞中表达,研究显示,缺乏左右对称的受伤涡虫,在早期再生中会通过调节BMP活性来形成新的中线,如果SMEDBMP4-1信号转导受扰,手术产生的缺乏左右对称性的涡虫片段不能正常再生[43]。Smed-BMPRNAi处理的涡虫再生了额外的光感受器,并且,视觉轴突的在前部异位投射,脑的腹面出现向背部的膨大[44]。
3.3 Hedgehog信号通路
在脊椎动物中,Hedgehog(HH)信号介导的许多发育事件,除了在脊髓腹侧模式中作为形态发生因子的作用,还包括少突胶质细胞的产生及其在控制神经祖细胞增殖中的促分裂作用[45]。Patched(ptc)是HH信号靶细胞膜上一种受体,对HH信号的表达起负调控的作用[46]。这种受体是日本三角涡虫头部再生所必需的[47]。此外,在涡虫再生过程中,HH信号通过调节Wnt家族基因的转录,来建立的前后(anterior-posterior,AP)极性从而进一步指导头部或者尾部的再生[47]。
4 总结与展望
扁形动物是左右对称、具有真正突触和脑的动物,涡虫作为扁形动物中自由生活种类,因其再生能力强、再生周期短、易饲养等特性在研究神经、器官再生及其机制中占有独特的地位。目前关于涡虫神经的研究多限于正常生境下、成体涡虫的神经系统,异常生境下、胚胎发育及再生过程中这些再生相关基因是如何对神经系统的重建进行时空调控的?受损或受伤神经是如何重新建立正确的突触联系并整合到原有神经环路中的?调控通路又是如何呢?这些问题均还尚不清楚。此外,扁形动物很多典型的神经再生调控因子在高等生物中高度保守,所以了解涡虫神经再生过程所涉及的基因分布有助于选择CNS和PNS特异性基因进行神经标记,有助于探讨涡虫中枢神经系统再生中可能的功能域,探究涡虫神经再生的分子机制,为研究高等动物包括人类神经系统的发育、神经相关疾病的治疗等提供背景资料。

