氧化锆基微量元素共掺杂羟基磷灰石增韧涂层研究
代钊, 王铭, 王双, 李静, 陈翔, 汪大林, 祝迎春
氧化锆基微量元素共掺杂羟基磷灰石增韧涂层研究
代钊1, 王铭2, 王双1, 李静1, 陈翔1, 汪大林1, 祝迎春2
(1. 上海第二军医大学附属长海医院, 上海 200433; 2. 中国科学院 上海硅酸盐研究所, 中国科学院特种无机涂层重点实验室, 上海 200050)
氧化锆陶瓷具有良好的力学性能和生物相容性, 是一种应用前景广阔的硬组织植入体材料。为促进植入体与骨组织形成稳定的骨结合, 本研究利用等离子喷涂制备了氧化锆增韧的锶、硅、氟微量掺杂羟基磷灰石(ZrO2-DHA)涂层, 对涂层物相、形貌以及力学性能和体外生物学性能进行了研究。结果表明, 锶、硅、氟的共掺杂通过成骨分化的信号转导通路提高了羟基磷灰石涂层对成骨细胞的黏附和分化等生物学性能; 不同复合组分的ZrO2-DHA涂层均不同程度地促进了小鼠成骨前体细胞的细胞活力和成骨分化相关基因的表达。在细胞培养的第7 d, DHA含量为70%的ZrO2-DHA涂层(7DHA)和的相对表达量分别是对照组的约2.8倍和2.3倍; ZrO2-DHA涂层的力学性能随氧化锆组分的增加而增强, DHA涂层和7DHA涂层的硬度和结合强度分别为250.8、313 HV和25.1、31.8 MPa; 7DHA涂层中的交织网络结构, 对残余热应力、压应力和拉伸力的承受能力较DHA涂层明显提升, 满足植入体应用需求。
锶、硅、氟微量掺杂羟基磷灰石; 等离子喷涂; 氧化锆增韧; 力学性能; 成骨
近年来, 氧化锆(Zirconia, ZrO2)陶瓷作为硬组织植入物受到了持续关注, 在口腔植入体方面的应用逐渐增加。氧化锆陶瓷具有优异的断裂韧性、弹性模量[1-3], 能够耐受长期负荷, 其生物相容性也早已得到证实[4-5]。此外, 氧化锆还能够满足患者日益提高的美学要求, 避免钛金属引起的潜在健康危害, 如植入体周围炎症、过敏反应等[6-8]。然而氧化锆属于生物惰性陶瓷, 在其表面制备生物活性涂层是促进植入体早期骨整合的有效方法。
羟基磷灰石(hydroxyapatite, HA)作为植入体涂层材料已有多年临床应用, 是一种与人体骨磷灰石结构类似的人工合成钙磷陶瓷材料。而天然羟基磷灰石含有除钙磷以外其他多种微量元素, 微量元素掺杂的羟基磷灰石(DHA)与人体骨磷灰石结构更接近, 且已被证明具有更优越的生物活性和更少的植入物炎症反应[9], 前期进行的微量元素掺杂羟基磷灰石研究印证了上述观点[10-14]。然而, 磷灰石的高度脆性使其在频繁承载负荷后发生过早的磨损和断裂, 影响性能发挥的持久性。引入力学性能优良的增韧材料制备复合涂层, 是目前改进这一缺陷的有效方法[15-17]。
目前已上市的氧化锆植入体几乎均未使用涂层[18], 且尚未见氧化锆植入体上制备羟基磷灰石涂层相关研究。本研究将锶、硅、氟微量掺杂羟基磷灰石(DHA)与氧化锆按不同比例复合, 通过等离子喷涂法在氧化锆基体上制备氧化锆增韧的锶、硅、氟微量掺杂羟基磷灰石(ZrO2-DHA)复合涂层, 并对涂层的力学性能和体外生物学性能进行了研究。
1 实验方法
1.1 试剂和材料
氧化锆基材10 mm×2 mm和25.4 mm×2.5 mm、氧化锆粉体分别购自苏州阿洛泰和江苏立达公司, 分析级Ca(H2PO4)2·H2O、Ca(OH)2、SrO、SiO2、CaF2和生物级4-硝基苯磷酸二钠(PNPP)、噻唑蓝(MTT)、二甲基亚砜(DMSO)购自上海阿拉丁公司。小鼠成骨前体细胞MC3T3-E1购自中科院细胞库, α-MEM培养基、青–链双抗购自赛默飞世尔, 胎牛血清购自杭州四季青,-甘油磷酸钠(-GP)、抗坏血酸(AA)购自西格玛奥德里奇, 茜素红S染色液购自北京索莱宝。
1.2 实验方法
1.2.1 涂层的制备
以Ca(OH)2和Ca(H2PO4)2∙H2O为原料, 以SrO、SiO2和CaF2为微量元素引入剂, 水热法合成HA和DHA。三种元素的掺杂量按照既往研究[12]投料, 使其在DHA中的质量分数与天然骨磷灰石保持一 致[19-21]。采用喷雾造粒法制备热喷涂粉, 其中, DHA和ZrO2分别按照质量比为7 : 3、5 : 5、3 : 7复合造粒。氧化锆基材经喷砂增加表面粗糙度, 然后使用大气等离子喷涂设备(Dualumsch. Wasser, Sulzer Metco, Switzerland)按照表1中喷涂参数制备HA/DHA涂层和质量比分别为7 : 3、5 : 5、3 : 7的ZrO2-DHA涂层(分别记为7DHA、5DHA、3DHA)。将得到的涂层样品在650 ℃晶化处理2 h, 备用。
1.2.2 表征和力学性能
X射线衍射仪(UltimaⅣ, Rigaku, Japan)和傅里叶变换红外光谱仪(IRAffinity-1, Shimadzu, Japan)检测样品相组成。扫描电镜(s-4800, Hitachi, Japan)和光学显微镜观察涂层表面和截面形貌。力学性能实验设7DHA、5DHA、3DHA涂层实验组和DHA涂层对照组。维氏硬度计(HMV-G21DT, Shimadzu, Japan)和万能试验机(UTM 5592-F2-G2, Instron, USA)检测涂层硬度和结合强度: 硬度检测随机选择涂层表面10个点测硬度值, 万能试验机检测每组5个样品的涂层结合强度, 结果用(¯±s)表示。
1.2.3 体外生物学性能检测
(1) 实验分组、细胞培养和涂层浸提液制备
体外生物学性能实验增加空白对照组、ZrO2基材组和阳性对照组(HA涂层)。小鼠成骨前体细胞在37 ℃、5% CO2条件下培养, 每2 d换液一次, 确保生长状态良好。参照国家标准GBT16886.12-2017[22],制备涂层浸提液。

表1 喷涂参数
(2) 细胞活力实验和毒性评级
涂层样品灭菌后置于24孔板, MC3T3-E1以4× 104Cells/well接种, 细胞贴壁后更换低血清培养基(含0.5%胎牛血清的基础培养基)孵育24 h, 避光加入100 μL浓度为5 mg/mL的MTT母液, 细胞继续培养4 h后吸出孔内液体, 加入500 μL DMSO充分溶解结晶, 吸取300 μL紫色液体至96孔板, 酶标仪(Multiskan FC, Thermo Fisher)检测490 nm的吸光度。通过计算细胞相对增值率(Relative Growth Rate, RGR)来评价涂层细胞毒性, 即RGR=(涂层组吸光度值/基材对照组吸光度值)×100%。若RGR≥100%, 则细胞毒性为0级。
(3) 细胞黏附实验
相同方法接种多孔板, 在接种1、6和12 h后吸去培养液, 加入500 μL 4%多聚甲醛固定15 min, PBS冲洗2次, 避光加入300 μL DAPI荧光染液, 倒置荧光显微镜(TH4-200, Olympus, Japan)下观察, 每个样品随机选取5个不同视野拍照并计数细胞, 细胞数用(¯±s)表示。
(4) 碱性磷酸酶活性实验
相同方法接种多孔板, 细胞贴壁后更换成骨诱导分化培养基, 每2 d换液一次, 于第1、7 d终止培养, 加入0.2%曲拉通200 μL裂解细胞, 收集细胞裂解液离心, 吸取上清液50 μL至96孔板, 加入100 μL浓度为1 mg/mL的PNPP工作液, 细胞培养条件继续孵育30 min后用酶标仪检测405 nm吸光度ODALP。BCA蛋白试剂盒检测各孔总蛋白量(mg), ODALP/总蛋白值用(¯±s)表示。
(5) 成骨分化相关基因表达实验
相同方法接种多孔板, 细胞贴壁后更换诱导分化培养液, 每2 d换液一次, 于第1、7 d终止培养, 加入1 mL Trizol抽提细胞总RNA, 反转录合成cDNA, 荧光定量PCR仪(Step one plus, ABI, USA)扩增成骨分化相关基因、和内参基因(引物序列见表2), 得到Ct值, 使用ΔCt法计算各组各基因的相对表达量。
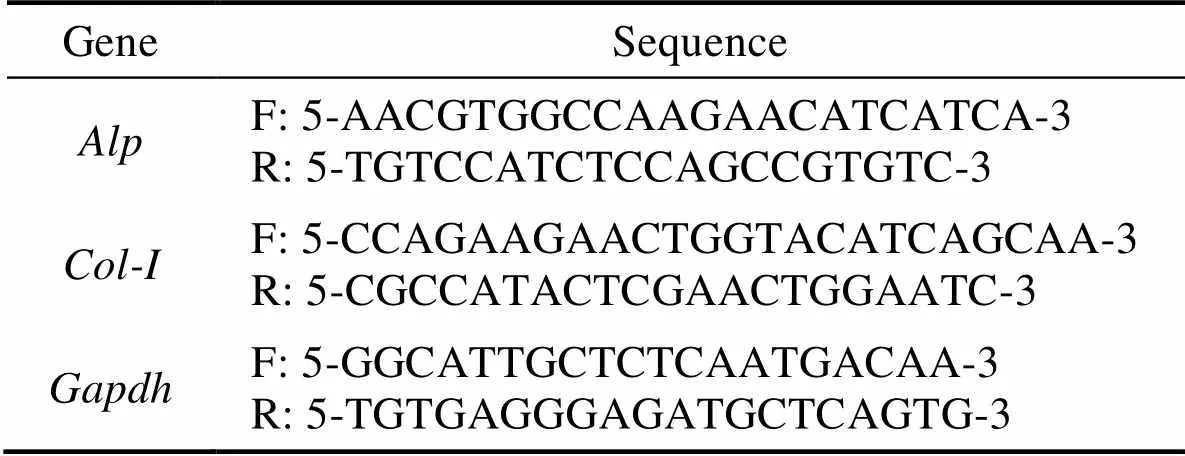
表2 引物序列
(6) 成骨矿化染色实验
相同方法接种多孔板, 细胞贴壁后更换涂层浸提液, 每2 d换液一次, 于第14 d终止培养,每孔加入4%多聚甲醛500 μL固定15 min, PBS清洗2次后加入茜素红S染色液200 μL避光染色15 min, PBS清洗至清洗液无色, 于倒置显微镜下观察拍照。
1.2.4 数据处理
所得数据及图像用Jade6.5、OMNIC32、Microsoft Excel和Origin2018软件处理、作图。2组之间比较用t检验,<0.05为具有显著性。
2 实验结果
2.1 粉体和涂层结构表征
图1(a)可见经喷砂处理后, 氧化锆基材呈现出不规则粗糙表面, 该表面有利于喷涂粉体与基材之间形成稳固的结合。图1(b)可见高温熔融的液滴状颗粒堆积而成的涂层表面, DHA粉体熔融状态良好, 呈现等离子喷涂涂层表面形貌特征。图中可见涂层微裂纹, 有助于释放涂层内应力, 防止涂层剥落, 提高结合强度。涂层的粗糙表面有利于细胞的黏附、生长。
图2(a~c)分别为7DHA涂层表面抛光后的SEM照片及Ca (绿色)、Zr (蓝色)元素分布的SEM照片, 深灰色区域(A)为含Ca的DHA, 灰白色区域(B)为ZrO2。图2(d~f)和图2(g~i)分别是DHA、7DHA、3DHA涂层的平面和截面照片, 可见DHA和ZrO2在涂层的三维结构中呈现相互交错和包绕状态。
图3(a)是HA和DHA粉体的XRD图谱, 符合羟基磷灰石标准谱(JCPDS No.09-0432), 表明本实验合成了羟基磷灰石材料; 插图为2=30°~35°的局部放大, 可见DHA峰位出现了右移, 说明元素的引入使DHA发生了晶格畸变。图3(b)为两者的FT-IR图谱, 图中可见羟基磷灰石的PO43–v4 (569、604 cm–1)、PO43–v3 (962、1042、1092 cm–1)和OH–(631 cm–1)的振动峰, 以及719 cm–1处的OH‧F键振动峰。图3(c)是三种组分ZrO2-DHA涂层的XRD图谱, 三者具有相似的衍射峰相, 氧化锆特征峰随其含量增加而增强。图3(d)是放大的7DHA涂层的XRD图谱, 可见明显的羟基磷灰石和氧化锆衍射峰, 未见其他杂质峰相。

图1 氧化锆基材(a)和DHA涂层表面(b)的SEM照片

图2 7DHA涂层的SEM照片(a)和元素分布扫描照片(Ca(b)和Zr(c)); 涂层平面(d~f)和截面(g~i)的SEM照片: DHA(d, g)、7DHA (e, h)、3DHA (f, i)
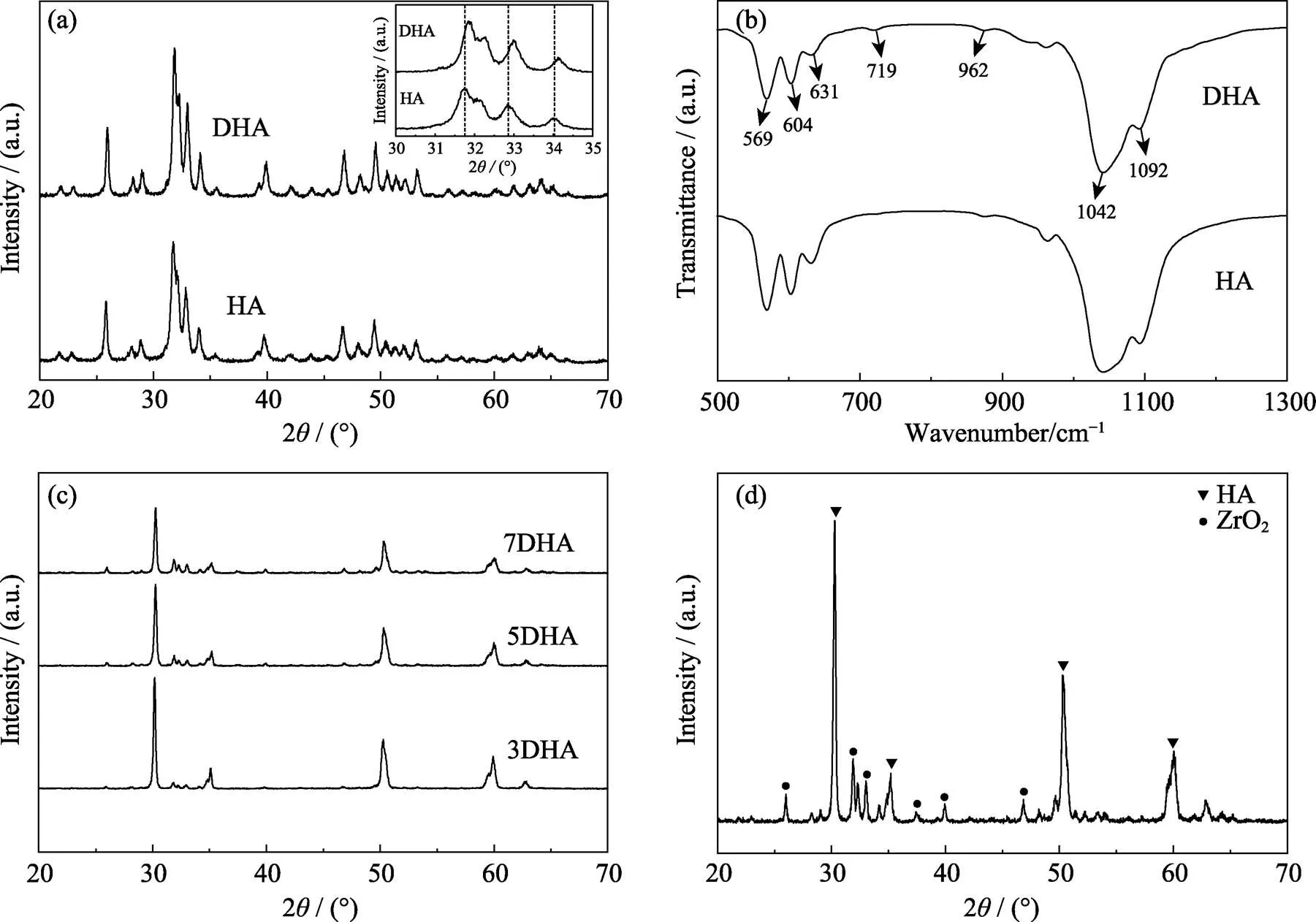
图3 HA和DHA粉体的XRD图谱(a)及FT-IR谱图 (b), DHA涂层的XRD图谱(c)及7DHA涂层的放大XRD图谱(d)
2.2 涂层力学性能
图4(a)可见, 涂层硬度和结合强度随氧化锆含量的增加而增大, 其中, DHA涂层的硬度和结合强度分别达到(250.8±18.9) HV和(25.1±2.6) MPa, 3DHA涂层的硬度和结合强度达到(526.2±23.6) HV和(46.2± 4.3) MPa。不同涂层组的硬度值和结合强度值之间的差异具有统计学意义。图4(b)为5DHA涂层的拉伸断面照片, 图中可见, 涂层拉伸断面出现在基材–涂层界面、涂层内部及涂层–胶水界面, 表明ZrO2-DHA涂层的拉伸断裂属于混合型失效模式。
2.3 涂层体外生物学性能
2.3.1 涂层对细胞活力的影响
图5表示经过24 h低血清培养后各组样品对MC3T3-E1细胞活力的影响。DHA组、7DHA组、HA组和氧化锆基材组的OD值分别为(0.46±0.02)、(0.44±0.02)、(0.39±0.01)和(0.37±0.01), 各组差异存在统计学意义, 表明DHA涂层和7DHA涂层组与HA涂层和氧化锆基材组相比, 具有较高的细胞活力。相对于氧化锆基材, 各种DHA含量涂层的RGR均大于100%, DHA涂层的最大值达到125.3%, 提示各涂层的细胞毒性评级均为0级。

图4 涂层显微硬度、结合强度(a)以及拉伸断面照片(b)
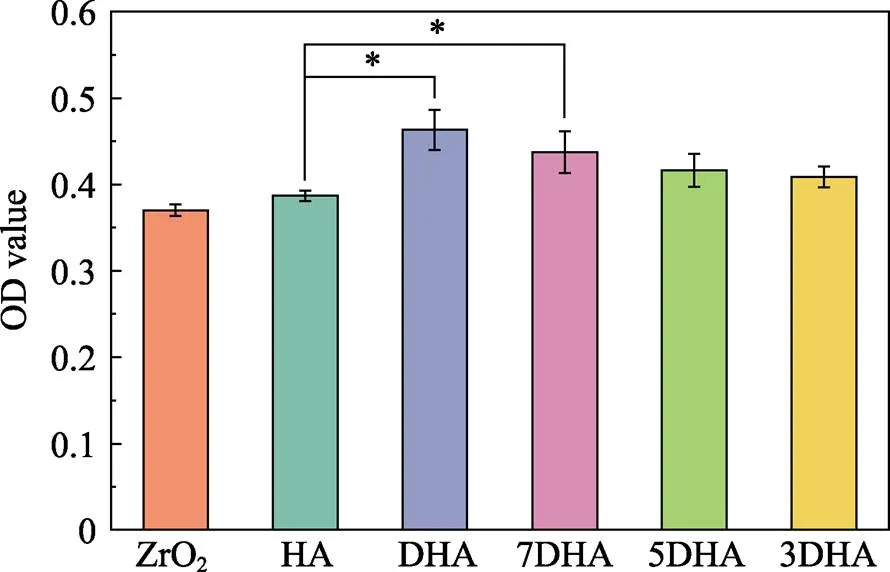
图5 细胞活力实验OD值
2.3.2 涂层对细胞黏附的影响
图6(a~f)是各组样品在细胞接种后第6 h的细胞黏附照片, 蓝色斑点为荧光染液着色的细胞核。图6(g)是各组样品在三个时间点细胞黏附数量柱状图。在第6 h, HA组、DHA组和7DHA组的细胞粘附数量分别为29.40、41.60和39.20, 后两组明显高于前者, 差异具有统计学意义; 但5DHA组和3DHA组的细胞黏附数量分别为30.20、29.00, 与HA组相比未见明显差异。在第1和12 h可见相同的趋势。DHA涂层和7DHA涂层与HA涂层相比促进了成骨细胞的黏附, 而随着ZrO2含量的增加, 促进作用逐渐减弱。
2.3.3 涂层对细胞成骨细胞分化的影响
图7(a~f)是培养14 d的MC3T3-E1茜素红S染色照片, 可见DHA组矿化最明显, 其次为7DHA组, 两组结果均优于其他各组。图7(g)是MC3T3-E1培养1、7 d后的碱性磷酸酶活性柱状图。可见随培养时间的延长, ALP活性逐渐增强; 在第7 d, DHA组和7DHA组的ALP活性分别达到(0.96±0.02)和(0.89± 0.01) OD/mg, 明显高于HA组的(0.82±0.01) OD/mg, 差异具有统计学意义。矿化染色实验和ALP活性实验提示, DHA涂层和7DHA涂层促进成骨分化能力优于HA涂层。

图6 细胞黏附实验的荧光照片(a~f)和细胞黏附数量(g)
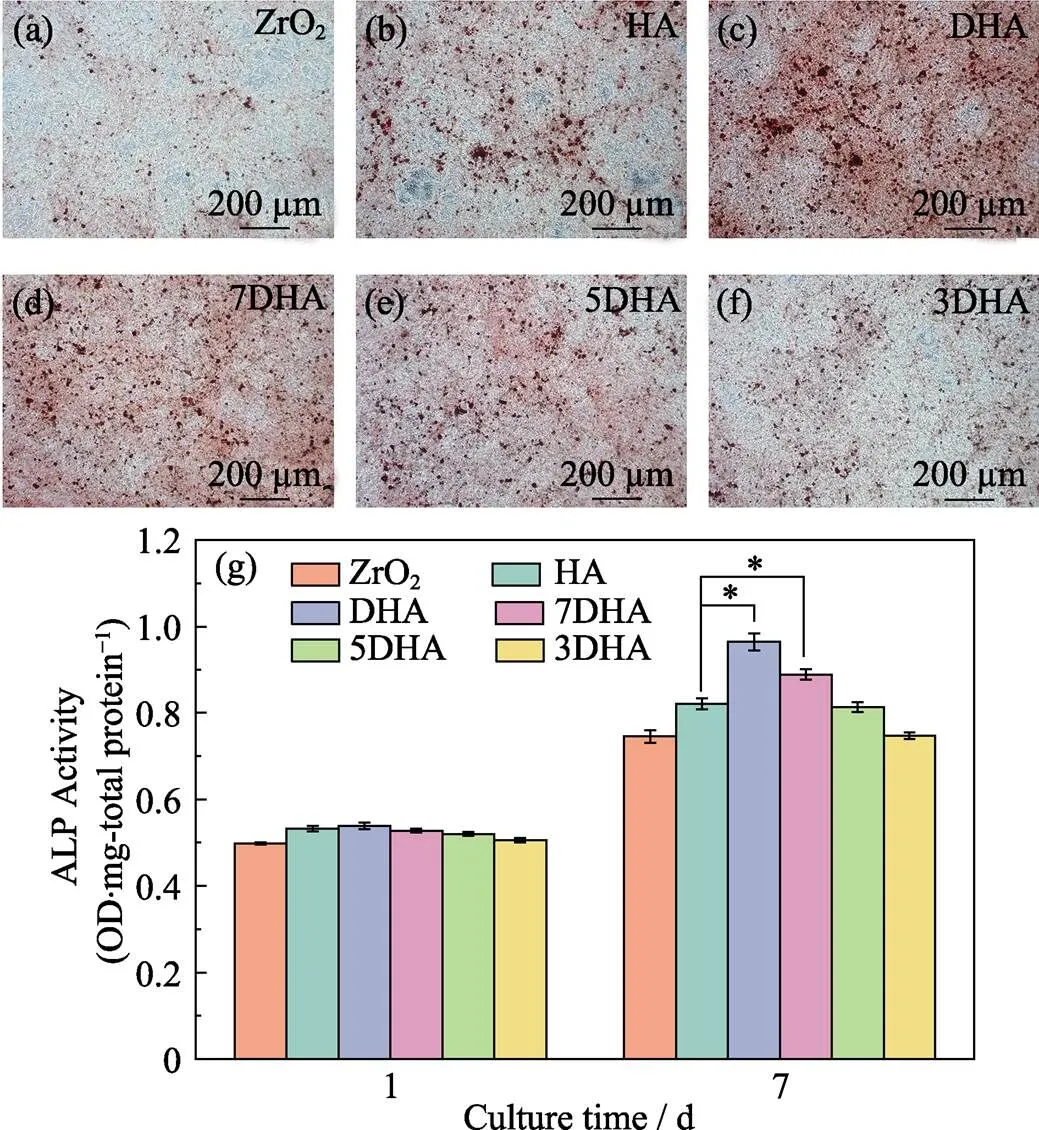
图7 MC3T3-E1细胞茜素红染色照片(a~f)和ALP活性比较(g)
2.3.4 涂层对细胞成骨分化相关基因表达的影响
成骨分化相关基因和的相对表达见图8。图8(a)可见, 在细胞培养的第1 d, 各组表达几乎未见差别。在细胞培养的第7 d, DHA组和7DHA组的相对表达量分别达到3.35和2.84, 明显高于HA组的2.51, 差异具有统计学意义。图8(b)中,的表达情况与出现相同的趋势, 提示与HA涂层相比, DHA涂层和7DHA组可促进成骨细胞早期表达成骨功能基因。
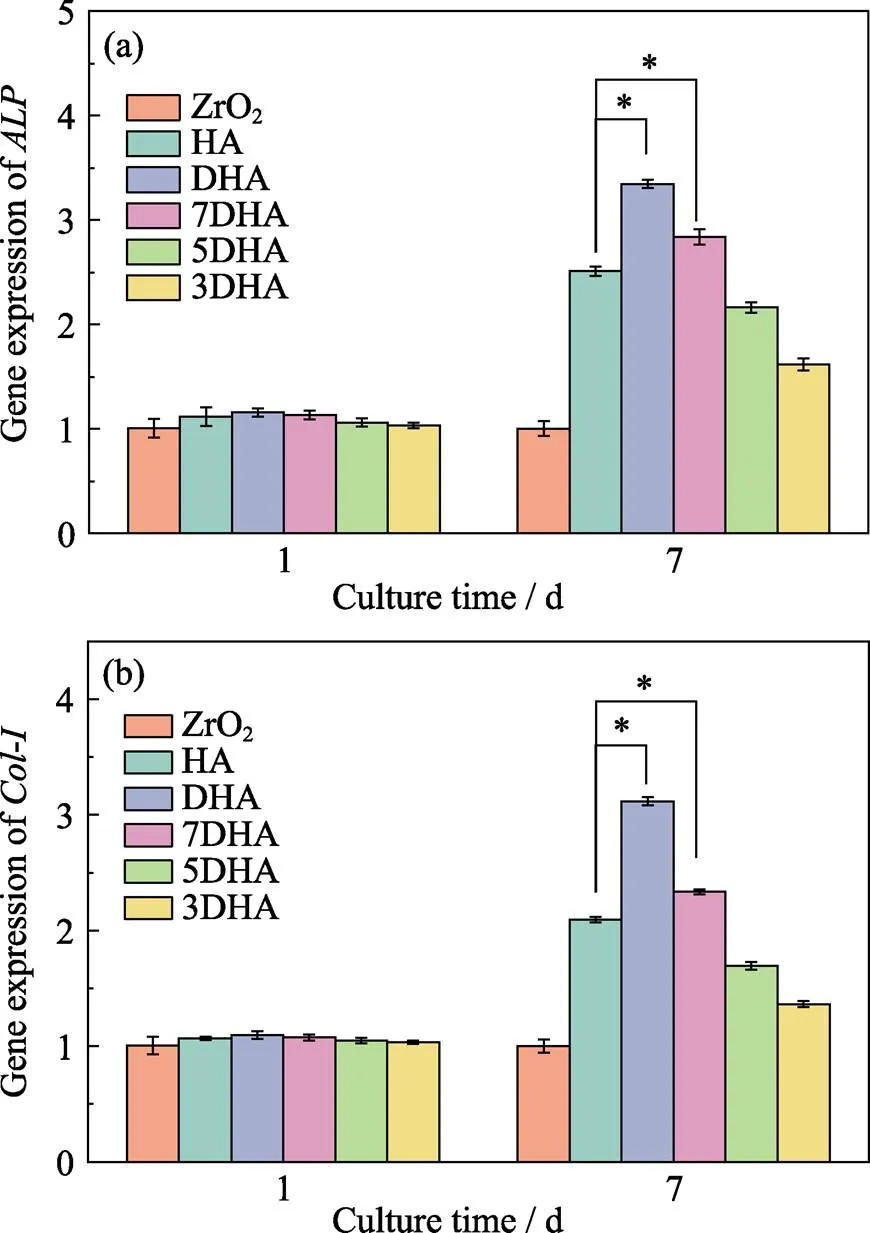
图8 成骨相关基因表达随时间变化图
(a)expression; (b)expression (*<0.05)
3 讨论
体外生物学实验表明, DHA涂层的促成骨性能优于HA涂层和ZrO2基材, 三种微量元素的引入是涂层促成骨性能提升的主要因素。锶是钙的同族元素, 取代HA中钙(1)后可使晶格尺寸增加、晶格稳定性下降[23], 从而提高溶解度[24]; 硅元素取代PO43–, 使HA产生晶格缺陷和更多的负电表面[25]; 氟元素引入HA后造成Ca(2)空位, 引起晶格缺陷[14]。本研究合成的DHA的XRD图谱中, 特征峰位发生了右移, 提示元素成功引入羟基磷灰石晶格中, 并导致了晶格结构改变。因微量元素引入造成的晶格缺陷提高了DHA在体液环境中的溶解度, 释出的Sr2+拥有刺激成骨细胞分泌新生骨组织基质, 抑制破骨细胞活性、减少骨吸收的双重调节功能[26-29], Si元素和F–则促进成骨细胞增殖和分化[14,30-32]。体外生物学性能的研究结果表明, 本研究所制备的DHA涂层在促成骨性能提高方面具有多元素协同作用[12], 相比于HA涂层表现出明显的优势。
成骨分化相关基因的表达数据, 从机制角度佐证了上述促成骨性能实验的结果。和是成骨分化标志性功能蛋白, 两者在早期成骨细胞分化、骨组织基质形成等方面发挥了重要作用。在细胞培养第7 d, DHA涂层的和表达量是ZrO2基材的3~4倍, 明显高于HA涂层。锶元素可引起以Runt相关转录因子()以及/信号通路中的关键分子-连环蛋白()和卷曲8 ()的上调[33-34], 而该信号通路在骨骼发育及骨稳态中发挥核心作用。Honda等[31]证明微量硅掺杂HA可上调成骨分化相关基因、、、和表达, Sun等[10]进一步检测了微量硅掺杂HA对多达20余种成骨分化信号通路相关基因的表达, 发现、、、和的高表达。Li等[30]则证明微量氟掺杂HA可上调、、和的表达, Wang的研究[14]进一步表明微量氟掺杂HA可增加和的表达。ZrO2-DHA涂层含有锶、硅、氟三种微量元素, 三种元素通过不同的分子生物学机制提高了ZrO2-DHA涂层的成骨活性。
ZrO2-DHA涂层的促成骨性能与涂层中DHA的含量呈正相关, DHA的含量越多, 涂层生物学性能越好。MTT实验结果表明, DHA涂层和ZrO2-DHA涂层对MC3T3-E1毒性评级为0; 而与ZrO2基材相比, DHA涂层和ZrO2-DHA涂层在不同程度上增强了细胞活力。促成骨分化实验证实, DHA涂层和ZrO2-DHA涂层的早期促成骨性能明显优于ZrO2基材。这些结果显示ZrO2-DHA作为涂层材料在植入体促成骨性能方面具有明显优势。
ZrO2-DHA涂层力学性能与ZrO2含量呈正相关, ZrO2含量越多, 涂层力学性能越好。力学性能的提升来自ZrO2的增韧作用, 最先沉积在氧化锆基材表面的ZrO2熔融液滴, 与氧化锆基材的结合力较DHA更强。DHA和ZrO2粉体在密度、粒径等方面存在差异, 熔融状态不完全一致, 在氧化锆基材上沉积时相互交织、包绕和穿插, 形成三维网状结构。这种结构使ZrO2-DHA涂层对残余热应力、压应力和拉伸力的承受能力较DHA涂层明显提升, 对植入体涂层在硬组织内发挥长期作用具有重要意义。
ZrO2-DHA涂层的生物活性虽有所减弱, 但7DHA涂层的早期促成骨活性仍优于HA涂层。结合生物学性能方面的优势, 7DHA涂层在早期促成骨性和对植入体受到硬组织机械力的抗性均优于HA涂层, 是一种理想的生物活性涂层材料。
4 结论
本研究通过等离子喷涂法在氧化锆基材上制备了锶、硅、氟微量掺杂羟基磷灰石涂层和氧化锆增韧锶、硅、氟微量掺杂羟基磷灰石涂层, 为氧化锆植入体的表面改性提供了新的依据。通过涂层的力学性能和体外生物学性能的研究得到以下结论:
1) DHA涂层在体外的早期促成骨性能优于HA涂层和ZrO2基材。
2) ZrO2-DHA涂层的促成骨性能明显优于ZrO2基材, 这是由涂层中的DHA组分决定的。ZrO2-DHA复合涂层的促成骨性能与DHA含量呈正相关。
3) ZrO2-DHA涂层的力学性能明显优于DHA涂层, 涂层中ZrO2与DHA复合形成三维结构。ZrO2-DHA涂层的力学性能与ZrO2含量呈正相关。
4) 相对于HA涂层, 7DHA涂层在体外促成骨性能和力学性能方面具有明显的优势。在氧化锆植入体表面制备DHA和ZrO2比例为7 : 3的涂层, 是一种具有应用前景的硬组织植入材料。
[1] PAYER M, HESCHL A, KOLLER M,. All-ceramic restoration of zirconia two-piece implants--a randomized controlled clinical trial., 2015, 26(4): 371–376.
[2] BANKOGLU G M, AYDIN C, YILMAZ H,. An overview of zirconia dental implants basic properties and clinical application of three cases., 2014, 40(4): 485–494.
[3] BAN S. Reliability and properties of core materials for all-ceramic dental restorations., 2008, 44(1): 3–21.
[4] GAHLERT M, ROEHLING S, SPRECHER C M,.performance of zirconia and titanium implants: a histomorphometric study in mini pig maxillae., 2012, 23(3): 281–286.
[5] KOHAL R J, WOLKEWITZ M, HINZE M,. Biomechanical and histological behavior of zirconia implants: an experiment in the rat., 2009, 20(4): 333–339.
[6] BIANCO P D, DUCHEYNE P, CUCKLE J M. Local accumulation of titanium released from a titanium implant in the absence of wear., 1996, 31: 227–234.
[7] TSCHEMITSCHEK H, BORCHERS L, GEURTSEN W. Nonalloyed titanium as a bioinert metal—a review., 2006, 96(1): 523–530.
[8] FRANSSON C, LEKHOLM U, JEMT T,. Prevalence of subjects with progressive bone loss at implants., 2005, 16(4): 440–446.
[9] ZHOU H, LEE J. Nanoscale hydroxyapatite particles for bone tissue engineering., 2011, 7(7): 2769–2781.
[10] SUN T, WANG M, SHAO Y,. The effect and osteoblast signaling response of trace silicon doping hydroxyapatite., 2018, 181(1): 82–94.
[11] XIAO S, WANG M, WANG L,. Environment-friendly synthesis of trace element Zn, Sr, and F codoping hydroxyapatite with non- cytotoxicity and improved osteoblast proliferation and differentiation., 2018, 185(1): 148–161.
[12] GAO J, WANG M, SHI C,. A facile green synthesis of trace Si, Sr and F multi-doped hydroxyapatite with enhanced biocompatibility and osteoconduction., 2017, 196: 406–409.
[13] GAO J, WANG M, SHI C,. Synthesis of trace element Si and Sr codoping hydroxyapatite with non-cytotoxicity and enhanced cell proliferation and differentiation., 2016, 174(1): 208–217.
[14] WANG L, WANG M, LI M,. Trace fluorine substituted calcium deficient hydroxyapatite with excellent osteoblastic activity and antibacterial ability., 2018, 20(38): 5744–5753.
[15] YUGESWARAN S, YOGANAND C P, KOBAYASHI A,. Mechanical properties, electrochemical corrosion andbioactivity of yttria stabilized zirconia reinforced hydroxyapatite coatings prepared by gas tunnel type plasma spraying., 2012, 9: 22–33.
[16] KHOR K A, GU Y W, PAN D,. Microstructure and mechanical properties of plasma sprayed HA/YSZ/Ti-6Al-4V composite coatings., 2004, 25(18): 4009–4017.
[17] 吴永智. 等离子喷涂羟基磷灰石纳米氧化锆梯度涂层的研究. 北京: 北京工业大学硕士学位论文, 2008.
[18] XIE L, WU X, LI W,. Latest research on zirconia implant surface treatment., 2017, 21(10): 1623–1628.
[19] SZURKOWSKA K, KOLMAS J. Hydroxyapatites enriched in silicon–bioceramic materials for biomedical and pharmaceutical applications., 2017, 27(4): 401–409.
[20] ZIPKIN I, MCCLURE F J, LEE W A. Relation of the fluoride content of human bone to its chemical composition., 1960, 2: 190–195.
[21] TRUEMAN CN, TUROSS N. Trace elements in recent and fossil bone apatite., 2002, 48(1): 489–521.
[22] GBT16886.12-2017/ISO10993-12:2012, Biological evaluation of medical devices-Part 12: Sample preparation and reference materials.
[23] FRASNELLI M, CRISTOFARO F, SGLAVO V M,. Synthesis and characterization of strontium-substituted hydroxyapatite nanoparticles for bone regeneration., 2017, 71: 653–662.
[24] NI GX, SHU B, HUANG G,. The effect of strontium incorporation into hydroxyapatites on their physical and biological properties., 2012, 100(2): 562–568.
[25] TANG Q, BROOKS R, RUSHTON N,. Production and characterization of HA and SiHA coatings., 2010, 21(1): 173–181.
[26] CANALIS E, HOTT M, DELOFFRE P,. The divalent strontium salt S12911 enhances bone cell replication and bone formation., 1996, 18(6): 517–523.
[27] BONNELYE E, CHABADEL A, SALTEL F,. Dual effect of strontium ranelate: stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption., 2008, 42(1): 129–138.
[28] TAKAHASHI N, SASAKI T, TSOUDEROS Y,. S 12911-2 inhibits osteoclastic bone resorption., 2003, 18(6): 1082–1087.
[29] BUEHLER J, CHAPPUIS P, SAFFAR J L,. Strontium ranelate inhibits bone resorption while maintaining bone formation in alveolar bone in monkeys ()., 2001, 29(2): 176–179.
[30] LI Z, HUANG B, MAI S,. Effects of fluoridation of porcine hydroxyapatite on osteoblastic activity of human MG63 cells., 2015, 16(3): 035006.
[31] HONDA M, KIKUSHIMA K, KAWANOBE Y,. Enhanced early osteogenic differentiation by silicon-substituted hydroxyapatite ceramics fabricatedultrasonic spray pyrolysis route., 2012, 23(12): 2923–2932.
[32] HONDA M, KIKUSHIMA K, KAWANOBE Y,. Cell proliferation, morphology and differentiation of transgenic-cloned pig calvarial osteoblasts on the silicon-substituted hydorxyapatite ceramics fabricatedultrasonic spray-pyrolysis technique., 2011, 47(1): 37–41.
[33] ZHOU J, LI B, LU S,. Regulation of osteoblast proliferation and differentiation by interrod spacing of Sr-HA nanorods on microporous titania coatings., 2013, 5(11): 5358–5365.
[34] YANG F, YANG D, TU J,. Strontium enhances osteogenic differentiation of mesenchymal stem cells andbone formation by activating Wnt/catenin signaling., 2011, 29(6): 981–991.
Zirconia Reinforced Trace Element Co-doped Hydroxyapatite Coating
DAI Zhao1, WANG Ming2, WANG Shuang1, LI Jing1, CHEN Xiang1, WANG Da-Lin1, ZHU Ying-Chun2
(1. Hospital of Changhai, Second Military Medical University, Shanghai 200433, China; 2. Key Laboratory of Inorganic Coating Materials, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
Zirconia is a kind of prospective hard tissue implant materials, which possesses superior mechanical properties and excellent biocompatibilities. To promote the stable osseointegration between Zirconia implants and tissue, zirconia-toughened trace Sr-, Si- and F- co-doped hydroxyapatite (ZrO2-DHA) was coated by plasma spraying on zirconia. The phase composition and structure of coatings were characterized, and the mechanical properties andbiological properties were investigated. The results show that co-doping of trace Sr, Si and F enhances the biological properties of coatings on adhesion and differentiation of osteoblasts through the signal transduction pathway of osteogenic differentiation. All of ZrO2-DHA coatings promote the cell viability and gene expression in osteogenic differentiation of MC3T3-E1. On the 7th day of cell culture, the relative expression levels ofandin the ZrO2-DHA coating containing 70% DHA (7DHA) were about 2.8 times and 2.3 times higher than those in the ZrO2substrate group, respectively. Mechanical properties of ZrO2-DHA coatings are improved with the increment of zirconia ratio. Hardness of DHA coating and 7DHA coating are 250.8 and 313 HV respectively and their bond strength are 25.1 and 31.8 MPa, respectively. 7DHA coatings with network structure possess both excellent mechanical and biological performance for the implant coating application.
Sr/Si/F trace-doped hydroxyapatite; plasma spraying; zirconia reinforcing; mechanical property; osteogenesis
TQ174
A
1000-324X(2020)02-0179-08
10.15541/jim20190053
2019-01-27;
2019-04-02
国家自然科学基金(51232007) National Natural Science Foundation of China (51232007)
代钊(1989–), 男, 硕士研究生. E-mail: zhaodai313@126.com
DAI Zhao (1989–), male, Master candidate. E-mail: zhaodai313@126.com
汪大林, 教授. E-mail: wang_dento@163.com; 祝迎春, 研究员. E-mail: yzhu@mail.sic.ac.cn
WAN Da-Lin, professor. E-mail: wang_dento@163.com; ZHU Ying-Chun, professor. E-mail: yzhu@mail.sic.ac.cn
- 无机材料学报的其它文章
- 巯基改性SBA-15的制备及其对Cr6+的吸附
- Interfacial Stress Analysis on Skutterudite-based Thermoelectric Joints under Service Conditions
- Powder Characteristics on the Rheological Performance of Resin-based Zirconia Suspension for Stereolithography
- 硫化镍引发钢化玻璃自爆的临界尺寸及影响
- 钛表面铜离子注入对细菌和细胞行为的影响
- Ni-Ti-LDHs纳米片对阿司匹林的负载与缓释

