2种不同耐热性的盆栽红掌品种抗性机制比较
王宏辉 顾俊杰 房伟民 陈发棣 张栋梁

摘要:为研究盆栽红掌品种的耐热性机制,筛选出红掌不同品种耐热性鉴定指标,以强耐热品种阿拉巴馬(Alabama)和弱耐热品种白冠军(White champion)为材料,在39 ℃高温处理不同时间后测定2个品种叶片的相对电导率(REC)﹑丙二醛含量(MDA)、相对含水量(RWC)和渗透调节物质含量等10个生理指标的变化。结果表明,随着高温处理时间的延长,2种盆栽红掌的相对电导率与MDA含量的动态变化趋势一致,且均呈上升趋势,耐热性强的阿拉巴马的相对电导率和MDA含量增幅比耐热性弱的白冠军小,且始终保持较低水平;RWC呈下降变化趋势,阿拉巴马的RWC降幅比白冠军的小,且最后趋于稳定并保持在较高水平;阿拉巴马叶绿素总含量和类胡萝卜素含量呈先升高后下降的变化趋势,且胁迫前后含量没有显著性差异,而白冠军均呈持续下降的趋势;脯氨酸含量和可溶性蛋白含量的动态变化趋势一致,均呈现为先升高后下降的变化趋势,阿拉巴马比白冠军出现峰值所需的时间长、增幅大、降幅小且始终显著高于对照;超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的变化趋势一致,均先升高后降低,阿拉巴马的升高幅度大于白冠军并始终保持高于对照的活性,而胁迫后白冠军的SOD和POD活性低于对照,CAT活性高于对照。综合试验结果,耐热性强的阿拉巴马的抗性机制是具有较稳定的细胞膜系统、较强的渗透调节能力和较高的抗氧化能力。相对电导率、丙二醛含量、相对含水量、脯氨酸含量、可溶性蛋白含量、SOD活性和POD活性可以作为红掌不同品种耐热性评价的生理指标。
关键词:高温胁迫;盆栽红掌;抗性机制;耐热性;评价指标;生理指标
中图分类号:S682.1+40.1 文献标志码:A 文章编号:1002-1302(2020)21-0140-06
红掌(Anthurium andraeanum Lind.)是天南星科(Araceae)花烛属(Anthurium Schott)多年生常绿草本花卉,原产于哥斯达黎加、哥伦比亚等热带雨林区,生长适温在14~35 ℃。红掌花朵奇特,色彩丰富,花期长,是目前国内外花卉市场上需求量较大的切花和盆载花卉,成为仅次于兰花的世界第二大热带花卉商品[1]。国内绝大多数红掌栽培产业从国外引进红掌种苗,经过多年的生产经验,引进品种中阿拉巴马在夏季栽培中生长良好,花苞颜色正常,其耐热性较强,而白冠军则长势较慢,花苞颜色不正常,其耐热性较弱。
高温逆境影响植物的正常生长发育,尤其影响观赏植物的观赏性,降低其商品价值[2]。随着工业的快速发展,温室效应越来越严重,频繁出现极端高温天气,植物在高温胁迫下的耐热性机制引起众多学者的广泛关注。莫健彬等研究了高温对6个不同耐热性玉簪品种的生理指标的影响,指出电导率、可溶性蛋白含量、自由水/束缚水比值、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性和脯氨酸含量均可以作为玉簪品种耐热性的评价指标[3]。彭华婷等研究了大花三色堇(Viola tricolor var. hortensis)和谐系列抗热的黄色品种和不抗热的绯红渐变品种在高温胁迫下生理指标的变化,指出电解质外渗、CAT活性、SOD活性和丙二醛(MDA)含量可以作为大花三色堇抗热品种选育的鉴定指标[4]。迄今为止,高温胁迫对不同耐热性红掌品种生理机制影响的相关报道较少,张伟等研究了3种不同耐热性红掌品种在不同温度下的可溶性蛋白含量、SOD活性、POD活性和可溶性糖含量的变化[5],涉及的耐热性相关指标较少。
本试验测定了39 ℃高温处理不同时间后强耐热品种阿拉巴马和弱耐热性品种白冠军的相对电导率(REC)﹑丙二醛含量、相对含水量(RWC)和渗透调节物质含量等10个生理指标的变化,旨在明确红掌品种的耐热性机制,筛选出红掌品种耐热性指标,为比较其他红掌品种的耐热性提供理论依据。
1 材料与方法
1.1 试验材料
5月龄的红掌盆花阿拉巴马(Alabama)和白冠军(White champion),购自上海鲜花港企业发展有限公司,2种盆栽红掌均为120盆,在智能人工气候室(型号RXZ-430A)中培养,白天温度维持在 25~28 ℃,夜间温度在20~23 ℃,空气相对湿度为70%~80%,光照度为10 000~15 000 lx,光照时间是12 h/d,根据红掌的长势情况进行浇水和施肥。
1.2 试验处理
2013年5月选择2个植株长势基本一致的红掌品种置于人工气候室内,在39 ℃高温胁迫下处理 6、12、24、36、48 h,对照置于室温下培养,5盆为1个处理,重复4次,每个处理后选取5株植株上部第1张成熟叶,于南京农业大学实验室内测定各个处理2种盆栽红掌品种叶片的10个生理指标。
1.3 测定指标与方法
参照高俊凤的方法[6],利用电导仪法测定REC,利用称质量法测定RWC,利用硫代巴比妥酸法测定丙二醛含量,利用紫外分光光度法测定叶绿素和类胡萝卜素含量,利用考马斯亮蓝比色法测定可溶性蛋白含量,利用酸性茚三酮比色法测定脯氨酸含量,利用硝基四氮唑(NBT)光还原比色法测定超氧化物歧化酶活性,利用紫外分光法测定过氧化氢酶活性,利用愈创木酚比色法测定过氧化物酶活性。
1.4 数据统计分析
运用Excel 2007软件对高温胁迫下2个红掌品种各个生理指标的变化趋势作图,用DPS软件进行方差分析和显著性检验。
2 结果与分析
2.1 高温胁迫对2种盆栽红掌叶内膜透性的影响
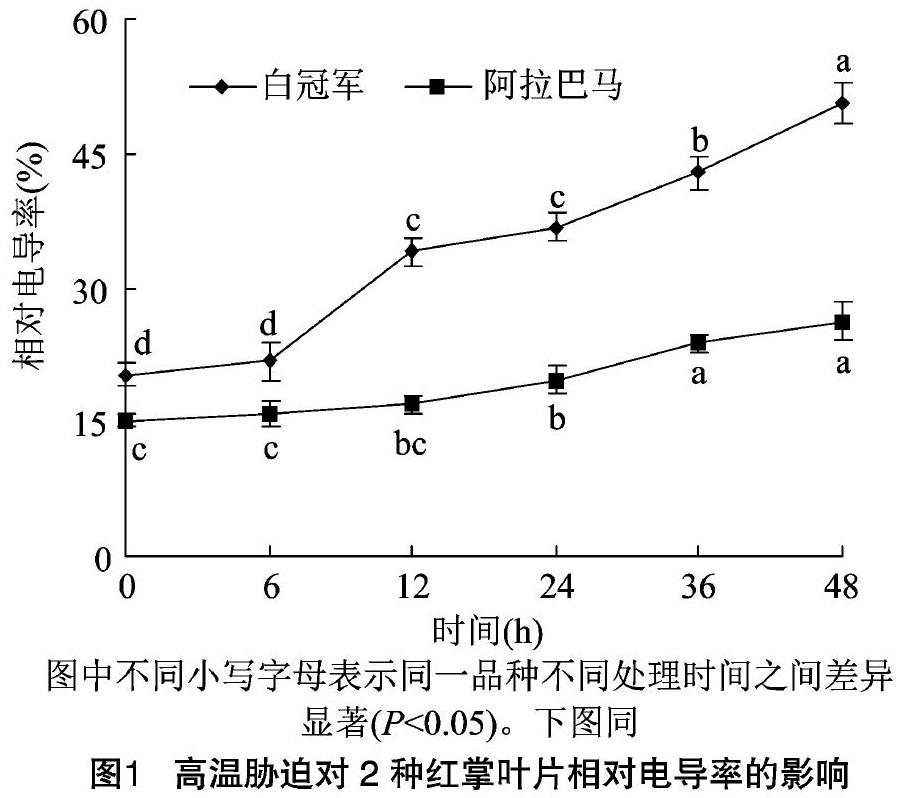
2.1.1 质膜透性的变化 高温胁迫首先会伤害细胞膜的结构,改变细胞膜的透性,使得细胞内的电解质向胞外渗出,导致植物体受到伤害,相对电导率是植物细胞膜透性损害程度最直观的指标[7]。从图1可以看出,阿拉巴马和白冠军的相对电导率(REC)随着高温胁迫时间的延长均呈现上升的趋势,高温处理之前,白冠军的REC明显大于阿拉巴马,胁迫6 h时2个红掌品种的REC与对照相比均没有显著性变化,白冠军在胁迫12 h时上升幅度最大,比对照增加67.24%,而阿拉巴马的相对电导率则一直缓慢上升;高温胁迫48 h时,白冠军的相对电导率比对照增加1.49倍,而阿拉巴马比对照增加72.78%。说明弱耐热品种白冠军叶片在高温胁迫下细胞膜透性比强耐热品种阿拉巴马膜透性增大的程度强,膜系统受害程度较大。
2.5.3 CAT活性的变化 过氧化氢酶(CAT)是植物产生的一种抗氧化酶,协同SOD和POD共同维持机体内氧代谢平衡。从图10可以看出,高温处理前,阿拉巴马叶片的CAT活性是白冠军的2.06倍,2个品种差异明显。在高温胁迫过程中2种红掌叶片CAT活性的动态变化趋势一致,均表现为先升高后降低,但都比对照高,白冠军在胁迫24 h时上升到最大值,而阿拉巴马的峰值表现在36 h,分别比对照升高1.26、1.06倍。高温胁迫结束后,白冠军和阿拉巴马叶片的CAT活性分别比对照上升31.86%和1.02倍,表明不同的耐热性红掌品种叶片的CAT活性在高温胁迫下均升高,但强耐热性品种阿拉巴马叶片的CAT活性升高的幅度明显高于弱耐热性品种白冠军。
3 讨论与结论
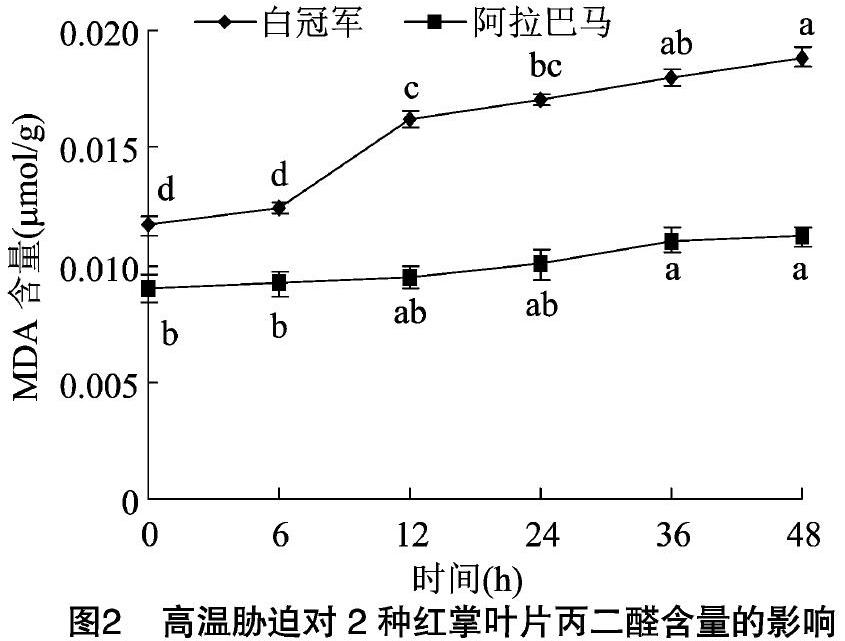
植物在高温逆境下会产生一系列的生理生化变化来抵御和适应一定程度的热胁迫[8],如调整细胞膜的组分、产生渗透调节物质和增强抗氧化酶活性等来减轻高温对它的伤害,植物本身都具有一定的耐热性,但不同植物的抗性机制不同。高温胁迫会直接破坏植物的生物膜结构及产生膜脂过氧化,致使细胞膜透性变大,胞内电解质向胞外渗出[9],并产生MDA等氧化产物。细胞膜透性变的越大,电解质外渗越多,相对电导率则越高[7];膜脂过氧化程度越高,产生的MDA就越多[10],并加剧膜的损伤程度。因此,相对电导率的大小、MDA含量的高低与植物的耐热能力的强弱成反比。该研究中发现相对电导率和丙二醛含量的动态变化一致,即在高温胁迫6 h时2个红掌品种的REC和丙二醛含量上升的幅度较小,与对照相比差异不显著,这与植物自身启动保护机制有关,随着高温胁迫时间的延长,耐热性强的阿拉巴马的REC和积累的MDA含量维持在较低水平,并缓慢上升,表现出一定的适应性;而耐热性弱的白冠军在胁迫12 h时REC和MDA含量均急剧上升,当胁迫结束后分别比对照增加1.49倍和61.56%,这与初敏等对2个耐热性不同的萝卜研究中得出的耐热品种的相对电导率和MDA含量升高幅度低于感热品种的结论[11]一致。表明相对电导率和丙二醛含量可以初步作为红掌品种耐热性评价的生理指标。
高温可以加快植物的蒸腾作用而使植物出现脱水现象,RWC是衡量植物脱水程度的指标,RWC的大小与植物耐热性强弱成正比[12]。本试验中发现2个红掌品种的RWC随着胁迫时间的延长均呈现下降趋势,但在6 h时下降的与对照相比差异不显著,说明短时间内2种红掌机体均未受到伤害。胁迫6 h后耐热性弱的白冠军的RWC急剧下降,高温结束后比对照下降了12.32%;而耐热性强的阿拉巴马在整个高温胁迫过程中RWC缓慢下降最后趋于稳定并保持在较高水平,这可能是阿拉巴马抗高温胁迫的原因之一。该结果与彭华婷等在大花三色堇研究中得出的抗热品种的RWC受高温的影响显著小于热敏感品种的结论[4]基本一致。
高温会破坏叶绿体的超微结构,同时还会影响叶绿素合成中间产物的生物合成而减少叶绿素的生成量[13],高温也会抑制类胡萝卜素的合成。本研究发现在高温胁迫过程中,耐热性弱的白冠军叶片叶绿素总含量和类胡萝卜素含量动态变化趋势一致,均呈持续下降趋势,48 h后分别比对照减少41.54%、29.80%,而阿拉巴马则均表现为先升高后下降的变化趋势,且胁迫48 h时与胁迫前的含量均没有显著差异。说明39 ℃高温胁迫48 h并不是强耐热性品种在叶绿素和类胡萝卜素代谢上的临界胁迫时间,却降低了弱耐热性品种的叶绿素和类胡萝卜素含量。该结果与林晓红等研究得出的32、39、46 ℃高溫胁迫4 h后梦幻、阿里西亚和红国王3个红掌品种叶片的类胡萝卜素含量与叶绿素总量的降幅排序[14]不一致,不能作为红掌抗热性指标的结论,这可能是由于红掌品种本身的区别和不同的试验处理所致。因此,叶绿素总含量和类胡萝卜素含量是否可以作为红掌耐热性的评价指标还需进一步研究。
高温会改变植物体的生物膜透性,加快植物蒸腾作用,进而引起细胞的电解质外渗和脱水,植物体会自动积累脯氨酸和可溶性蛋白质等渗透调节物质来避免或减少伤害,它们的调节机制备受国内外研究学者的关注[15-18]。本试验发现高温胁迫过程中2种红掌的脯氨酸含量和可溶性蛋白含量均表现为先升高后降低的趋势,但耐热性强的阿拉巴马出现峰值所需的时间较长,幅度较大且始终显著高于对照,而胁迫结束后耐热性弱的白冠军比对照分别减少了11.97%、50.00%,说明强耐热性品种积累脯氨酸和可溶性蛋白的能力较强,具有更强的渗透调节能力,该结论与许多研究结果[19-22]相一致。因此,脯氨酸含量和可溶性蛋白含量可以作为红掌品种耐热能力评价的指标。
高温会破坏植物体正常的活性氧代谢,积累大量活性氧,造成机体伤害,但植物体在一定范围内会通过增加抗氧化酶活性来启动自我防御机制消除活性氧[9],SOD、POD和CAT是重要的抗氧化保护酶。从本研究结果看出,胁迫前耐热性强的阿拉巴马的SOD、POD和CAT活性均显著大于耐热性弱的品种白冠军,胁迫过程中2个红掌品种的3个酶活性均表现先升高后下降的趋势,这与马延臣等的研究结果[23]一致,说明短期高温胁迫下红掌启动自身保护机制,通过增加抗氧化酶活性的方式来降低活性氧对机体造成的伤害。阿拉巴马升高幅度均大于白冠军并始终保持高于对照的活性,而胁迫后白冠军的SOD和POD活性分别比对照降低了30.39%、25.83%,CAT活性比对照增加了31.86%,说明红掌品种的耐热性越强,抵抗活性氧对机体伤害的能力就越强。该结论与杨华庚等对蝴蝶兰和水稻研究得出的耐热性强品种的SOD和POD活性增幅显著大于耐热性弱的品种的结论[24-25]一致。但高温胁迫提高了2个红掌品种的CAT活性,相关机制还不清楚。因此,SOD 和POD活性可以作为红掌品种耐热性评价的指标。
在高温胁迫过程中,耐热性强的阿拉巴马可能是通过始终保持较低的相对电导率和丙二醛含量,保持较高水平的相对含水量,积累更多的脯氨酸和可溶性蛋白,更高的SOD和POD活性等机制来抵御高温胁迫,这些指标可以作为红掌品种耐热性评价的依据。而叶绿素总含量、类胡萝卜素含量和CAT活性是否可以作为评价红掌耐热能力的指标还需要进一步研究。
参考文献:
[1]杜 平,邵小斌. 我国红掌的研究进展[J]. 江苏农业科学,2011,39(6):325-327.
[2]Wahid A,Gelani S,Ashraf M,et al. Heat tolerance in plants:an overview[J]. Environmental and Experimental Botany,2007,61(3):199-223.
[3]莫健彬,陈必胜,黄 梅,等. 高温对玉簪品种部分生理指标的影响研究[J]. 种子,2007,26(5):48-51.
[4]彭华婷,高 悦,杜红梅,等. 高温胁迫对大花三色堇幼苗相关生理指标的影响[J]. 上海交通大学学报(农业科学版),2012,30(6):66-71.
[5]张 伟,朱方平. 红掌不同耐热性品种对高温胁迫的生理反应[J]. 农业科技通讯,2014,15(12):108-110.
[6]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[7]王 涛,田雪瑶,谢寅峰,等. 植物耐热性研究进展[J]. 云南农业大学学报,2013,28(5):719-726.
[8]李晓清,胡学煜,左英强,等. 热胁迫对植物生理影响的研究进展[J]. 西南林学院学报,2009,29(6):72-76.
[9]Essemine J,Ammar S,Bouzid S. Impact of heat stress on germination and growth in higher plants:physiological,biochemical and molecular repercussions and mechanisms of defence[J]. Journal of Biological Sciences,2010,10(6):565-572.
[10]Han Y Y,Fan S X,Qiao Z,et al. Effect of heat stress on the MDA,proline and soluble sugar content in leaf lettuce seedlings[J]. Agricultural Sciences,2013,4(5):112-115.
[11]初 敏,庄志群,王秀峰,等. 不同耐热性萝卜幼苗对高温胁迫的生理响应[J]. 山东农业大学学报(自然科学版),2014,45(3):334-339.
[12]胡永红,蒋昌华,秦 俊. 植物耐热常规生理指标的研究进展[J]. 安徽农业科学,2006,34(1):192-195.
[13]宰学明,钦 佩,吴国荣,等. 高温胁迫对花生幼苗光合速率、叶绿素含量、叶绿体Ca2+-ATPase、Mg2+-ATPase及Ca2+分布的影响[J]. 植物研究,2007,27(4):416-420.
[14]林晓红,施木田,林小苹,等. 3个红掌盆栽品种的抗热性比较研究[J]. 热带作物学报,2012,33(10):1835-1840.
[15]Stefanov D,Petkova V,Denevi I D. Screening for heat tolerance in common bean(Phaseolus vulgaris L.)lines and cultivars using JIP-test[J]. Scientia Horticulturae,2011,128(1):1-6.
[16]吳久赟,廉苇佳,曾晓燕,等. 不同品种葡萄对高温的生理响应及耐热性评价[J]. 西北植物学报,2019,39(6):1075-1084.
[17]骞光耀,孔祥生,张淑玲. 3个牡丹品种对高温胁迫的生理响应[J]. 江苏农业科学,2017,45(12):103-105.
[18]曹 毅,李春梅,邓 燏,等. 不同菜心品种耐热性研究[J]. 西南师范大学学报(自然科学版),2010,35(5):128-131.
[19]徐 海,宋 波,顾宗福,等. 植物耐热机理研究进展[J]. 江苏农业学报,2020,36(1):243-250.
[20]贾宇婷,张梅娟,刘丽丽,等. 高温胁迫对2种苔藓植物生理生化指标的影响[J]. 齐齐哈尔大学学报(自然科学版),2016,32(4):41-44.
[21]张永平,陈幼源,杨少军. 高温胁迫对不同甜瓜品种幼苗生长和生理特性的影响[J]. 上海农业学报,2011,27(2):71-76.
[22]贾开志,陈贵林. 高温胁迫下不同茄子品种幼苗耐热性研究[J]. 生态学杂志,2005,24(4):398-401.
[23]马廷臣,夏加发,王元垒,等. 抽穗扬花期高温胁迫对不同耐热性水稻生理指标的影响[J]. 中国农学通报,2015,31(24):25-32.
[24]杨华庚,杨重法,陈慧娟,等. 蝴蝶兰不同耐热性品种幼苗对高温胁迫的生理反应[J]. 中国农学通报,2011,27(2):144-150.
[25]张桂莲,陈立云,张顺堂,等. 高温胁迫对水稻剑叶保护酶活性和膜透性的影响[J]. 作物学报,2006,32(9):1306-1310.邓少春,陈林波,陈春林,等. 大叶茶树品种内源激素水平及其与扦插生根的关系[J]. 江苏农业科学,2020,48(21):146-150.

