耐盐碱羊肚菌菌株筛选研究*
李树文 ,徐丽丽 ,于 浩 ,郭立忠 **
(1.青岛农业大学生命科学学院,山东 青岛 266109;2.山东省应用真菌重点实验室,山东 青岛 266109)
盐碱地是一个世界性资源与环境问题,由于工业化的快速发展和人口数量的急剧膨胀,造成农田、山林、牧地的过渡开垦,化肥的过渡使用、植被的过渡破坏甚至是气候的异常变化,从而加速了土壤的盐碱化进程。全球盐渍化土壤面积约为1×109hm2,我国盐碱地总面积约为0.991×108hm2,为第三大盐碱地分布国家,其中潜在盐渍化土壤为0.173×108hm2[1-2]。可见,盐碱地是重要的后备土地资源,其科学开发、合理利用对维护生态平衡、缓解耕地紧缺、推动国民经济发展及其可持续发展具有重要的经济、社会和生态意义[1-2]。而盐碱地耐盐作物或盐生作物的栽培对其开发利用及其改良和治理具有重要意义。
羊肚菌(Morchella spp.)因子实体外形似羊肚而得名,是一种名贵的食(药) 用菌,具有保肝、降血脂、抗肿瘤、抗氧化以及增强免疫力等保健价值[3]。自21世纪初我国掌握了野外栽培羊肚菌的技术,由于栽培过程简单、设施构造低廉、产品价值高、可套种农作物等特点,羊肚菌栽培得到了迅速而大面积的推广,2015年~2016年羊肚菌栽培面积达1 600 hm2[4]。关于羊肚菌在盐碱地中栽培菌株的筛选、育种以及栽培管理和设施优化等方面的研究未见报道,通过以试验室目前保存的能进行人工栽培的羊肚菌菌株以及采集的野生菌株为研究对象,从NaCl浓度和pH两个方面进行耐盐碱菌种的筛选试验,为未来盐碱地栽培羊肚菌的研究提供菌种资源和实践指导。
1 材料与方法
1.1 试验材料
菌种于2017年3月~4月分别采集于山东省文登市(命名为文登)、山东省烟台市(命名为烟台)、山东省诸城市(命名为51号),及试验室保存种(命名为2-4),其中文登和烟台鉴定为梯纹羊肚菌(Morchella importuna),2-4为尖顶羊肚菌(Morchella conica),51号是野外采集种,经鉴定为尖顶羊肚菌(Morchella conica),保存于山东省应用真菌重点试验室。PDA培养基115℃灭菌30 min,接菌后培养温度25℃。
1.2 试验仪器
MLS-3750全自动高压蒸汽灭菌器,日本三洋(SANYO);HWS-250恒温恒湿培养箱,上海淮宇仪器设备有限公司;THG-9070A鼓风干燥箱,苏州正合测试设备有限公司;BSA224S电子天平,Sartorius;PHS-3EpH计,上海雷磁;SW-CJ-2D超净工作台,苏州净化。
1.3 试验方法
1.3.1 pH对羊肚菌菌丝生长的影响
PDA培养基灭菌后调节pH:培养基灭菌后,经pH调节预试验后,在超净工作台内以无菌操作方式加入已灭菌的1 mol·L-1NaOH,调节培养基pH为6.71(对照)、7.50、8.09、8.33和 8.50。倒平板,冷却凝固后接种4株菌株培养2 d时的菌饼(直径6 mm),各pH接种3个重复;培养29 h后直尺测量并记录菌落直径。
PDA培养基灭菌前调节pH:培养基制备时,加入1 mol·L-1NaOH调节培养基pH为 6.39(编号PDA-1)、8.34(编号 PDA-2)、9.28(编号 PDA-3)和10.03(编号PDA-4),高压蒸汽灭菌后测定培养基pH,倒平板,冷却凝固后接种4株菌株培养2 d时的菌饼(直径6 mm),各pH接种3个重复;培养48 h后直尺测量并记录菌落直径。
1.3.2 不同浓度NaCl对羊肚菌菌丝生长的影响
选择在近似于滨海盐碱地pH(7.5~8.5)[5]的培养基中接种菌丝生长速度最快的菌株进行不同盐浓度的试验。将不同质量的NaCl加入培养基,调节灭菌后NaCl浓度(w/v) 为0(对照)、1.0%、2.0%、3.0%、3.5%、4.0%、4.5%、5.0%。倒平板,接种过程和测量过程与2.3.1相同。盐浓度对菌丝生长的抑制率(Y,%)的计算公式为:
式中:CKR为对照菌落直径(mm);R为各盐度菌落直径(mm)。
1.3.3 耐盐菌株的传代驯化
选择最耐盐菌株进行传代驯化试验,接种过程和测量过程与2.3.1同,传代驯化流程试验设计见图1~图3。
如图1~图3所示,3%~3%逐级驯化为菌株在不含盐培养基中培养2 d后依次转接于含盐量1%、2%、3%的培养基中,分别培养5 d,后于盐含量3%的培养基中培养2 d后测量菌落直径。0~3%传代培养为菌株在不含盐培养基中培养2 d后连续转接于不含盐培养基,分别培养5 d,后于盐含量3%的培养基中培养2 d后测量菌落直径。0~0对照传代培养为菌株在不含盐培养基中培养2 d后连续转接于不含盐培养基,分别培养5 d,于最后1个不含盐培养基培养2 d后测量菌落直径。
2 结果与分析
2.1 pH对羊肚菌菌丝生长的影响
试验选择了近似滨海盐碱地的pH(7.50~8.50)[5]。PDA培养基灭菌后调节pH,培养29 h后各菌株的菌落直径见图4。
由图4可知,各菌株均可在pH 7.50~8.50内生长,其中菌株51号pH在7.50时菌丝生长速率为1.21 mm·h-1,高于对照 1.17 mm·h-1,总体与对照近似;菌株2-4在pH 7.50时菌丝生长速率与对照1.52 mm·h-1相近,但总体低于对照;文登菌丝生长速率在pH 8.09时为1.76 mm·h-1,但总体均低于对照1.79 mm·h-1;烟台菌株pH在8.33时菌丝生长速度与对照1.48mm·h-1相近,但总体低于对照。不同pH对菌株生长影响的方差分析结果,见表1。

表1 不同pH条件下各菌株菌落直径的方差分析Tab.1 Anova analysis of the colony diameters of Morchella spp.under the condition of different pH
由表1可知,试验设置的pH对51号菌株、2-4菌株和文登菌株的生长均未有显著影响(F<Fcrit,P>0.05),而对烟台菌株的生长具有显著影响(F>Fcrit,P<0.05)。结合图4试验整体结果,各菌株的生长速率快慢为:文登菌株>2-4菌株>烟台菌株>51号菌株。综上所述,应选择生长速率快且试验pH对其生长未有显著抑制作用的文登菌株和2-4菌株进行后续试验。PDA培养基灭菌前调节pH,经过灭菌后,培养基pH变化见表2。
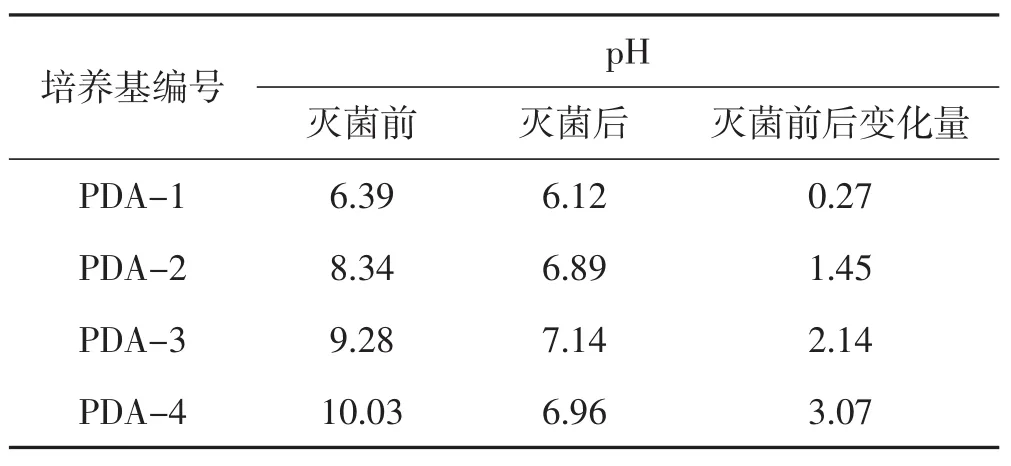
表2 PDA培养基灭菌前后pH变化情况Tab.2 pH changes before and after sterilizing PDA medium
由表2可知,灭菌后培养基pH均比原来低,且灭菌前pH越高,灭菌后pH下降越快。灭菌前调节pH为6.39~10.03,灭菌后pH为6.12~7.14,其对羊肚菌菌落直径的影响见图5,灭菌前调节PDA培养基pH对羊肚菌菌落直径的方差分析结果见表3。
表3 PDA灭菌后pH变化对羊肚菌菌落直径的方差分析Tab.3 Anova analysis of the colony diameters of of Morchella spp.with changes of pH after sterilizing PDA medium
由图5、表3可知,灭菌前调节培养基的pH,其灭菌后对文登和2-4菌株菌丝的生长有显著影响(P<0.05),其中对2-4菌株菌丝生长的影响极显著(P<0.001),如果依据该结论,则得出pH 6.12~7.14对菌丝生长有显著影响,而与前面的研究结果不一致。不同羊肚菌生长pH范围和培养基种类见表4。

表4 不同羊肚菌生长的pH范围和培养基种类Tab.4 pH ranges and culture media of Morchella spp.in the references
由表4可知,本试验研究所得羊肚菌菌丝可生长的pH与谢放[6]、陈易飞[7]、肖锋[8]的研究结果具有一致性。而李洁[9]、李小燕[10]、周洁[11]的研究表明,pH>8.00羊肚菌菌丝生长将受到抑制。原因可能是培养基成分产生差异,当加入NaOH进行pH调节高压灭菌后,导致沉淀物的生成或发生美拉德反应[12],不利于菌丝生长;或者培养基pH的调节造成,培养基灭菌前调节的pH与灭菌后培养基的pH存在差异[13],灭菌后pH变化太大时抑制菌丝生长。
2.2 NaCl浓度对羊肚菌菌丝生长的影响
不同NaCl浓度对2-4及文登菌株菌落直径的影响见图6。
由图6所示,在试验盐度范围内(盐浓度大于1.0%),文登菌株和2-4菌株菌丝均可生长,但随盐度的增加,与对照比较,菌丝生长量受到明显抑制。盐度对2株菌的抑制率不同,文登菌株在各盐度下的耐盐能力均高于2-4菌株,盐浓度5.0%时,其对2-4菌株和文登菌株的抑制率分别为92%和86%,可见文登菌株耐盐性更强。随培养时间的延长,2株菌株均能在高盐的培养基中生长,但菌丝生长速率存在差异。不同培养时间段盐度对菌丝生长速度的影响见图7,其抑制率结果见表5。
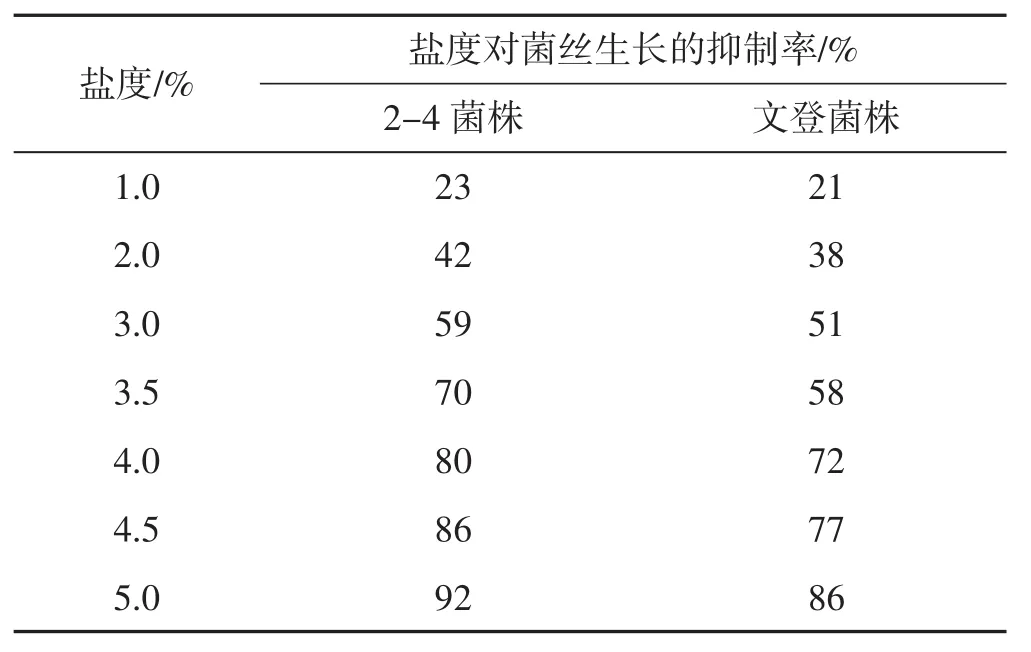
表5 盐度对菌丝生长的抑制率(105 h)Tab.5 The inhibition rate of salt concentration on mycelial growth(105 h)
由图7、表5可知,对于2-4菌株,在3.0%~3.5%盐浓度下,后期培养(培养时间为105 h~132 h)生长速率略有下降外,其他浓度后续培养的速率均高于前期培养(培养时间为48 h~105 h) 速率。对于文登菌株,在3.5%~4.5%盐浓度下,后期生长速率明显下降,尤其在3.5%~4.0%时的盐浓度;2.0%~3.0%盐浓度下生长速率前期与后期基本一致或后期生长速度略高于前期;当盐浓度达到5.0%时,后期菌丝生长速率高于前期。虽然盐浓度对文登菌株的生长速率影响较大,但是在各盐浓度的培养基上,文登菌株的生长速率均高于2-4菌株,所以后续耐盐试验将以文登菌株为驯化对象以期提高其耐盐性。
2.3 耐盐菌株驯化
对文登菌株进行3组驯化试验,其驯化结果见图8。驯化菌株与未驯化菌株菌落直径的差异性分析见表6。

表6 驯化菌株与未驯化菌株菌落直径的差异性分析Tab.6 Difference analysis of colony diameters between acclimated strain and original strain
由图8、表6可知,以文登菌株为试验对象,采用逐级增加盐浓度(3%~3%) 的方式进行耐盐菌株驯化,结果表明在盐度3%的培养基中,虽然驯化后菌株菌落直径(18.2 mm) 略高于未经驯化(15.5 mm),但是逐级驯化后的菌株与未经驯化的菌株菌丝生物量之间无显著差异,F<Fcrit。还需通过物理、化学、生物诱变以及基因工程等方法选育耐盐的新菌株,以进一步适应盐渍化土壤和盐土环境的生长。
3 结论
从pH和NaCl浓度2个方面进行耐盐碱性羊肚菌菌株的筛选研究,51号菌株、2-4菌株、文登菌株、烟台菌株均能在盐碱地的pH范围内生长,其环境pH对51号菌株、2-4菌株、文登菌株生长无显著影响,且文登菌株和2-4菌株的生长速率高于51号菌株。耐盐性研究表明,文登菌株和2-4菌株均可生长在盐度1.0%~5.0%的培养基中,与对照相比较,随盐度的增加,菌丝生长受到明显抑制,但均具有较强的耐盐能力,其中文登菌株具有较快的生长速度,但逐级驯化的抗盐文登菌株与未经驯化菌株的耐盐性未见显著性差异。
据报道,在华北地区的盐碱地,含盐量<0.2%为非盐渍化土壤;0.2%~0.3%为轻度盐渍化土壤;0.3%~0.4%为中度盐渍化土壤;0.4%~0.6%为重度盐渍化土壤;含盐量大于0.6%或1.0%为盐土[5]。在东营市盐碱地pH为8.09~8.35,盐度在0.3%~3.0%[14]。因此,文登菌株具有较强的耐盐能力,为盐碱地栽培羊肚菌及其育种提供了菌种资源。

