1,25-二羟维生素D3对小鼠急性结肠炎模型的干预研究
陈颖,周仁民,陈欣涛,林琼
(无锡市儿童医院消化科,江苏 无锡 214000)
炎症性肠病是一种非特异性肠道炎症性疾病,近年来儿童炎症性肠病发病率逐年升高,其特异性致病因素和发病机制尚不十分清楚,目前认为与多种因素有关,免疫紊乱可能是其致病的基础机制[1-2]。1,25-二羟维生素D3[1,25-dihydroxyvitamin D3,1,25(OH)2D3]是机体免疫系统的调节因子,在多种自身免疫性疾病中通过与维生素D受体(nuclear receptor vitamin D receptor,VDR)结合发挥调节作用[3-4]。炎症性肠病患者和小鼠模型血清中1,25(OH)2D3水平较低[5-6]。将小鼠的VDR基因敲除,可以诱导结肠炎的发生,而在补充1,25(OH)2D3后结肠炎症得到明显改善[7]。大多数研究认为,成人炎症性肠病患者补充维生素D是必要的,也有部分研究不支持这一观点[8-9]。在儿童炎症性肠病患者中,维生素D缺乏更为明显,但现有研究对于维生素D能否作为治疗手段仍不明确[10]。
炎症性肠病患者及小鼠模型中均有肠黏膜凋亡增多[5-6],而Bax和Bcl-2是重要凋亡调控基因,胱天蛋白酶3(caspase-3)是细胞凋亡过程中最主要的终末剪切酶。研究发现,在人肾小球系膜细胞中,1,25(OH)2D3能够改善系膜细胞凋亡并促进caspase-3表达[11-12]。本研究进一步证实1,25(OH)2D3在小鼠急性肠炎中的治疗作用,探讨其可能的作用机制,以期为炎症性肠病的临床治疗提供新思路和新方法。
1 材料与方法
1.1材料 选取6~8周龄清洁级BALB/c雄性小鼠24只,体重18~22 g,购自江苏亚东实验动物研究院有限公司[生产许可证号:SCXK(苏)2016-0009]。饲养温度控制在18~22 ℃,湿度50%~60%。主要试剂:右旋葡聚糖硫酸钠(dextran sodium sulfate,DSS)(美国Sigma公司);维生素D3(罗盖全胶囊,上海罗氏制药有限公司生产);核因子κB(nuclear factor κB,NF-κB)单克隆抗体、caspase-3多克隆抗体均购自美国CST公司;GTVisionTM抗鼠/兔通用型免疫组织化学检测试剂盒购自南京贝斯特生物技术有限公司。主要仪器:离心机(美国Beckman公司);组织切片机(德国徕卡);光学显微镜(美国Olympus公司)等。
1.2小鼠模型及分组 24只小鼠编号后按随机数字法分为对照组、模型组、干预组,每组8只。维生素D3是按照成人维生素D缺乏的常规剂量给药(50 000 IU/周),按体表面积折算为小鼠的等效剂量,采用该剂量的5倍作为本实验的干预剂量。根据Cooper等[13]的经典方法,对照组小鼠自由饮用蒸馏水7 d;模型组和干预组小鼠自由饮用 3% DSS溶液7 d建立小鼠急性结肠炎模型。同时,于第 1、3、5、7 天行灌胃,对照组和模型组小鼠予无菌磷酸盐缓冲液灌胃,干预组小鼠予维生素D3灌胃。每天观察并记录小鼠体重、大便、活动、饮食、存活等情况。造模10 d后,处死各组小鼠,采集小鼠结肠标本备检。
1.3疾病活动指数(disease activity index,DAI) 每日观察小鼠体重、大便性状和隐血或血便情况,计算DAI评分。DAI结合患者(患病动物)的体重下降百分率(体重不变为0,1%~5%为1分,6%~10%为2分,11%~15%为3分,>15%为4分)、大便黏稠度(正常为0,松散的大便为2分,腹泻为4分)和大便出血(正常0分,隐血阳性为2分,肉眼血便为4分)三种情况进行综合评分。DAI=(体重下降分数+大便性状分数+便血分数)/3[13]。
1.4结肠组织病理学评分 取远端结肠组织,石蜡包埋的肠组织分别做5 μm连续切片,按照二甲苯脱蜡、梯度乙醇水化、自来水冲洗1 min、苏木精染色7 min、自来水冲洗2 min、1%盐酸乙醇2 s、自来水冲洗2 min、1%氨水30 s、自来水冲洗4 min、0.5%伊红乙醇30 s、乙醇梯度脱水、二甲苯透明、中性树胶封片顺序行苏木精-伊红(hematoxylin-eosin,HE)染色,根据表1进行组织病理学评分[13]。
1.5采用逆转录-聚合酶链反应测定小鼠远端结肠组织中肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)的表达情况 应用RNAiso Plus总RNA提取试剂盒提取标本总RNA,并测定其浓度后-80 ℃保存备用。逆转录按照PrimeScriptTMRT reagent试剂盒进行逆转录-聚合酶链反应,以肌动蛋白(β-actin)为内参并检测TNF-α的相对表达水平。引物设计如下。TNF-α上游引物:ACTCCAGGCGGTGCCTATGT,TNF-α 下游引物:GTGAGGGTCTGGGCCATAGAA;β-actin上游引物:CATCCGTAAAGACCTCTATGCCAAC,β-actin 下游引物:ATGGAGCCACCGATCCACA,聚合酶链反应总反应体系为20 μL,置入聚合酶链反应仪中,95 ℃预变性2 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,共40个循环,4 ℃终止反应。

表1 结肠组织病理评分
1.6采用免疫组织化学法测定结肠组织中NF-κB、 caspase-3的表达情况 将石蜡包埋组织连续切片后,依次行脱蜡、 水化、3%过氧化氢灭活内源性过氧化物酶,磷酸盐缓冲液冲洗,微波炉内行抗原修复,再滴加山羊血清封闭液,一抗后4 ℃过夜,二抗、 三抗室温各孵育30 min,正置显微镜下二氨基联苯胺显色 2 min后,行复染、脱水、透明,封片镜检。采用半定量法分别判断NF-κB、caspase-3阳性结果。首先,判断阳性细胞百分比:无阳性细胞记0分,1%~10%记1分,11%~50%记 2分,51%~80%记 3分,>80%记4分;再判定染色强度,根据阴性、弱、中、强分别记0、1、2、3分;最终评分为阳性细胞百分比和染色强度的乘积。

2 结 果
2.1各组小鼠的一般状况 研究期间,对照组小鼠大小便正常、体重持续增加、毛发有光泽,饮食、活动等正常。模型组小鼠造模后第1天,体重增长,进食进水较多;造模后第3天体重逐渐下降、进食进水量逐渐减少,大便松散逐渐呈稀便,第5天后肛周可见肉眼血便。干预组小鼠造模后症状同模型组,但灌胃干预后,体重逐渐升高,进食进水量逐渐增加,大便量增加。
2.21,25(OH)2D3改善DAI及结肠长度 模型组与干预组小鼠DAI均高于对照组(Z=-2.498,P=0.013;Z=-2.400,P=0.016),而干预组与模型组比较差异无统计学意义(Z=-0.369,P=0.712)。模型组、干预组结肠长度短于对照组(t=21.176,9.954,均P<0.01),而干预组小鼠结肠长度长于模型组(t=16.088,P<0.01),见表2。三组小鼠结肠长度测量结果见图1。
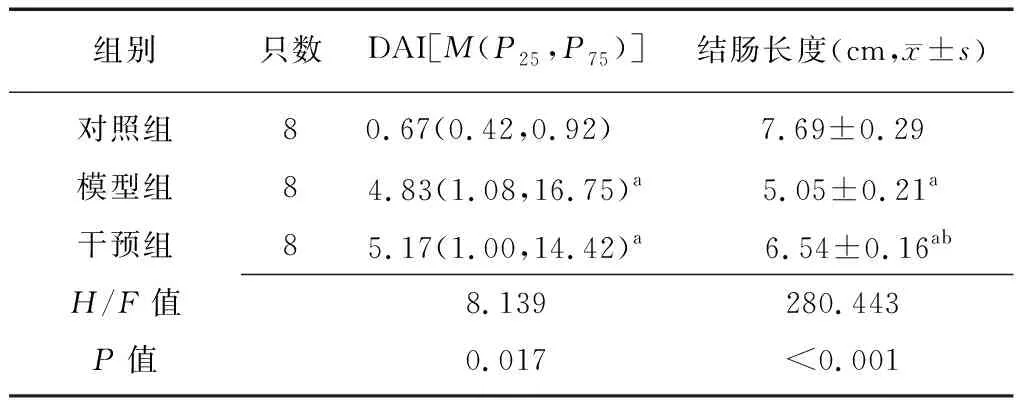
表2 各组小鼠DAI及结肠长度比较
DAI:疾病活动指数;a与对照组比较,P<0.05;b与模型组比较,P<0.05


图1 对照组(1a)、模型组(1b)及干预组(1c)小鼠结肠长度
2.31,25(OH)2D3改善结肠组织病理损伤 对照组镜下结肠组织结构基本正常,模型组小鼠显示结肠结构紊乱,包括炎症细胞浸润、腺体萎缩,部分可见淋巴滤泡形成等,见图2。干预组小鼠结肠病理损伤较模型组改善,干预组与模型组小鼠组织病理评分分别为(17.75±2.87)分、(15.00±2.62)分,差异无统计学意义(t=2.004,P=0.065)。
2.41,25(OH)2D3对结肠组织中TNF-α表达的影响 对照组、模型组及干预组TNF-α mRNA相对表达量分别为1.00±0.00、2.85±0.08、2.74±0.06,三组间比较差异有统计学意义(F=989.112,P<0.01),模型组及干预组TNF-α mRNA表达水平显著高于对照组(t=39.147、54.129,均P<0.01),而干预组TNF-α mRNA表达与模型组比较差异无统计学意义(t=1.925,P=0.127)。

图2 对照组(2a)、模型组(2b)及干预组(2c)小鼠结肠组织病理结果图像(HE ×200)
2.51,25(OH)2D3对凋亡途径的影响 模型组与干预组小鼠结肠组织NF-κB p65表达均高于对照组小鼠(Z=-3.489,-3.491,P均<0.01),而干预组和模型组比较差异无统计学意义(Z=-1.489,P=0.138)。模型组和干预组caspase-3高于对照组(Z=-3.475,-3.491,均P<0.01),而干预组与模型组比较差异无统计学意义(Z=-1.560,P=0.119)。见表3。 NF-κB p65、caspase-3在对照组结肠组织内无表达,两者在模型组和干预组黏膜层、黏膜下层腺体内及其炎症细胞中均有表达,但两者在干预组中表达较模型组低,见图3。
3 讨 论
约1/4的炎症性肠病患者在20岁前被诊断[14]。儿童炎症性肠病的发生率逐年升高,其肠道外并发症、营养不良等发生风险较成人更为显著。研究发现,炎症性肠病患者存在不同程度的维生素D缺乏,在儿童炎症性肠病患者中更为明显。额外补充维生素D能否作为一种新的治疗手段仍不确定。DSS诱导的结肠炎小鼠模型与人类溃疡性结肠炎患者临床表现及组织病理损伤类似,包括食欲下降、体重减轻、腹泻、便血、炎症细胞浸润、腺体萎缩等[15-16]。因此,本研究利用DSS结肠炎小鼠作为研究模型。
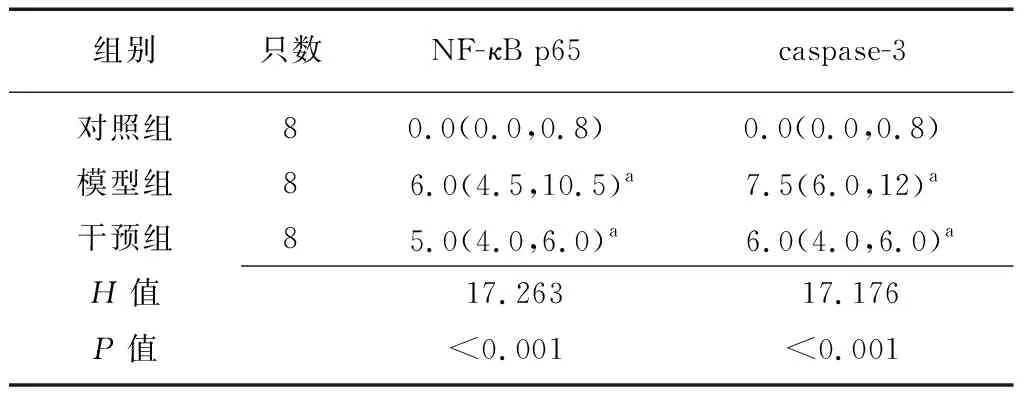
表3 各组小鼠结肠组织内NF-κB p65、caspase-3相对表达水平比较 [M(P25,P75)]
NF-κB:核因子κB;caspase-3:胱天蛋白酶3;a与对照组比较,P<0.05
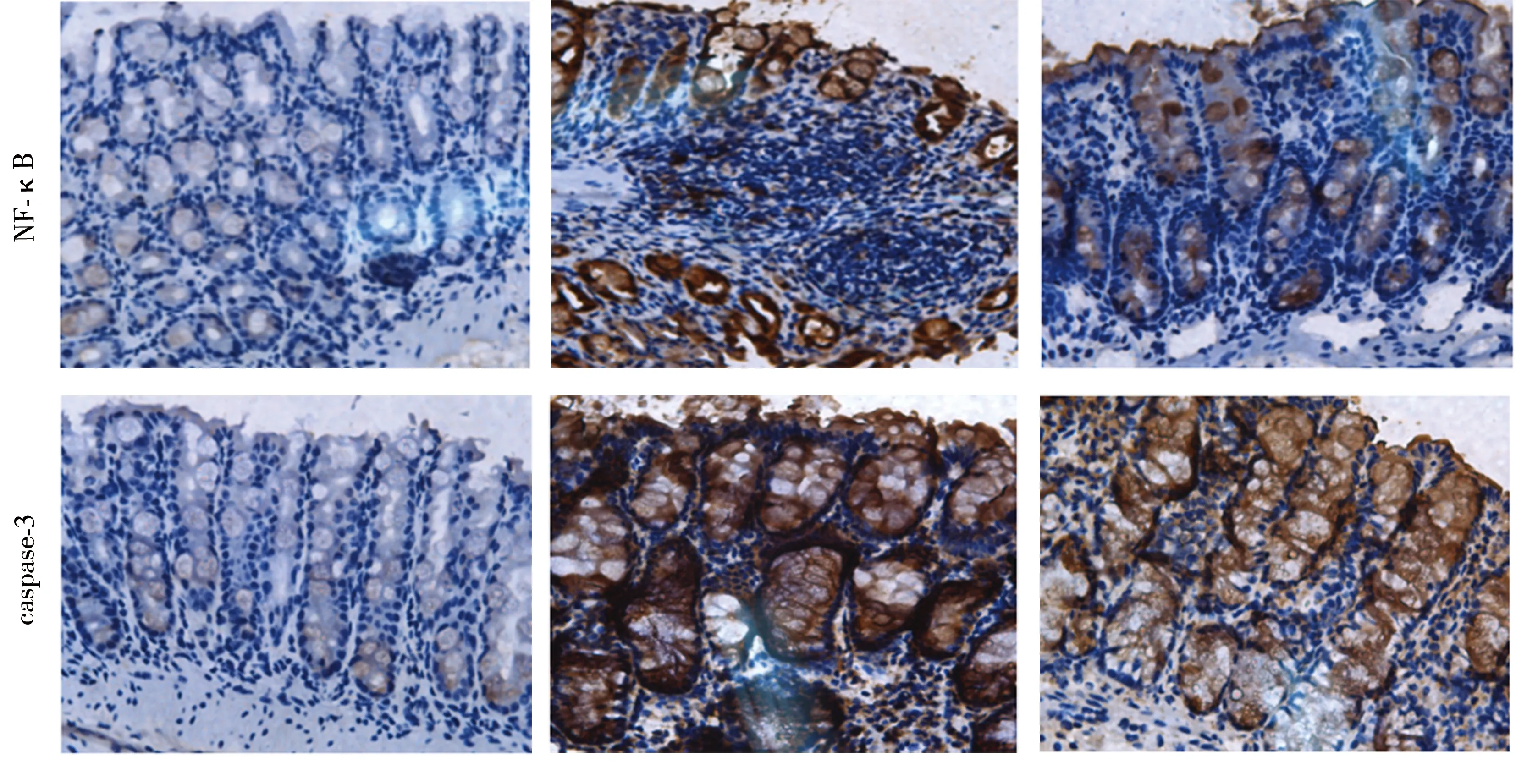
对照组 模型组 干预组
NF-κB:核因子κB;caspase-3:胱天蛋白酶3
图3 对照组、干预组及模型组小鼠NF-κB p65、caspase-3表达图像(HE ×200)
本研究结果显示,模型组和干预组DAI高于对照组,与既往研究一致[17]。对比结肠长度,模型组较对照组显著缩短,而干预组较模型组改善。本研究通过HE染色镜检发现,模型组结肠组织病理可见炎症细胞浸润、腺体萎缩,部分可见淋巴滤泡形成等,干预组和模型组组织病理评分比较差异无统计学意义(P>0.05)。因此,建模成功。同时,本研究结果提示,干预组结肠组织也可见结肠炎表现,但严重程度较模型组低,与之前的研究一致[18],表明1,25(OH)2D3可以改善DSS诱导的结肠炎小鼠DAI及结肠组织病理炎症表现。
1,25(OH)2D3是维生素D的活性形式,具有免疫调节特性,对自身免疫性疾病发生及治疗具有潜在作用。VDR是介导1,25(OH)2D3发挥生物效应的核内生物大分子,其在肠道组织内广泛表达。既往研究着重于维生素D/VDR信号通路在炎症性肠病动物模型中免疫调节机制,也有研究表明,维生素D/VDR信号通路可以通过非免疫机制调节炎症性肠病[7-8]。NF-κB信号通路可以调控多种细胞因子、转录因子等基因的表达,参与免疫反应、炎症反应、细胞凋亡等多种生物进程,其也是肠道炎症反应的重要信号通路之一。在实验性小鼠模型中发现,NF-κB 可以调节多种促炎因子与抗炎因子表达,如TNF-α、白细胞介素-4、白细胞介素-6、白细胞介素-10、环加氧酶-2等,调节局部免疫反应,最终导致结肠黏膜损伤[14-20]。本研究结果显示,1,25(OH)2D3可显著降低局部TNF-α mRNA表达,减轻肠道炎症反应,与既往研究结果一致[16]。VDR与NF-κB p65结合可以阻止其发生核转移,阻断NF-κB信号途径,抑制后续级联反应的发生。VDR在肠上皮细胞上表达减少导致NF-κB信号途径的表达增加,从而促进促炎因子的表达。本研究中,模型组NF-κB p65蛋白表达较对照组升高,而干预组较模型组表达降低,表明1,25(OH)2D3可以通过结肠组织内NF-κB信号通路系统调节肠道内炎症反应。故推测1,25(OH)2D3可以通过NF-κB信号通路调节炎症因子平衡,改善结肠炎症。
炎症性肠病患者及小鼠模型中均发现结肠细胞凋亡表达增加,从而导致肠黏膜损伤。肠上皮细胞凋亡使肠上皮屏障受损及肠道损伤。Bax和Bcl-2是B细胞淋巴瘤2家族成员,在细胞凋亡中具有重要作用。Bax是一种促凋亡蛋白,而Bcl-2是一种抗凋亡蛋白,Bcl-2位于线粒体外膜,可竞争性与Bax蛋白结合,形成Bax/Bcl-2二聚体,从而终止凋亡的发生。Bax/Bcl-2比率增加可以促进线粒体内细胞色素C释放进入细胞质。正常情况下,细胞质内caspase-3以无活性酶原形式存在,细胞凋亡信号可以导致其发生裂解而活化,活化后的caspase-3是哺乳动物细胞凋亡中的关键蛋白酶,而细胞色素C能促进caspase-3活化,进而发生下游级联反应,使凋亡发生。本研究显示,1,25(OH)2D3下调caspase-3表达,提示1,25(OH)2D3可以改善DSS诱导的结肠炎小鼠结肠组织细胞凋亡的发生。有研究表明,抑制结肠上皮细胞凋亡及NF-κB信号通路激活可能是1,25(OH)2D3抑制结肠炎症的机制之一[21]。
综上所述,急性结肠炎模型小鼠给予1,25(OH)2D3可显著改善DAI、结肠长度及炎症反应,减轻肠道损伤,并抑制结肠上皮细胞凋亡及NF-κB信号通路相关蛋白的表达,对急性结肠炎小鼠具有较好的干预效果。

