苦参素及Mir-181a对人肝癌细胞耐药株HepG2/ADM裸鼠移植瘤中耐药蛋白P-gp的影响
2覃小珊2陈椿
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院,广西肝脏疾病临床医学研究中心,广西 百色 533000)
原发性肝细胞癌(primary hepatocellular carcinoma,PHC)是世界上最常见的恶性肿瘤之一,在世界卫生组织(World Health Organization,WHO)发表的《全球癌症报告2018》中,肝癌的死亡率仅次于肺癌和结肠癌[1];而根据2019年国家癌症中心发布的中国最新癌症数据显示:在男性患者中,肝癌的发病率仅次于肺癌及胃癌[2]。目前肝癌的治疗手段仍以手术切除为主,辅以放化疗和药物治疗,手术复发率较高、预后差。MicroRNA(简称miRNA)是指广泛存在于动物、植物、病毒中,大小为18~24个核苷酸的非编码RNA小分子,它主要通过与靶基因mRNA的3端非编码区的结合来进行转录后的基因表达调控,从而参与细胞的增殖、凋亡、侵袭和转移等。目前已有研究表明,mir-181a不仅与多种肿瘤的发生发展密切相关,同时也在肝癌细胞的增殖、凋亡、侵袭和转移方面发挥着重要作用[3]。苦参素,从我国传统中药苦参和广豆根提纯而来,具有抗炎、抗肿瘤等多种药理作用。近年来我们课题组前期研究发现,苦参素能够在体外及体内环境中抑制肝癌细胞的增殖、转移,并改善肝癌细胞的多药耐药性[4-5]。因此,本研究通过构建人肝癌细胞耐药株HepG2/ADM裸鼠皮下移植瘤模型,在体内环境中研究苦参素及miR-181a在肝癌化疗耐药中的作用,进而探讨苦参素逆转肝癌化疗耐药的机制,为肝癌的分子治疗提供理论和实验依据。
1 材料与方法
1.1材料
1.1.1细胞株 人肝癌耐药细胞株HepG2/ADM购自广州吉妮欧生物科技有限公司,由本校科研中心保存于液氮中。
1.1.2实验动物 45只SPF级BALB/c-nu雌性裸鼠,4周龄,质量12~13 g,购于湖南省长沙市天勤生物技术有限公司,饲养于SPF级动物房内,裸鼠饲料、水均经高压灭菌处理并由动物实验室提供。
1.1.3主要试剂 苦参素注射液:正大天晴药业集团股份有限公司(批号:国药准字H20057480);注射用盐酸多柔比星:深圳万乐药业有限公司(批号:国药准字H44024359) ; PBS,RPMI-1640细胞培养基、胰蛋白酶消化液来自索莱宝公司,胎牛血清来自Gibco公司;miR-181a mimic,mirna mimic NC购自广州锐博生物技术有限公司;体内转染试剂Entranster-in vivo购自英格恩生物公司;兔抗P-gp、 β-action、辣根过氧化物酶标记羊抗兔免疫球蛋白 G 购自武汉三鹰生物技术有限公司;高效RIPA裂解液购自索莱宝公司;BCA法蛋白定量试剂盒、SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒购自上海碧云天公司;底物发光液购自北京全品速生物科技有限公司;人ABCB1、GAPDH引物购自上海生工;总RNA小量制备试剂盒购自AxyPrep公司;逆转录试剂盒购自Thermo公司; FastStart Universal SYBR Green Master (Rox)购自Roche公司。
1.2方法
1.2.1细胞培养 人肝癌耐药细胞株HepG2/ADM需在阿霉素浓度为2 μg/ml含10%胎牛血清的PRMI-1640细胞培养液中培养以维持其耐药性,并在37℃、5%CO2饱和湿度的培养箱中培养;细胞贴壁生长于培养基中,取对数生长期细胞用于实验。
1.2.2裸鼠耐药模型建立 购买45只4周龄BALB/C裸鼠(均为雌性),严格饲养在恒温(20℃~26℃)、恒湿(50%~56%)、无特定病原体(specific pamogen-free,SPF)的空气洁净层流架内;裸鼠盒、空气过滤罩、垫料、饲料和饮水等均经高压蒸气灭菌,并在无菌条件下2~3 d左右适时更换。适应性饲养1周后,常规消毒,右前肢腋背部皮下接种HepG2/ADM细胞,接种细胞数为1×107个。接种后继续饲养裸鼠,并每天观察裸鼠的饮食、排便、精神状态。接种7~10 d后,在接种部位可见米粒大小的结节,触之质硬时为HepG2/ADM裸鼠移植瘤构建成功。
1.2.3实验分组及处理 待肿瘤长至直径5 mm时,从45只裸鼠中随机选取42只,其余3只备用,取42只雌性裸鼠随机分为6组(苦参素组、阿霉素组、miR-181a mimic组、苦参素+miR-181a mimic组、mirna mimic NC组、空白对照组),每组7只,分别瘤内注射:苦参素,阿霉素,miR-181a mimic,苦参素+miR-181a mimic,mirna mimic NC,PBS,每两天一次,共注射18 d。苦参素组:每只裸鼠注射苦参素100 mg/kg;阿霉素组:每只裸鼠注射阿霉素6 mg/kg;miR-181a mimic组:取5 μg miR-181a mimic溶于8 μl体内转染剂 Entranster-in vivo中,然后以PBS稀释至终浓度50 μg/ml,每只裸鼠每次注射0.1 ml;苦参素+miR-181a mimic组:每只裸鼠注射0.1 ml浓度为50 μg/ml的miR-181a mimic和苦参素100 mg/kg;mirna mimic NC组:取5 μg mirna mimic NC溶于8 μl体内转染剂Entranster-in vivo中,然后以PBS稀释至终浓度50 μg/ml,每只裸鼠每次注射0.1 ml;空白对照组:直接注射0.1 ml PBS。
1.2.4观察和测量 接种后每天观察裸鼠的饮食、排便、精神状态。隔天观察并测量成瘤体积大小,计算1/2×最长径线(mm)×(最短径线)2(mm2)为瘤体体积(mm3)。开始给药后,每次注射前,重新测量瘤体体积并记录,根据数据绘制生长曲线。注射结束后,拉颈法处死裸鼠,用手术剪和手术刀剥离瘤体,进行拍照并称取肿瘤重量;取部分瘤组织作常规固定,石蜡包埋,切片,HE染色后观察组织病理学;剩余部分瘤组织放置于-80℃冰箱,用作其余实验。
1.2.5免疫组织化学检测P-gp蛋白的表达 取出部分瘤体使用4%甲醛固定,蜡块包埋与切片后染色。结果判定标准:在细胞质或/和细胞膜出现黄色、棕色或褐色颗粒的细胞为P-gp阳性细胞,每个样本切片在400倍光镜下随机选取1个视野,四组共20个视野,用IPP 6.0(Image-Pro Plus)图像分析系统扫描后,取各组的视野积分光密度值(IOD)进行对比。
1.2.6Western blot 法检测P-gp蛋白的表达 提取各组总蛋白,BCA 法检测各组总蛋白浓度并配平,加入上样蛋白缓冲液后100℃加热变性, 按照SDS-PAGE凝胶试剂盒制胶,上样5 μl,70 V电泳,待溴酚蓝进入分离胶时将电压调为120 V,溴酚蓝到达胶的底部时停止电泳(约1.5 h);准备膜与凝胶,制作转移“三明治”膜,在电流0.3 mA中转膜1~2 h,转膜结束后取出PVDF膜,加入封闭液封闭15 min,用TBST漂洗3次,根据抗体说明书稀释一抗,将PVDF膜与一抗共孵育,在4℃中孵育过夜,根据抗体说明书稀释二抗,取出PVDF膜,用TBST漂洗3次,将PVDF膜与二抗共孵育1 h,取出PVDF膜,用TBST漂洗3次,最后加入发光液进行曝光。使用 Image J 软件分析各条带灰度值。
1.2.7实时荧光定量PCR法检测ABCB1基因的表达 使用总RNA小量制备试剂盒(AP-MN-MS-RNA-50G)和逆转录试剂盒(K1622)提取总RNA并逆转录成cDNA。按4913914001-5 ml试剂盒说明进行两步法扩增,然后溶解、冷却。ABCB1引物由上海生工公司设计合成,F:GATTGCTCACCGCCTGTCCAC,R:CGTGCCATGCTCCTTGACTCTG。内参HS-GAPDH,F: CAGGAGGCATTGCTGATGAT,R:GAAGGCTGGGGCTCATTT。计算:Ct(目标基因-内参基因),Ct(样品△Ct-空白对照样品△Ct),结果是2-△△Ct。
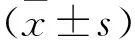
2 结果
2.1肿瘤生长情况及裸鼠一般状况 裸鼠成瘤率为100%,将肿瘤细胞接种于裸鼠右背近腋部皮下,15 d左右可见皮下肿瘤结节,瘤体长径5~6 mm,肿瘤为类圆形,表面光滑。实验期间各组裸鼠均存活,且未出现明显异常,大小便及饮食情况均正常。干预18 d后,各组体积皆为正态分布,因方差具有齐性,采用LSD法组间两两比较,阿霉素组、空白对照组及mirna mimic NC组之间差异无统计学意义(P>0.05),其他组之间两两比较差异均有统计学意义(P<0.05)。表1、图1可见,miR-181a mimic组对肿瘤的生长促进作用最好,苦参素+miR-181a mimic组的促进效果次之,苦参素组对肿瘤的生长抑制作用明显,单独使用阿霉素对人肝癌耐药细胞株HepG2/ADM移植瘤效果较差。
表1干预18d后各组移植瘤体积比较单位:mm3

组别瘤体积miR-181a mimic组558.86±13.32acdef苦参素组152.57 ±3.67abdef苦参素+ miR-181a mimic组414.71 ±8.90abcef阿霉素组258.71 ±8.77bcdmirna mimic NC组283.57 ±7.64bcd空白对照组275.29 ±7.86bcdF259.530P<0.05

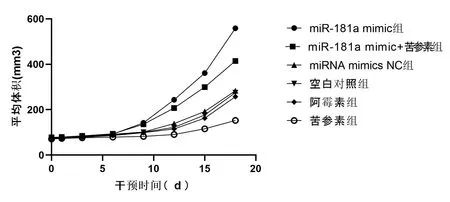
图1 各组移植瘤体积生长曲线图
2.2病理学结果及HE染色 表面观察形态裸鼠移植瘤和人肝癌组织相似。早期移植组织一般显示为坚硬结节状,随着时间推移,逐步显示为圆形。部分为卵形或不规则形,上面有突起。裸鼠体内未出现转移灶、腹水、胸水。200倍数光镜下观察HE染色。见图2。所有样本组织结构与细胞形态都没有明显区别,体现为肝癌实体:细胞大小不均,其胞质为嗜碱性,核浆比例增多,核分裂随处可见;一部分肝癌细胞有脂肪变性现象,有小片或大片凝固性坏死。miR-181a mimic组(见图2A)与苦参素+miR-181a mimic组(见图2B)类似,凝固性坏死较少。miRNA mimics NC组(见图2C)、空白对照组(见图2D)及阿霉素组组(见图2E)出现少量凝固性坏死。苦参素组(见图2F)出现大片凝固性坏死。结果表明:阿霉素对人肝癌耐药细胞株HepG2/ADM基本无效,苦参素有促进肿瘤组织坏死作用,miR-181a mimic有抑制肿瘤组织坏死作用。

图2 各组移植瘤石蜡切片HE染色表现(200倍光镜下)
注:A为miR-181a mimic组;B为苦参素+miR-181a mimic组;C为miRNA mimics NC组;D为空白对照组;E为阿霉素组;F为苦参素组
2.3P-gp蛋白免疫组化结果 P-gp若呈阳性,染色多数在细胞胞浆内(部分在包膜),颜色呈棕黄色或褐色,在组织视野中出现片状、弥漫分布。经过IPP 6.0扫描后,取各自的视野积分光密度值(IOD)进行对比。得出IOD值后用SPSS 24.0处理数据。因方差具有齐性,使用LSD法,空白对照组与mirna mimic NC组之间差异无统计学意义(P>0.05),其他组之间两两比较差异均有统计学意义(P<0.05)。表2、图3可见miR-181a mimic组P-gp蛋白表达最高,其次是苦参素+miR-181a mimic组和阿霉素组,苦参素组中P-gp蛋白表达明显降低。

表2 各组P-gp蛋白表达积分光密度值IOD对比

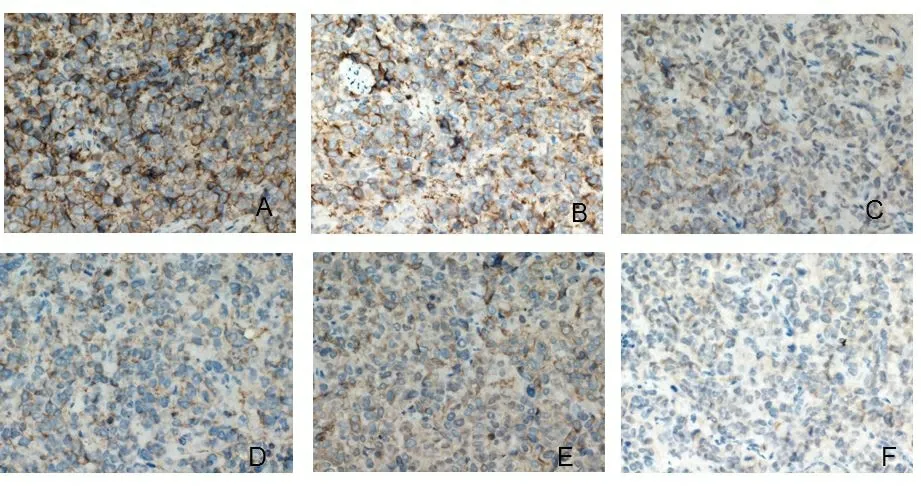
图3 各组P-gp蛋白免疫组化图(400倍光镜下)
注:A为miR-181a mimic组;B为苦参素+ miR-181a mimic组;C为miRNA mimics NC组;D为空白对照组;E为阿霉素组;F为苦参素组
2.4Western Blot法检测P-gp蛋白的结果 曝光后的图片经Image J软件进行分析,得出灰度值后用SPSS 24.0处理数据,各组内参蛋白β-action的表达经统计学分析无显著性差异。因方差具有齐性,使用LSD法,空白对照组与mirna mimic NC组之间差异无统计学意义(P>0.05),其他组之间两两比较差异均有统计学意义(P<0.05)。图4、图5、表3可见miR-181a mimic组P-gp蛋白表达最高,其次是苦参素+miR-181a mimic组和阿霉素组,苦参素组中P-gp蛋白表达最低。
2.5实时荧光定量PCR法检测ABCB1 mRNA结果 空白对照组与mirna mimic NC组之间差异无统计学意义(P>0.05),其他组之间两两比较差异均有统计学意义(P<0.05)。表4、图6可见miR-181a mimic组中ABCB1基因表达最高,其次是苦参素+miR-181a mimic组和阿霉素组,苦参素组中ABCB1基因表达最低。
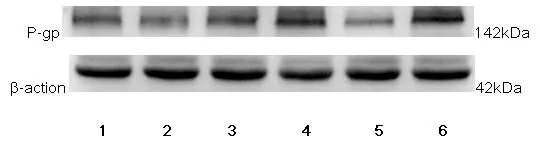
图4 各组移植瘤中P-gp蛋白及β-action蛋白的Western Blot蛋白印迹图
注:1为空白对照组;2为mirna mimic NC组;3为阿霉素组;4为苦参素+ miR-181a mimic组;5为苦参素组;6为miR-181a mimic组

图5 各组移植瘤中P-gp蛋白的相对表达
表3各组移植瘤中P-gp蛋白相对表达量

组别相对表达量miR-181a mimic组1.07±0.05acdef苦参素组0.54±0.07abdef苦参素+miR-181a mimic组0.96±0.03abcef阿霉素组0.84±0.02abcdfmirna mimic NC组0.69±0.09bcde空白对照组0.72±0.09bcdeF30.292P<0.05

3 讨论
肝癌传统的治疗方式主要可分为手术切除、肝移植、局部消融、常规化疗以及综合辅助治疗等。但由于目前大部分的HCC患者被诊断出肝癌时已经处于疾病晚期,中位生存期仅为6~8个月,因此手术切除后再进行辅组化疗是目前应用最广泛的肝癌根治性治疗方法。常用的化疗药物包括索拉非尼、阿霉素、5-氟尿嘧啶、含铂抗癌药物等,但是这些药物对患者的生存率改善并不明显,主要原因就是多药耐药性的产生。多药耐药现象几乎存在于所有恶性肿瘤中,是指一种肿瘤细胞同时对多种结构和作用机制完全不同的抗肿瘤药物产生交叉耐药性的现象,临床上多分为原发耐药和继发耐药两种。目前认为肿瘤原发耐药与基因遗传学水平的变异密切相关,而继发耐药与不改变DNA序列的基因表观遗传学水平的变异密切相关,常见的方式有对组蛋白、非编码RNA序列以及DNA位点的修饰,其结果往往会影响到相关基因序列的表达,从而影响到继发耐药的产生过程[6]。关于肿瘤多药耐药,目前研究认为其机制主要有[7-8]:以耐药相关蛋白的表达等为例的生化耐药,常起因于肿瘤细胞的遗传特性发生生物化学修饰改变所致的;机体在不同病理情况下产生的药理性耐药,常起因于作用于肿瘤细胞的有效的药物浓度减少所致的;以及在遗传信息分子因素发生变化产生的细胞凋亡耐药,常起因于不同促抗凋亡基因的异常表达所致的。而后者与临床上使用的诸多化学治疗药物作用原理相关,因此,进一步探索逆转细胞凋亡耐药的有效途径,将会为提高临床化学治疗质量带来希望。

表4 各组移植瘤中ABCB1 mRNA相对表达量

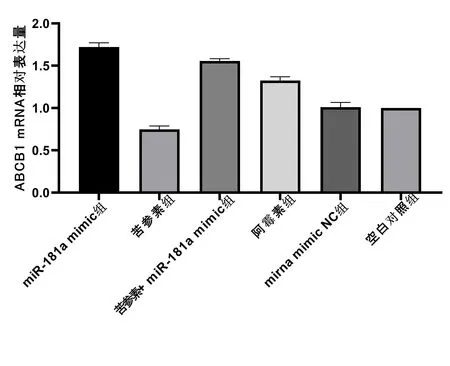
图6 各组移植瘤中ABCB1 mRNA的相对表达
miR-181a是miR-181家族成员之一,其作用机制主要通过与靶基因mRNA的3 端非编码区的结合来进行转录后的基因表达调控,从而参与细胞的增殖、凋亡、侵袭和转移等。有研究显示miR-181a不仅参与肿瘤的增值、侵袭和转移,还参与多种肿瘤的多药耐药性的产生,并在不同的肿瘤耐药中具有不同的作用,如miR-181a可促进使乳腺癌细胞对阿霉素的耐药性[9],但在肺癌中miR-181a却可以提高肺癌细胞对化疗药物的敏感性[10]。在肝癌中,已有研究发现miR-181a在耐药的肝癌细胞中高表达[11],Azumi J等[12]研究发现miR-181a可以通过靶向抑制信号转导因子RASSF1来诱导肝癌细胞对索拉菲尼耐药。而我们课题组前期研究已发现miR-181a可以通过抑制促凋亡蛋白Bim的表达来促进肝癌细胞对阿霉素的耐药性[13]。苦参素,是从豆科槐属植物苦参中提取分离出的一种生物碱,以氧化苦参碱为主,并含有少量氧化槐果碱。苦参素在体外具有抑制人肝癌细胞HepG2增殖、侵袭和迁移能力的能力[14],用于晚期肝癌患者和肝功能严重失代偿无法耐受其他治疗的患者,可改善机体全身状况,延长生命。近年来也有研究表明苦参素有逆转肿瘤MDR的作用[15-16],我们课题组前期研究也发现,苦参素可以通过调控ABCG2的表达来提高阿霉素抗人肝癌耐药裸鼠移植瘤的疗效[17]。
近年研究发现,miR-181a与肿瘤的发生发展密切相关,并参与多种肿瘤化疗耐药,我们课题组已对苦参素抗肿瘤作用研究多年,发现其具有抗肝癌作用和部分逆转肝癌细胞耐药作用。故本实验以人肝癌细胞耐药株HepG2/ADM皮下移植瘤裸鼠为研究对象,利用HE染色法、免疫组化法、Western-blot法、实时荧光定量PCR法等技术,在体内环境中研究苦参素及miR-181a对人肝癌细胞耐药株HepG2/ADM裸鼠移植瘤中耐药蛋白P-gp的影响,从而探讨苦参素及miR-181a在肝癌化疗耐药中的作用。实验发现,与空白对照组相比,miR-181a mimic组的P-gp蛋白及ABCB1基因的表达提高,而苦参素组的P-gp蛋白及ABCB1基因的表达降低;与miR-181a mimic组相比,加入苦参素的苦参素+miR-181a mimic组P-gp蛋白及ABCB1基因的表达降低。所以miR-181a在裸鼠体内可能参与调节肝癌细胞对化疗药的敏感性,能够通过促进P-gp蛋白的表达而提高其多药耐药性,而苦参素可在裸鼠体内通过抑制P-gp蛋白的表达,从而逆转肝癌耐药细胞HepG2/ADM的耐药性。
综上所述,本研究发现,苦参素在体内环境中不仅可以抑制人肝癌耐药移植瘤的生长,还可提高人肝癌耐药细胞对化学治疗药的敏感性,而miR-181a在体内环境中可以促进人肝癌耐药移植瘤的生长,提高人肝癌耐药细胞的多药耐药性。这一研究进一步探讨了苦参素逆转肝癌化疗耐药的机制,为肝癌的分子治疗提供理论和实验依据。

