川射干的基础研究与临床转化应用
尹竹君 陈世龙 李莉 方清茂 曾瑾 吴诗惠 黎勇 赵军宁

摘要 川射干为2005年收载入中华人民共和国药典的川产道地药材,是治疗咽喉肿痛的常用中药。近年来随着川射干基础研究的不断深入以及相关的中药新药的上市,使其受到了研究学者及诸多医者的广泛关注。本文主要从川射干的基源考证、化学成分、药理作用、药代动力学及临床应用等方面全面总结并分析川射干的基础研究与临床转化应用,以期为该药材的进一步研发提供新的思路。
关键词 川射干;生药学;药理学;临床应用;鸢尾;异黄酮类;咽喉炎;川射干黄酮胶囊
Abstract Iris tectorum Maxim.(Chuan Shegan)is traditional Chinese Medicine commonly used to treat pharyngitis and laryngitis for a long time in China, which was documented in Chinese Pharmacopoeia(2005). In recent years, fundamental research and new TCM or the related formula of Iris tectorum Maxim. have been got more attention. In this paper, we summarized and analyzed the fundamental research and clinical application of Iris tectorum Maxim, including its origin, ancient studies, chemical constituents, pharmacology and clinical application, in order to provide new ideas for the further research and development of Iris tectorum Maxim.
Keywords Iris Tectorum Maxim.; Pharmacognosy; Pharmacology; Clinical application; Isoflavones; Laryngopharyngitis; Chuanshegan Huangtong Capsules
中图分类号:R284.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.02.014
川射干为鸢尾科植物鸢尾Iris tectorum Maxim.的干燥根茎,苦、寒,归肺经,具有清热解毒、祛痰利咽的功效,用于热毒痰火郁结,咽喉肿痛、痰涎壅盛、咳嗽气喘等症状,于2005年收载入《中华人民共和国药典》,属川产道地药材。现将近年来对川射干的基础研究与临床转化应用情况加以总结分析,以期为其临床应用提供支持。
1 生药学研究
1.1 基源研究 鸢尾科射干类药材始载于《神龙本草经》,被称为“治疗喉痹咽痛之要药”。鸢尾科品种外观形状略为相似的有3个种:一个是鸢尾科鸢尾属植物射干Belamcanda chinensis(L)DC.,一个是鸢尾科鸢尾属白花射干Iris japonica Thunb.;一个是鸢尾科植物鸢尾Iris tectorum Maxim.以上3种植物虽为同科,性味较接近,但为不同种[1]。在《中国植物志》中,鸢尾科共分11属,其中鸢尾属(Iris)又包括6个亚属:无附属物亚属、琴瓣鸢尾亚属、尼泊尔鸢尾亚属、野鸢尾亚属、鸡冠状附属物亚属、须毛状附属物亚属。
川射干是2005版《中华人民共和国药典》(一部)新增药材之一,是鸢尾Iris tectorum Maxim.的干燥根茎,在民间常被当作射干应用[2]。射干于1990年就被《中华人民共和国药典》载入,为鸢尾科植物射干Belamcanda chinensis(L)DC.的干燥根茎。两者为同科不同属植物,需要从性味、归经、功效、主治等方面对其不同性加以区别。目前已有的川射干中药材标准有《四川省中药材标准(1987年版)》,川射干中药饮片包括《贵州省中药饮片炮制标准(2005年版)》《湖南省中药饮片炮制标准(2010年版)》《江西省中药饮片炮制标准(2008年版)》《陕西省中药饮片标准第二册》《重庆市中药饮片炮制规范(2006年版)》等。由四川大学、四川省食品药品检验所牵头的“川产道地药材川射干的标准化研究”在对川射干基源、名称、原植物、产地分布、采收加工及应用历史与现状进行文献调研与考察的基础上,开展了川射干与药典所载射干的显微鉴别、色谱鉴别、含量测定等分析比较研究,发现川射干与药典载射干存在显著差异。其薄层色谱显现出药典载射干没有的特异性亮绿色荧光斑点,川射干中射干苷的平均含量高达4.6%,在此基础上,侯世祥教授带领团队制订并完善了川射干药材质量标准,为《中华人民共和国药典》2005年版川射干的收载奠定了坚实的基础。
1.2 道地性考证 川射干在1987版《四川省中药材标准》中被正式载入:“经研究,鸢尾Iris tectorum Mazim.和射干(Belamcanda chinensis(L)DC.)的化学成分和药理作用相似,且在我省作为射干使用的历史较长,故收入本标准,以‘川射干为正名,鸢尾为副名”[3]。经专家考证,射干的名称及含义变化经历了漫长的过程:在元代以前一直与鸢尾分开分别药用,但各个时期的划分方法有所不同。而元代以后,射干与鸢尾不再完全划分,但在这一时期,药用射干均为紫花,即鸢尾。正所谓“陶弘景曰射干和鳶尾是一种;苏恭陈藏器曰紫花者是鸢尾,红花者是射干;苏颂曰花红黄者是射干,白花者亦其类;朱震亨曰紫花者是射干,红花者非,各执一说,何以凭依?”[4]。现代研究表明,利用内部简单重复序列ISSR标记仅能用于射干与其混伪品间的分子鉴定,而采用目标起始密码子多态性SCoT分子标记技术能稳定、快速、准确的用于射干、川射干药材的分子鉴定[5]。更有学者利用流式细胞仪碘化丙啶(Propidium Iodide,PI)染色法分别测定鸢尾、射干和巴西鸢尾新鲜叶片核悬液的荧光吸收强度以估算3种鸢尾科植物基因组的大小,以期为药材的鉴定提供科学依据[6]。
1.3 生产区划 全世界约有鸢尾属植物300种,分布于北温带。鸢尾生于海拔500~3 500 m向阳坡地、林缘及水边湿地,我国约产60种、13变种及5变型,主要分布于我国的西南、西北、东南、华中等地区。全世界有射干2种,分布于亚洲东部[7]。川射干药材主要来源于野生资源,胡平等[8]对川射干野生资源的分布、生态环境进行了调查研究,结果发现四川省成都、中江、井研、甘洛、越西、宝兴、安县、青川、茂县、宣汉等地均有分布。而在该文研究的几个产地中,井研的川射干单株块茎最重(19.68 g),其长、宽、厚均具有明显优势,可考虑作为最佳的产地或种源。
2 化学成分
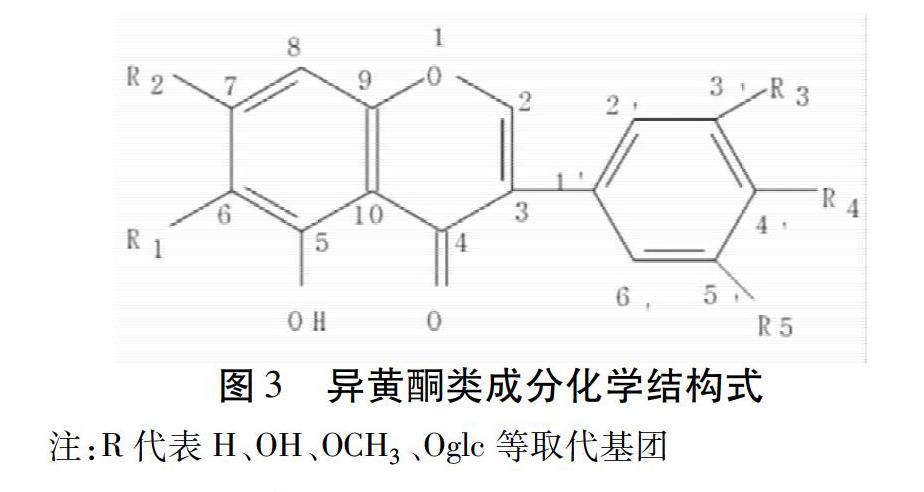
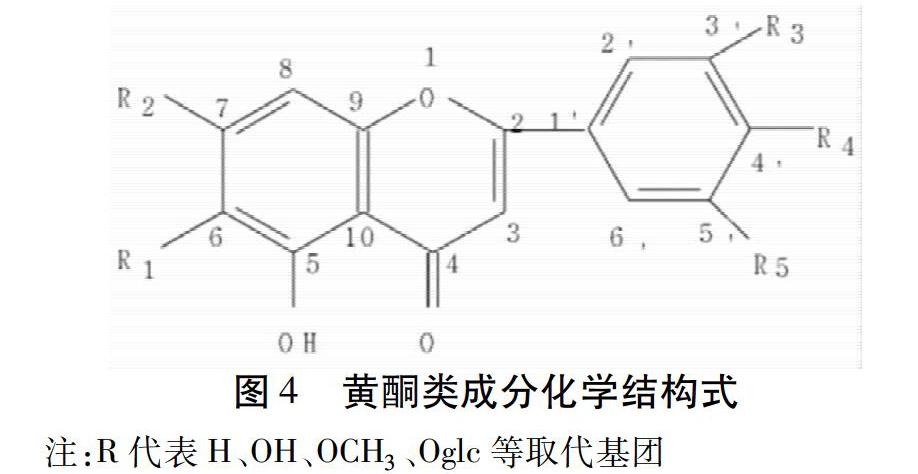
川射干所含化学成分主要包括异黄酮类化合物及其糖苷,黄酮类化合物及其糖苷,苯醌类化合物,三萜类化合物及其皂苷等[9-10]。其中,鸢尾属植物的特征性化学成分为异黄酮类化合物。结构见图3。
2.1 异黄酮类化合物 异黄酮类化合物为川射干的主要活性成分。研究人员先后从川射干中分离出鸢尾苷(也称射干苷,Tectoridin)、鸢尾苷元(也称鸢尾黄素,Tectorigenin)、白射干素(Dichotomitin)、野鸢尾苷(Iridin)、野鸢尾黄素(Irigenin)、次野鸢尾黄素(Irisflorentin)、(Tectorigenin)、德鸢尾素(Irilone)、染料木素、鸢尾新苷A(Iristectorin A)、鸢尾甲黄素A(Iristectorigenin A)、鸢尾新苷B(Iristectorin B)、二甲基鸢尾苷元(Dim-Ethy-Tectorigenin)、二氢山柰甲黄素(Dihydrokaempferide)和鸢尾苷元-7-O-葡萄糖-4-O-葡萄糖苷(Tectorigenin-7-O-Bglucosy-L-4′-O-β-Glucoside)、甲基鸢尾苷元(Dim-Ethy-Tectorigenin)、5,7,4′-三羟基-6,3′-二甲氧基异黄酮(5,7,4′-Trihydroxy-6,3′-Dimethoxyisoflvone)等异黄酮化合物[11-14]。
杨勇勋等[15]采用大孔吸附树脂——酸水解法制备川射干总异黄酮苷元,制备的总异黄酮苷元的含量在59%~63%之间。通过测定川射干中7个异黄酮成分含量,发现射干苷含量最高35~52 mg/g,鸢尾苷元次之6~24 mg/g,成分含量根据样品产地不同而不同[16],陈帅等[10]建立的川射干HPLC含量测定方法可用于川射干的质量控制,聚类分析方法也可为该种属植物的种植、栽培和质量评价提供科学依据。Wu等[17]利用AB-8树脂柱色谱分离川射干粗提物中总黄酮类成分由传统分离方法的10.60%提高到54.20%,随后结合Prep-HPLC纯化分离得到的6种异黄酮类成分——鸢尾苷、鸢尾甲苷B、鸢尾甲苷A、鸢尾黄素、鸢尾甲黄素A、鸢尾甲黄素B(纯度分别为99.8%,98.2%,82.2%,99.6%,92.5%,95.8%)。
2.2 黄酮类化合物 川射干中可分离到的黄酮类化合物主要有茶叶花宁(Apocynin)、鼠李柠檬素(Rhamnocitrin),染料木素(Geristein),鼠李秦素(Rhamnazin)、Kanzakifla-Vone-2,二氢山柰甲黄素、二茶叶花宁[14]等。粗毛豚草素(Hispidulin),黄酮醇类有异鼠李素(Isorhamnetin)、3′-O-甲基鼠李素(Rhamnazin)。
2.3 挥发油成分苯醌类化合物 川射干中可提取到的挥发油成分主要有[18]十四酸(Myristic Acid)、十四酸甲酯(Irisqui-None),射干醌(Belamcandaquinone)、鳶尾烯(Tetra-Decanoic Acid)、5-庚基二氢-2(3H)-呋喃酮[5-Heptyldihydro-2(3H)-Furanone]、6-庚基四氢-2H-吡喃-2-酮(6-Heptyltetrahydro-2H-Pyran-2-One)、二十一烷(Heneicosane)、3-羟基-苯甲醛肟(3-Hydroxyl-Benfromoxine)。此外还有正丁基-β-D-吡喃果糖苷(N-Butyl-β-D-Fructopyranoside)、草夹竹桃苷(Androsin)、胡萝卜苷(Daucosterol)、β-谷甾醇(β-Sitosterol)和点地梅双糖苷(Tectoruside)。
2.4 其他成分 除异黄酮类、黄酮类化合物及挥发油外,川射干还含有三萜类化合物:二环三萜类化合物和鸢尾型的脂肪酸酯,豆甾醇等。近年来从川射干中分离出一系列结构复杂的新骨架鸢尾醛型三萜,结构见图5,而且这类三萜成分仅在鸢尾科植物中发现[19-22]。
3 药理研究
药理研究表明,川射干总黄酮具有镇咳祛痰、解热止痛、抗炎、抗菌、抗病毒等作用,是川射干的有效部位。川射干乙醇提取物具有抗炎、抗肿瘤、抗氧化、降血脂,清除自由基和雌激素样作用;鸢尾苷是川射干中的主要活性成分,也是川射干质量控制的指标之一,其具有抗炎、雌激素样作用、保肝、抗氧化等活性[23]。川射干中的其他有效成分还具有抗炎、抗氧化、抗肿瘤、神经保护等作用。
3.1 镇咳祛痰作用 吴泽芳等[24]研究发现,鸢尾醇提物(小鼠25 mg/kg,大鼠15 g/kg)灌胃给药,对动物炎性反应早期和炎性反应晚期均有明显抑制作用,同时对小鼠有明显的祛痰作用。此外,还能明显抑制巴豆油所致的炎性渗出和增生,同时显著增加小鼠呼吸道排痰量。刘亚灵等[25]用川射干提取的有效部位制成的胶囊(1.0、0.5、0.25 g/kg),分别灌胃小鼠和豚鼠3 d,并统计小鼠和豚鼠的咳嗽次数,结果表明川射干有效部位能显著抑制浓氨水诱导的小鼠和枸橼酸诱导的豚鼠咳嗽反应。
3.2 解热止痛抗炎作用 异黄酮类成分鸢尾苷、鸢尾黄素均能抑制腹膜巨噬细胞中环氧合酶2(COX-2)的诱导,从而抑制前列腺素E2(PGE2)的产生[26]。染料木素能通过抑制NF-κB、NLRP3炎性反应小体、STAT3等多种途径抗炎[27-28]。宁楠等[29]用咽喉康胶囊内容物分别灌胃给药角叉菜胶致热模型大鼠(0.125、0.25、0.5 g/kg)和干酵母致热模型大鼠(1.0、0.25、0.5 g/kg),并分别测定肛温。结果表明鸢尾总黄酮提取物对角叉菜胶致大鼠体温升高有明显的降低作用,6 h、8 h的体温较对照组降低明显,10 h较对照组显著降低(P<0.05);对干酵母致大鼠体温升高有显著降低的作用(P<0.01或P<0.05),且呈量效依赖关系。刘亚灵等通过醋酸扭体法、热板法观察其镇痛作用发现,鸢尾总黄酮提取物(1.0、0.5 g/kg,灌胃1 d)能显著减少醋酸致小鼠的扭体次数,延长小鼠热板痛阈值[25]。
3.3 抗菌抗病毒作用 鸢尾苷及鸢尾苷元等异黄酮类化合物被认为是川射干抗病毒的主要活性成分。徐学民等[30]合成了一种新的鸢尾苷元衍生物——鸢尾苷元磺酸钠,水溶性为67 mg/mL,远远高于鸢尾苷元(0.1 mg/mL)。抗SARS病毒测试结果显示,鸢尾苷元磺酸钠在Vero-E6病毒感染模型细胞上的半数抑制浓度(IC50)为0.056 mg/mL,治疗指数(TI)为53.57。当鸢尾苷元磺酸钠浓度高于0.062 5 mg/mL时,可显著抑制SARS病毒对Vero-E6细胞的感染,其效力强于利巴韦林。
3.4 抗肿瘤作用 Hoon Jung-Sang等[31]研究了鸢尾苷及其苷元鸢尾黄素抑制血管增生的活性,并进行了小鼠体内外实验。鸢尾苷和鸢尾黄素(30 mg/kg,腹腔注射,连续10 d)均能有效地抑制Sarcoma 180(S180V)恶性肉瘤小鼠的肿瘤大小,其中鸢尾黄素的抗肿瘤活性更强。鸢尾黄素(30 mg/kg)皮下注射连续20 d能显著抑制鼠Lewis肺癌(LLC)小鼠的肿瘤生长。黄文哲等[32]用MTT法研究发现异黄酮类单体化合物染料木素和鸢尾苷元,在浓度为10 μg/mL时和100 μg/mL时对人胃癌细胞(BGC)和人淋巴样白血病细胞(HL-60)的生长均有不同程度的抑制作用,且这种作用呈剂量依赖性。潘静[33]采用MTT法,研究川射干中鸢尾苷和鸢尾苷元对人胃癌细胞株SGC-7901的作用,结果发现其对人胃癌细胞株SGC7901的生长有一定的抑制作用,鸢尾苷元IC50为79.8 μg/mL,鸢尾苷IC50为176.2 μg/mL,其作用稍弱,而鸢尾甲黄素A作用不显著[32]。Morrissey C.等[34]考察体外环境下鸢尾苷元和野鸢尾苷元对前列腺癌细胞RWPE-1、LNCaP和PC-3的作用。结果表明,鸢尾苷元和野鸢尾苷元(50~100 mol/L)能显著抑制这3种前列腺癌细胞的增殖,该作用可能是通过调控细胞周期来抑制癌细胞增殖,从而降低癌细胞数量的。Thelen等[35]也对鸢尾黄素、鸢尾苷、野鸢尾苷元(100 μmol/L预处理24 h)等其他异黄酮类的抗前列腺癌活性进行了体外实验,发现该类化合物能显著降低LNCaP细胞前列腺癌相关基因的表达,可开发为前列腺癌预防/治疗药物。
3.5 抗氧化作用 秦民坚等[36]分离出川射干的4种成分——异黄酮野鸢尾苷元、鸢尾苷元、鸢尾苷和5,6,7,4′-四羟基-8-甲氧基异黄酮,发现其均具有清除自由基的能力。进一步研究结果显示鸢尾苷元清除O2-、·OH和H2O2氧自由基的能力最强,推测其清除自由基的能力与其异黄酮类化合物结构相关。韩晓静[37]用川射干异黄酮提取物(低、中、高剂量组分别为50、100、200 mg/kg)腹腔注射连续给药3周,研究对Xan-XO系统、双氧水、UV照射诱导的3种细胞膜脂质过氧化细胞模型的影响,发现川射干异黄酮提取物对细胞膜脂质过氧化损伤小鼠也具有一定的保护作用。Hoon Jung-Sang等[31]研究发现,鸢尾苷及其苷元(100 mg/kg,腹腔注射7 d)能显著降低CCl4诱导的肝损伤大鼠血清转氨酶活性,并能大大增强肝细胞中抗氧化酶[过氧化物歧化酶(SOD)、过氧化氢酶(H2O2)和谷胱甘肽过氧化酶(GSH-px)]活性。以上研究表明,鸢尾苷及其苷元不仅具有抗氧化作用,还具有保肝作用。
3.6 神经保护作用 此外,川射干三萜类化合物还具有神经保护作用,从鸢尾中分离得到的新的化合物命名为spirioiridotectals A-F(1-6),体外实验检测发现化合物1、2和6在对抗血清剥夺诱导的PC12细胞损伤中,表现出一定的神经保护活性[19]。于颖[38]采用体外实验观察了鸢尾新苷A和鸢尾新苷B处理的受损神经细胞,结果表明川射干异黄酮类化学成分鸢尾新苷A和鸢尾新苷B均具有明显的神经保护作用。染料木素对脑缺血性损伤、肌萎缩性侧索硬化症、痴呆等疾病有一定作用,染料木素(10 mg/kg)连续灌胃2周,能通过增加脑组织Nrf2与NQO1的表达减轻去卵巢大鼠的脑缺血性氧化损伤[39],并能减轻β淀粉样蛋白(Aβ25-35)诱导的PC12细胞氧化损伤[39-40]。
3.7 药代动力学研究 目前仅有几篇文献报道了鸢尾苷等单體在大鼠中的药动学研究。Qu等[41]分析并鉴定出大鼠单次灌胃鸢尾苷(200 mg/kg)后血清中的4种结合型代谢产物:鸢尾黄素-7-O-葡萄糖醛酸苷-4′-O-硫酸酯(Te-7G-4′S),鸢尾黄素-7-O-葡萄糖醛酸苷(Te-7G),鸢尾黄素-7-O-硫酸酯(Te-7S)以及鸢尾黄素。Zhang等[42]使用液相色谱法测定了大鼠灌胃鸢尾黄素及鸢尾苷后血清中鸢尾黄素的浓度,建立了适用于鸢尾黄素的体内药代动力学研究方法。Yang等[43]使用UPLC-MS/MS分析并比较了大鼠灌胃川射干提取物[ITME(46 mg/kg,灌胃)相当于PT(32 mg/kg,灌胃)]与鸢尾苷(PT,32 mg/kg,灌胃)后的药动学参数变化。该研究显示,灌胃ITME大鼠血清中鸢尾黄素(鸢尾苷的代谢产物)含量远远高于PT组(P<0.01),且t1/2值与AUC0-∞值也显著高于PT组(P<0.01)。因此研究人员推测,川射干提取物中的化学成分可能存在相互作用,该作用可能显著促进大鼠对鸢尾苷的吸收,但具体的作用机制目前并不清楚。
3.8 毒理学研究 现代研究多认为川射干毒性较小,基本可归为无毒性范畴。其乙醇提取物小鼠灌胃给药LD50为39 g/kg,也有报道认为>50 g/kg。而川射干水煎液的LD50为90 g/kg[44]。王琼等[45]将生品川射干(LD50为90.01 g/kg)蜜制后无法测出LD50。韩晓静[37]通过研究川射干异黄酮的相关药效学,发现川射干异黄酮提取物小鼠腹腔注射给药的LD50为1 864 mg/kg。川射干黄酮类提取物(咽喉康胶囊内容物)大剂量1 250 mg/kg给药180 d后33.33%(2/6)Beagle犬肝功能和组织出现轻微异常,停药观察30 d各检查指标未见异常,说明咽喉康胶囊1 250 mg/kg以下剂量长期服用是安全的,而大鼠长期给药的安全剂量在2 500 mg/kg以下[46]。
4 临床应用
4.1 传统经验 川射干在收载入《中华人民共和国药典(2005年版)》之前并未完全与射干区分应用,因此,我们以“射干”“鸢尾”搜索了传统中医记载的相关中药方剂。其中含有射干的经典名方有5个,包括射干麻黄汤、解肌透痧汤、清咽下痰汤、鳖甲煎丸、甘露消毒丹。此外还有治疗咽喉疾病的百部散、白药丸,补下焦虚惫的巴戟丸等168个传统方剂。而涉及“鸢尾”的传统方剂主要有大金牙散、狸骨丸。
射干麻黄汤,源自汉·张仲景《金匮要略》,本方宣肺祛痰,下气止咳,主要用于痰饮郁结,气逆喘咳之证。咳而上气,喉中有水鸡声者。该方于小青龙汤基础上减桂枝、白芍、炙甘草,加入祛痰利肺、止咳平喘之射干、冬花、紫菀等药。方中射干性寒、善降,与麻黄配伍,一降一宣,更能加强肺金的降泄作用,平复上逆的肺气。各医家均认为该方主治寒饮郁肺的哮证,多用于寒哮证[47]。解肌透痧汤出自《丁氏医案》,具有辛凉宣透,清热利咽之功。方中荆芥、浮萍、蝉蜕、白僵蚕、葛根善疏风清热透痧,淡豆豉、竹茹能清热除烦,加以具有清热解毒透疹之功的连翘,清热利咽的生甘草、桔梗、射干等药。该方主治痧麻初起,恶寒发热,咽喉肿痛,妨于咽饮,遍体酸痛,烦闷呕恶。清咽下痰汤《验方新编》(清·鲍相璈)由玄参、桔梗、炒牛蒡子、甘草、浙贝母、瓜蒌、射干、荆芥、马兜铃九味中药组成。具清热解毒、利咽化痰之功,主治热毒攻喉证,临床上多在该方基础上加减治疗流行性风疹、麻疹、急性咽喉炎、小儿风热喉痹等。鳖甲煎丸出自汉·张仲景《金匮要略》,该方由醋鳖甲、射干、黄芩片、柴胡、鼠妇虫、干姜等23味中药组成。具有消痞化积、活血化瘀、疏肝解郁之功,主治肝硬化、肝脾肿大、肝癌等病,血瘀肝郁型黄疸。1985年版《中华人民共和国药典》收录的鳖甲煎丸是将《金匮要略》鳖甲煎丸中人参替换为党参,取其活血化瘀,软坚散结之功,用于胁下癖块。出自《温热经纬》的甘露消毒丹具有利湿化浊、清热解毒之功,主治湿温时疫,邪在气分,湿热并重证。医家主要将其加减(茵陈、藿香、炒杏仁、薏苡仁、白豆蔻、连翘、黄芩、青蒿等药)用于湿热闭肺等证。
4.2 临床新用 综合各类文献资料,川射干临床主要用于治疗呼吸系统疾病,例如上呼吸道感染、急慢性咽炎、扁桃体炎、慢性鼻窦炎、支气管炎、哮喘、肺气肿、肺心病等,单方/复方还可用于治疗微热口臭、腹胀便秘、蛔虫腹痛、痞块、肝硬化腹水、黄疸肝炎、肾气水肿、疟疾等。目前临床射干麻黄汤除用于各类咳嗽、哮喘外,还可用于急慢性支气管炎、慢性喘息性支气管炎、肺炎、上呼吸道感染、肺癌等肺部疾病[48]。李春燕等[49]还将该方用于艾滋病患者肺部感染的治疗中,该患者中医诊断为“喘证,证属痰饮伏肺,肺失宣降”。患者服用射干麻黄汤水煎液3 d后,喘咳、咽痒症状好转,后在此方基础上去掉附子,加入陈皮、香附、木香服用半个月后症状基本缓解。
鳖甲煎丸临床上除用于肝炎、肝硬化腹水、肝纤维化、肝癌、子宫肌瘤、卵巢囊肿及腹腔其他肿瘤等,还被用于水肿病(尿毒症期),乙肝肝硬化失代偿。柳少逸先生根据异病同治原则,将鳖甲煎丸易汤用于水肿病(尿毒症期)的治疗,柳先生认为方中射干、芦根、葶苈子开宣肺气,通透肌表,使邪毒从皮肤、呼吸道排出。该方改善了患者肾积水、肾脏微循环,疗效迅速,标本兼治[50]。汪慧兰[51]发现,恩替卡韦联合鳖甲煎丸治疗半年后能有效改善乙肝肝硬化失代偿患者的肝功能指标,提高临床效果,同时减少并发症的发生。作者推测,两药可能通过协同作用抑制乙肝病毒的产生,从而避免患者发生肝癌或肝硬化。
甘露消毒丹为治疗湿温时疫之主方,该方在内、外、妇、儿、五官、传染等多种疾病的治疗中取得了较好的临床疗效,主要包括粉刺、带下病、喉痹、鼻炎、眼病、皮肤病等[52]。蔡楚君[53]发现,糠酸莫米松喷鼻剂联合甘露消毒丹治疗较单纯使用现代医学治疗可明显改善慢性鼻-鼻窦炎患者临床症状。在眼科临床中,赵越娟[54]用此方加减治疗单纯疱疹病毒性角膜炎、毕夏综合征、中心性渗出性脉络膜视网膜病变等疾病,揭示了该方在眼疾治疗中“异病同治”的特点。四川名中医刘应龙先生[55]将甘露消毒丹灵活运用到了各类儿科疾病中,如暑湿感冒发热、小儿支气管炎、肺炎、鹅口疮、顽固瘙痒、泄泻、细菌性痢疾、手足口病等。天津名中医吴深涛教授[56]还将甘露消毒丹于消渴并发急性湿疹的治疗。
4.3 新药转化研究 与川射干相关的已上市中成药包括虎杖解毒颗粒、小儿哮喘灵颗粒、抗病毒颗粒、消积通便胶囊、川射干黄酮胶囊(咽喉康胶囊)等。目前正在开发的创新中药产品主要有泰克吉宁注射液、抗柯萨奇病毒胶囊等。贵州神奇药业开发的消积通便胶囊用于胃肠实热所致的便秘,脘腹胀痛,食欲不振。该制剂是由川射干粉碎为细粉装入胶囊中。此外,以川射干为主要组分的中药制剂也得到广泛应用。如虎杖解毒颗粒(由虎杖、青蒿、川射干、板蓝根等药材组成),具有清热、解毒的功效,用于上呼吸道感染[57]。成都中医药大学附属医院的经验方小儿哮喘灵颗粒复方是川射干、黄芩等五味药材为处方的颗粒药。可解表化饮,祛痰平喘,在该校附属医院长期应用,疗效确切[58]。另外,夏瑜[59]发明了一种含川射干的治疗鼻炎的丸剂,有较好的治疗效果。用于病毒性感冒的抗病毒颗粒板包含蓝根、忍冬藤、山豆根、川射干、鱼腥草等九味中藥。截止到2019年9月30日,以川射干为主要成分/组分的公开专利12个,进入实质审查阶段的专利29个,授权专利达13个。如罗艳春发明的预防高血压的中药复方,丽珠药业发明的预防/治疗猪流感、禽流感的中药组合物,河南润弘制药发明的消水、消食、消痰、消气的“四消丸”,林海燕发明的治疗阑尾炎的中药组合,昌安达药业发明的治疗创伤的中药散剂等。
四川省中医药科学院(四川省中药研究所)徐学民研究员团队与四川逢春制药有限公司联合研制的新药产品川射干黄酮胶囊(曾用名:咽喉康胶囊),为中药5类新药,于2014年6月获得新药证书。具有清热解毒、消肿利咽作用,用于治疗急性咽炎风热证及轻度急性单纯性喉炎风热证出现的咽喉肿痛、声音嘶哑、咳嗽等。药理实验结果表明,川射干黄酮胶囊具有抗炎、镇痛、解热、止咳和抗病毒等作用[60]。Ⅰ期临床研究表明,川射干黄酮胶囊单次给药0.7、1.4、2.1、3.15 g以及5.25 g连续给药10 d均未出现具有临床意义的指标改变。而单次给药4.2、5.25、6.3 g以及6.3 g连续给药10 d组共出现14例患者轻度腹泻、腹痛等消化系统不良反应,但停药后均自行缓解了。我们推测,川射干黄酮胶囊的不良反应可能是其“行水消积”功效的表现。Ⅱ期及Ⅲ期临床研究证实,在中医辨证为风热证的急性咽炎与急性喉炎的治疗中,川射干黄酮胶囊的疗效均优于银黄胶囊,主要指标包括临床痊愈率、纤维喉镜检查、咽痛发热、中医辨证积分等,2组率的差异有统计学意义(P<0.05)。以Ⅲ期临床研究结果为例,川射干黄酮胶囊对急性喉炎(风热证)(FAS方案集)结果临床疗效临床痊愈率为49.11%,银黄胶囊对照组为31.48%;川射干黄酮胶囊纤维喉镜检查结果临床痊愈率为77.68%,对照组为64.81%。川射干黄酮胶囊对急性咽炎(风热证)(PPS方案集)临床疗效临床痊愈率为36.57%,对照组为30.56%,经CMH卡方检验,2组率的比较差异有统计学意义(P<0.05)。
鸢尾苷元磺酸钠(Tectorigenin Sodium Sulfonate),化学结构式为4′,5′,7′-三羟基-6-甲氧基异黄酮-5′-磺酸钠),由川射干中黄酮类有效成分进行结构修饰得到的新型抗病毒药物,是四川省中医药科学院徐学民等[61-62]研发的中药一类新药,其制剂射干苷元磺酸钠注射液(曾用名:鸢尾苷元磺酸钠注射液,XYW抗病毒注射液、泰克吉宁注射液),列入国家高技术研究发展计划(863计划,2002AA2Z3206),于2008年进入临床阶段。本药物具有抗病毒、抗炎、解热和镇痛作用,用于治疗急性上呼吸道感染和病毒性肺炎,供肌肉注射或静脉滴注。
抗柯萨奇病毒胶囊(曾用名:MJJ抗柯萨奇病毒胶囊)系本单位徐学民等研发的具有独立自主知识产权的化药一类新药,化学名为二乙氧基射干苷元,列入国家科技重大专题新药创制项目(一类新药MJJ原料药及胶囊剂的临床前研究,2009ZX09102~153)。該药主要用于柯萨奇病毒感染引起的心肌炎、心包炎、无菌性脑膜炎,手足口病等疾病。研究结果表明,该药物具有较低的毒性,较强的抗病毒作用[9]。
综上所述,川射干作为一味经典的用于咽喉肿痛的川产道地药材,历经了上千年的中医实践。现代研究与临床试验也证实了川射干活性成分、有效部位、衍生物、川射干单味中药、相关复方在治疗咽喉炎、抗炎、抗病毒、便秘、上呼吸道感染等多种疾病中的显著疗效。川射干相关药物的开发,为我们提供了新药研发的新思路:从传统的中药复方的开发转变为单味中药有效部位或是活性成分衍生物的开发,从传统的中药“无不良反应”认知转变为“如何通过去除脂质降低不良反应”。然而目前的基础研究还不足以支撑川射干的现代化、国际化进程,如川射干一系列产品的药代动力学研究较少,缺乏药效物质基础的系统研究,缺乏其作用机制的深入探讨以及如何促进基础研究向临床应用之间的转化。因此,我们希望通过总结川射干的研究进展,分析目前川射干的研究热点、遇到的问题,为川射干的进一步开发及国际化提供线索。
参考文献
[1]毛水龙.国家2005版药典一部中射干与川射干名称之我见[C].中华中医药学会第九届中药鉴定学术会议论文集,建德:2008.
[2]熊军,张晋文.关于2005版《中华人民共和国药典》(一部)部分中药材和饮片的修订内容[J].中国中医药信息杂志,2006,13(7):8-9.
[3]四川省卫生厅.四川省中药材标准[S].成都:四川科学技术出版社,1987:13-19.
[4]中国医学科学院药物研究所.中药志[M].北京:人民卫生出版社,1959:521.
[5]郑茜,杨倩,陈永钧,等.基于ISSR及SCoT分子标记对射干、川射干药材的分子鉴别[J].中国药学杂志,2018,53(13):1063-1069.
[6]朱敏,王云鹏,熊文波,等.流式细胞仪测定三种鸢尾科植物基因组的大小[J].中药材,2018,41(10):2306-2310.
[7]韩问.药材小常识(六)[M].长春:吉林摄影出版社,2005:1-20.
[8]胡平,舒光明,夏燕莉,等.川射干野生资源产量性状调查研究[J].时珍国医国药,2014,25(6):1478-1479.
[9]袁崇均,陈帅,罗森,等.川产道地药材川射干系统开发研究[J].四川中医,2016,34(10):220-223.
[10]陈帅,袁崇均,罗森,等.不同产地川射干中异黄酮成分含量比较研究[J].药物分析杂志,2018,38(7):1280-1284.
[11]张琳,张妮.川射干的化学及药理研究进展[J].陕西中医学院学报,2014,37(5):91-93.
[12]黄龙.白射干化学成分研究及我国鸢尾属药用亲缘学初探[D].北京:北京协和医学院,2011.
[13]张志国,吕泰省,邱庆浩,等.川射干与射干中异黄酮类化学成分的含量比较[J].中国药师,2013,16(10):1452-1454.
[14]张志国,吕泰省,邱庆浩,等.川射干中非异黄酮类化学成分研究[J].中药材,2013,36(8):1281-1283.
[15]杨勇勋,董小萍,陈胡兰,等.川射干总异黄酮苷元有效部位的制备工艺研究[J].亚太传统医药,2012,8(9):49-52.
[16]陈帅,袁崇均,罗森,等.超高效液相色谱法同时测定川射干中7个异黄酮成分的含量[J].天然产物研究与开发,2018,30(2):257-260,217.
[17]Wu Z,Ren S,Chen T,et al.Separation and purification of six isoflavones from Iris tectorum Maxim by macroporous resin-based column chromatography coupled with preparative high-performance liquid chromatography[J].Sep Sci Technol,2019.DOI:10.1080/01496395.2019.1603239.
[18]秦民坚,徐珞珊,田中俊弘.射干和鸢尾的挥发性成分[J].植物资源与环境学报,1997,6(2):55-56.
[19]Zhang CL,Wang Y,Liu YF,et al.Iridal-type triterpenoids with neuroprotective activities from Iris tectorum[J].J Nat Prod,2014,77(2):411-415.
[20]Zhang CL,Wang Y,Liang D,et al.Cytotoxic iridal-type triterpenoids from Iris tectorum[J].Tetrahedron,2015,71(34):5579-5583.
[21]Zhang CL,Liu YF,Wang Y,et al.Polycycloiridals A-D,Four Iridal-Type Triterpenoids with an α-Terpineol Moiety from Iris tectorum[J].Org Lett,2015,17(22):5686-5689.
[22]Zhang CL,Hao ZY,Liu YF,et al.Polycycloiridals with a Cyclopentane Ring from Iris tectorum[J].J Nat Prod,2016,80(1):156-161.
[23]冯汉林,严启新.射干提取物抗雌激素缺乏大鼠骨质疏松的研究[J].现代药物与临床,2012,27(3):209-213.
[24]吴泽芳,熊朝敏.射干与土射干(鸢尾)抗炎祛痰作用的比较研究[J].中药药理与临床,1985,1(00):169.
[25]刘亚灵,宁楠,李利民,等.咽喉康胶囊的镇痛和止咳作用[J].华西药学杂志,2007,22(6):647-649.
[26]Kim YP,Yamada M,Lim SS,et al.Inhibition by tectorigenin and tectoridin of prostaglandin E2 production and cyclooxygenase-2 induction in rat peritoneal macrophages[J].Biochim Biophys Acta,1999,1438(3):399-407.
[27]Wang A,Wei J,Lu C,et al.Genistein suppresses psoriasis-related inflammation through a STAT3-NF-κB-dependent mechanism in keratinocytes[J].Int Immunopharmacol,2019,69(1):270-278.
[28]Chen Y,Le TH,Du Q,et al.Genistein protects against DSS-induced colitis by inhibiting NLRP3 inflammasome via TGR5-cAMP signaling[J].Int Immunopharmacol,2019,71(4):144-154.
[29]寧楠,刘亚灵,李利民,等.咽喉康胶囊对大鼠的解热作用[J].华西药学杂志,2009,24(6):681-682.
[30]徐学民.鸢尾苷元的结构修饰及其体外抗SARS病毒的活性研究[C].第三届中医药现代化国际科技大会论文集,成都:第三届中医药现代化国际科技大会,2010.
[31]Hoon Jung-Sang,Sil Lee-Yeon,Sanghyun Lee,et al.Anti-angiogenic and anti-tumor activities of isoflavonoids from the rhizomes of Belamcanda chinensis[J].Planta medica,2003,69(7):622-617.
[32]黄文哲,赵小辰,王峥涛,等.异黄酮类化合物抗肿瘤细胞增殖作用[J].现代中药研究与实践,2003,17(1):50-51.
[33]潘静.川射干化学成分及体外抗肿瘤活性的研究[D].武汉:湖北中医学院,2009.
[34]Morrissey C,Bektic J,Spengler B,et al.Phytoestrogens derived from Belamcanda chinensis have an antiproliferative effect on prostate cancer cells in vitro[J].J Urol,2004,172(6):2426-2433.
[35]Thelen P,Scharf JG,Burfeind P,et al.Tectorigenin and other phytochemicals extracted from leopard lily Belamcanda chinensis affect new and established targets for therapies in prostate cancer[J].Carcinogenesis,2005,26(8):1360-1367.
[36]秦民坚,吉文亮,刘峻,等.射干中异黄酮成分清除自由基的作用[J].中草药,2003,34(7):640-641.
[37]韩晓静.川射干异黄酮的相关药效学研究[D].武汉:湖北大学,2006.
[38]于颖.川射干异黄酮类化学成分的神经保护作用[D].泰安:泰山医学院,2013.
[39]Miao ZY,Xia X,Che L,et al.Genistein attenuates brain damage induced by transient cerebral ischemia through up-regulation of Nrf2 expression in ovariectomized rats[J].Neurol Res,2018,40(8):689-695.
[40]Liu EYL,Xu ML,Jin Y,et al.Genistein,a Phytoestrogen in Soybean,Induces the Expression of Acetylcholinesterase via G Protein-Coupled Receptor 30 in PC12 Cells[J].Front Mol Neurosci,2018,11(2):1-11.
[41]Qu J,Gao J,Sun J,et al.Pharmacokinetics of conjugated metabolites in rat plasma after oral administration of tectoridin[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,902(6):61-69.
[42]Zhang W.D.,Qi L.W.,Yang X.L.,et al.Determination of Tectorigenin in Rat Plasma:Application to a Pharmacokinetic Study After Oral Administration of Tectorigenin or Its Prodrug Tectoridin[J].Chromatographia,2008,68(11):1021-1025.
[43]Yang M,Yang X,An J,et al.Comparative pharmacokinetic profiles of tectorigenin in rat plasma by UPLC-MS/MS after oral administration of Iris tectorum Maxim extract and pure tectoridin[J].J Pharm Biomed Anal,2015,114(5):34-41.
[44]袁崇均,陳帅,罗森,等.川射干功效与毒性探讨[J].四川中医,2017,35(12):27-28.
[45]王琼.蜜炙川射干减毒存效的部分实验研究[D].成都:成都中医药大学,2008.
[46]王红星,何永亮,廖世平,等.咽喉康胶囊(内容物)Beagle犬180天长期毒性试验[J].四川生理科学杂志,2001,23(3):137-138.
[47]房莉萍.射干麻黄汤与小青龙汤临床辨治鉴别[J].中医研究,2011,24(5):64-65.
[48]朱璞玉.射干麻黄汤治疗肺系疾病的理论及文献研究[D].广州:暨南大学,2014.
[49]李春燕,徐立然,邱荃,等.经方治疗艾滋病肺部感染[J].中医研究,2017,30(6):55-59.
[50]王永前.鳖甲煎丸易汤在水肿病中的应用[J].中国民间疗法,2019,27(16):82-83.
[51]汪慧兰.恩替卡韦联合鳖甲煎丸治疗乙肝肝硬化失代偿临床疗效[J].临床医药文献(连续型电子期刊),2019,6(38):62.
[52]李庆梅.甘露消毒丹临床应用举隅[J].浙江中西医结合杂志,2018,28(9):790-791.
[53]蔡楚君.甘露消毒丹治疗脾胃湿热型慢性鼻-鼻窦炎随机对照试验[D].乌鲁木齐:新疆医科大学,2019.
[54]赵越娟.甘露消毒丹在眼科运用的探讨[J].中国中医药现代远程教育,2016,14(3):124-126.
[55]袁建.刘应龙应用甘露消毒丹治疗儿科疾病的经验[J].国际中医中药杂志,2016,38(2):174-175.
[56]苗耀东,马运涛,吴深涛.吴深涛教授运用甘露消毒丹验案举隅[J].天津中医药,2019,36(2):159-160.
[57]帅小翠,丁成慧,山珊.我院制剂虎杖解毒颗粒2010-2012应用情况以及前景浅析[J].中国保健营养(中旬刊),2013,23(9):94-94.
[58]黄东萍.小儿哮喘灵颗粒药学部分研究[D].成都:成都中医药大学,2008.
[59]夏瑜.一种可有效治疗鼻炎的丸剂药物及制备方法[P].中国:CN108143855A,2018-06-12.
[60]陈帅,袁崇均,罗森,等.川射干黄酮胶囊的化学成分研究[J].中国医院用药评价与分析,2016,16(4):498-500.
[61]姚勤,余勤,梁茂植,等.泰克吉宁注射液健康人体药动学研究[C].四川省第十四届色谱技术交流会论文集,成都:2008.
[62]袁崇均,王笳,陈帅,等.高效液相色谱法测定川射干鸢尾苷元磺酸钠及其制剂泰克吉宁注射液含量和有关物质[J].天然产物研究与开发,2010,22(1):104-106.
(2020-01-09收稿 责任编辑:王明)

