紫草素减轻低氧-复氧致大鼠心肌细胞系H9c2损伤
刘 明,杨臣礼,孟庆鑫
(甘肃省中医院 心胸外科, 甘肃 兰州 730000)
缺血-再灌注(ischemia-reperfusion,I/R)损伤产生机制复杂[1],氧化应激在其中起主要作用。有报道具有抗氧化作用的药物对预防心肌I/R损伤有良好效果,包括白藜芦醇、茶多酚、人参皂苷、东莨菪碱和超氧化物歧化酶(superoxide dismutase,SOD)/过氧化氢酶(catalase,CAT)等活性氧清除酶、黄嘌呤氧化酶抑制剂和低分子化合物维生素C、E及辅酶Q等[2]。紫草素(shikonin)作为天然萘醌类化合物,其分子式为C16H16O5,是紫草的根部提取物,具有抗氧化、抗菌、抗肿瘤和抗感染等作用[3-4]。紫草素可在体外明显抑制脂质过氧化,显著清除自由基,具有较好的抗氧化作用[5];还可激活核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/红素加氧酶-1(heme oxygenase-1, HO-1)通路提高血管内皮细胞的抗氧化能力,抑制由高糖诱导的血管内皮细胞的氧化应激,降低血管内皮细胞的凋亡[6]。关于紫草素对I/R损伤的心肌细胞的作用的相关研究未见报道。本研究将拟在体外利用H9c2心肌细胞建造低氧-复氧(hypoxia-reoxygenation,H/R)损伤模型,探讨紫草素对H/R损伤心肌细胞氧化应激的影响及其保护机制,为临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞与药物:大鼠心肌细胞系H9c2(中国科学院典型培养物保藏委员会细胞库);紫草素(s7576)(Sigma-Aldrich公司),纯度≥98%(HLPC),用DMSO配制成80 mmol/L的母液备用,用时稀释1 000倍。
1.1.2 材料:H-DMEM培养基(Gibco公司);胎牛血清(fetal bovine serum,FBS)(浙江天杭生物科技股份有限公司);活性氧检测试剂盒、丙二醛(malondialdehyde, MDA)检测试剂盒、RIPA裂解液、HRP标记山羊抗兔二抗和HRP标记山羊抗小鼠二抗(上海碧云天生物技术有限公司);噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]、凋亡检测试剂盒和周期检测试剂盒(北京索莱宝生物科技有限公司);总谷胱甘肽(glutathione,GSH)检测试剂盒(南京建成生物工程研究所);8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHdG)ELISA检测试剂盒(上海酶联生物科技有限公司);Trizol、反转录PCR试剂盒和实时荧光定量PCR试剂盒(TaKaRa公司);兔抗caspase-3单克隆抗体、兔抗cleaved caspase-3多克隆抗体、兔抗Bax单克隆抗体、兔抗Bcl-2单克隆抗体、兔抗Nrf2单克隆抗体、鼠抗Keap1单克隆抗体和DyLight®594标记的荧光二抗(Abcam公司)。
1.2 方法
1.2.1 细胞的分组及处理:参照文献[7]制备模型。对照组细胞培养箱中常规培养;H/R组细胞在37 ℃下通入100% N2(O2<1%),培养8 h后,恢复常规培养24 h;紫草素组细胞分别用0.1、1和10 μmol/L的紫草素(母液溶解在DMSO中,DMSO终浓度为0.5%)预处理24 h,随后进行上述H/R实验;对照组和H/R组均加入终浓度为0.5%的DMSO。
1.2.2 MTT法检测细胞增殖:制备1.5×105个/mL的单细胞悬液,以每孔100 μL种植于96孔板中,待贴壁后,每孔加入终浓度为0.1、1、10、20、40和80 μmol/L的紫草素,对照组加入0.1%的DMSO。分别处理24、48和72 h后,再加入10 μL浓度为5 g/L的MTT,继续培养4 h,弃去培养基,加入150 μL DMSO溶解MTT,于490 nm处在酶标仪上检测A值,并计算各组细胞的增殖率。增殖率(%)=(A实验组/A对照组)×100。
为避免紫草素由于浓度过大或处理时间过长造成对H9c2细胞毒性过高,本研究选取干预时间24 h下的对H9c2细胞增殖抑制率<10%的0.1、1和10 μmol/L 3个浓度进行后续实验。
1.2.3 流式细胞计量术检测细胞凋亡和周期:按照细胞凋亡检测试剂盒和细胞周期检测试剂盒说明书分别检测细胞凋亡和周期。
1.2.4 2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorofluorescin diacetate,DCFH-DA)检测细胞中活性氧水平:在6孔板各组细胞,弃去培养基,加入以无血清培养基稀释的浓度为10 μmol/L的DCFH-DA 1.5 mL,37 ℃孵育细胞20 min,用无血清培养基洗涤3次,荧光显微镜拍照。
1.2.5 Western blot检测细胞中Bax、Bcl-2、Keap1和Nrf2蛋白表达:利用RIPA裂解液提取各组细胞总蛋白,BCA定量后,加入5×上样缓冲液,煮沸5 min,-20 ℃保存。进行SDS-PAGE凝胶电泳。依次经过电泳、转膜、封闭、孵育一抗和二抗、ECL发光液显色、自动曝光仪曝光,对条带进行拍照分析。
1.2.6 硫代巴比妥酸(thiobarbituric acid,TBA)法、ELISA和微量酶标法分别检测细胞中MDA、8-OHdG、GSH含量:在磷酸缓冲盐溶液(phosphate buffer saline,PBS)中研碎细胞,离心取上清液,按照试剂盒说明书分别检测上清液中MDA、8-OHdG和GSH含量,其中TBA法检测MDA、ELISA检测8-OHdG、微量酶标法检测GSH。
1.2.7 qPCR检测细胞中γ-谷氨酰半胱氨酸合成酶(human γ-glutamyl systeine synthetase, γ-GCS)、HO-1和醌氧化还原酶1[NAD(P)H dehydrogenase 1, NQO1]mRNA表达:Trizol法提取总RNA,无RNA酶水溶解后,参照反转录试剂盒说明书合成cDNA,然后按照实时定量PCR试剂盒步骤进行qPCR,物序列信息详见表1,荧光定量反应程序为:预变性:95 ℃ 10 min,1循环数;扩增:95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,40循环数。用2-△△Ct表示基因相对表达量。
1.2.8 免疫荧光检测紫细胞中Nrf2进核:取对数增殖期细胞,在6孔板中以1.5×105个/孔的细胞数目进行细胞爬片,待细胞贴壁后,洗涤固定,0.25% Triton×100进行透膜,山羊血清封闭,4 ℃孵育一抗过夜(1∶200),洗涤,室温孵育二抗2 h(1∶2 000),洗涤,DAPI室温孵育15 min,洗涤,抗荧光淬灭剂封片,拍照分析。

表1 引物序列Table 1 Primer sequence
1.3 统计学分析

2 结果
2.1 紫草素对H9c2细胞增殖的影响
紫草素可呈浓度-时间依赖地抑制H9c2增殖(图1)。

*P<0.05 compared with 0 μmol/L group图1 紫草素对H9c2细胞增殖的影响Fig 1 Effect of shikonin on proliferation of H9c2 cells
2.2 紫草素对H/R损伤的H9c2细胞凋亡周期的影响
与对照组相比,H/R组细胞早晚期凋亡细胞比例显著增加(P<0.05);紫草素干预后,随紫草素浓度的增加,早晚期细胞凋亡比例较H/R组逐渐减少,1和10 μmol/L紫草素组细胞凋亡较H/R组显著减少(P<0.05)(图2)。
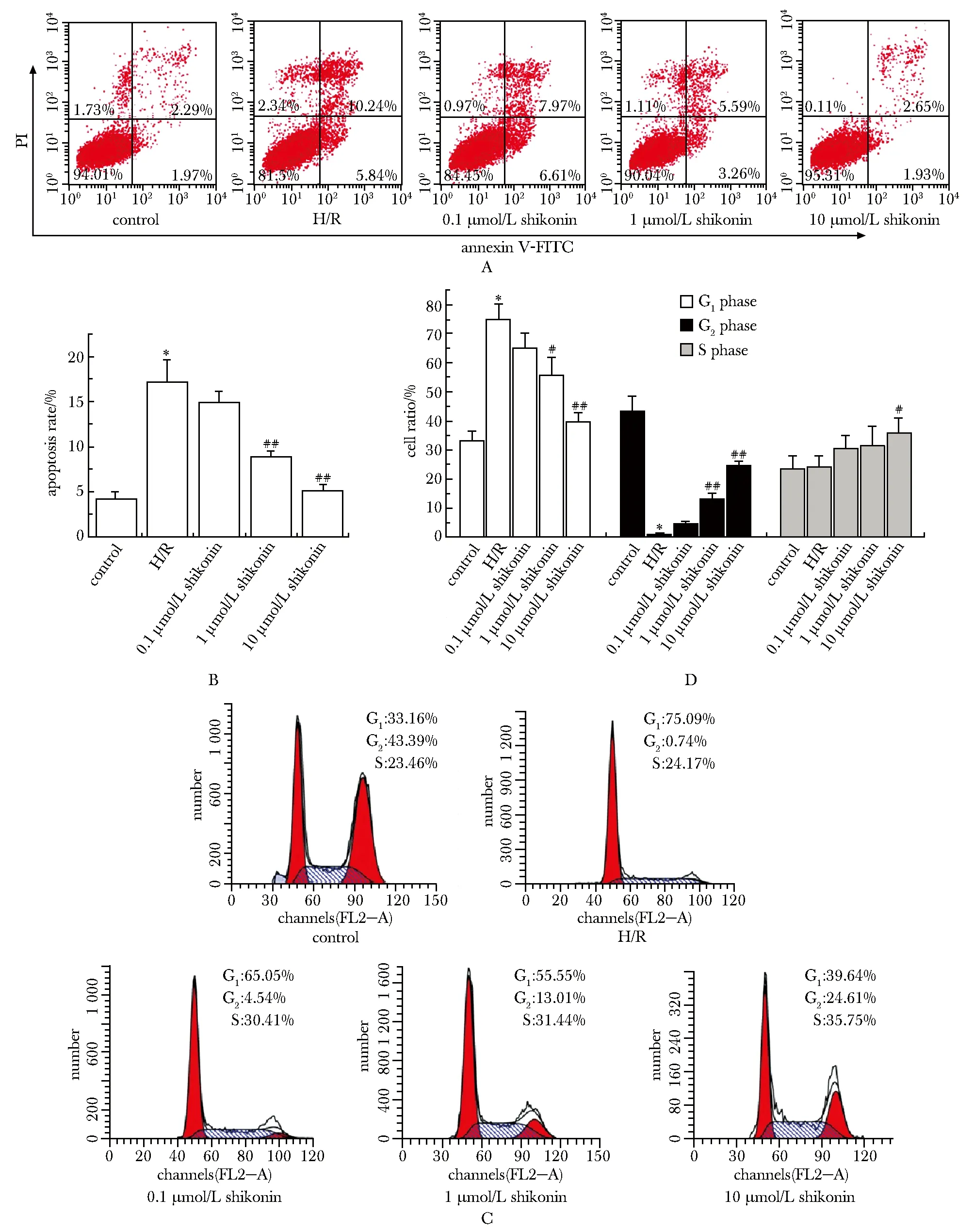
A.flow detection of apoptosis; B.statistics of apoptosis; C.flow detection of cell cycle; D.statistics of cell cycle;*P<0.05 compared with control group; #P<0.05, ##P<0.01 compared with H/R group
与对照组相比,H/R组细胞G1期细胞比例显著增加(P<0.05),G2期细胞比例显著减少(P<0.05),S期细胞比例无显著变化;紫草素干预后随紫草素浓度的增加,G1期细胞比例较H/R组逐渐减少,G2期和S期细胞比例逐渐增多,1和10 μmol/L紫草素组G1期和G2期细胞以及10 μmol/L紫草素组S期细胞的比例变化明显(P<0.05)(图2)。
2.3 紫草素对H/R损伤的H9c2细胞中活性氧水平的影响
对照组细胞荧光较弱,H/R组细胞荧光明显增强;紫草素干预后,细胞中荧光强度呈浓度依赖性逐渐减弱;与对照组相比,H/R组细胞荧光强度显著增强(P<0.05);与H/R细胞相比,1和10 μmol/L紫草素组细胞中荧光强度显著减弱(P<0.05)(图3)。
2.4 紫草素对H/R损伤的H9c2细胞中Bax、Bcl-2、caspase-3和cleaved caspase-3蛋白含量的影响
与正常对照组相比,H/R组细胞Bax和cleaved caspase-3蛋白含量显著增加(P<0.05),Bcl-2蛋白含量显著减少(P<0.05);紫草素干预后,随紫草素浓度的增加,细胞中Bax、cleaved caspase-3蛋白含量较H/R组逐渐减少,Bcl-2蛋白含量逐渐增加,1和10 μmol/L紫草素组细胞中Bcl-2、cleaved caspase-3蛋白含量和10 μmol/L紫草素组细胞中Bax蛋白含量较H/R组变化明显(P<0.05);caspase-3蛋白含量在各组细胞中无显著变化(图4)。
2.5 紫草素对H/R损伤的H9c2细胞中MDA、8-OHdG和GSH含量的影响
与正常组相比,H/R组细胞中MDA和8-OHdG含量明显增加,GSH含量明显减少;随紫草素浓度的增加,细胞中MDA和8-OHdG含量逐渐减少,GSH含量逐渐增加(表2)。
2.6 紫草素对H/R损伤的H9c2细胞中γ-GCS、HO-1和NQO1 mRNA表达影响
与正常组相比,H/R组细胞中γ-GCS、HO-1和NQO1 mRNA表达均显著减少(P<0.05);紫草素干预后,随着紫草素浓度的增加,细胞中γ-GCS、HO-1和NQO1 mRNA表达较H/R组逐渐增加,1和10 μmol/L紫草素组细胞中γ-GCS、HO-1和NQO1 mRNA表达较H/R组变化明显(P<0.05)(图5)。
2.7 紫草素对H/R损伤的H9c2细胞中Keap1和Nrf2蛋白含量的影响
与正常组相比,H/R组细胞中Keap1蛋白含量显著减少(P<0.05),Nrf2蛋白含量显著升高(P<0.05);紫草素干预后,随紫草素浓度的增加,细胞中Keap1蛋白含量较H/R组逐渐减少,Nrf2蛋白含量逐渐升高,1和10 μmol/L紫草素组细胞中Keap1和Nrf2蛋白含量较H/R组变化明显(P<0.05)(图6)。

A.detection of ROS; B.statistics of A value of fluorescence; *P<0.01 compared with control group;#P<0.05, ##P<0.01 compared with H/R group
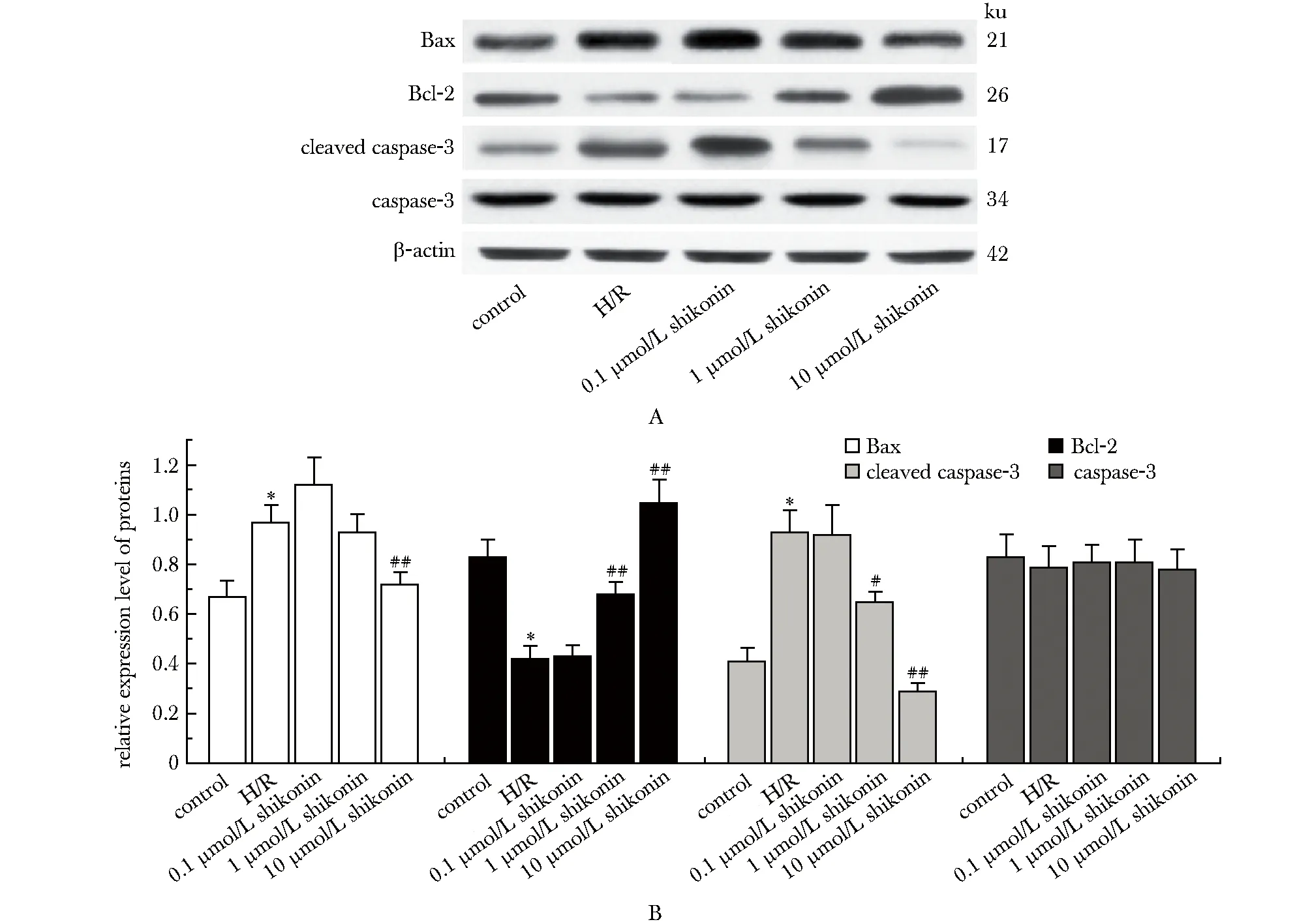
A.protein band; B.semi-quantitative statistics of protein bands; *P<0.01 compared with control group; #P<0.05, ##P<0.01 compared with H/R group
表2 紫草素对H9c2细胞中MDA、8-OHdG、GSH含量的影响Table 2 Effect of shikonin on the contents of MDA, 8-OHdG and GSH in H9c2
*P<0.01 compared with control group;#P<0.05,##P<0.01 compared with H/R group.
2.8 紫草素对H/R损伤的H9c2细胞中Nrf2蛋白进核的影响
与对照组相比,H/R组细胞核中可见有较强的荧光聚集;紫草素干预后,组随紫草素浓度的增加,细胞核中荧光强度较H/R组增强(图7)。
3 讨论
本研究发现紫草素可呈浓度依赖的上调H/R造成的心肌细胞中Bcl-2蛋白表达下降,下调H/R造成的心肌细胞中cleaved caspase-3和Bax蛋白表达上升,进而降低H/R造成的心肌细胞凋亡,这种抑制凋亡的作用在心肌细胞被证实。研究发现缺血的心肌再灌注后启动凋亡程序的原因在于缺血期间细胞内氧自由基的生成增多[8-9]。后者通过攻击细胞膜和DNA引起凋亡。MDA和8-OHdG分别作为脂质和DNA过氧化的标志物,本研究中发现紫草素可降低心肌细胞中因H/R引起的活性氧水平、MDA和8-OHdG浓度的升高,提示紫草素可降低活性氧水平,保护H/R心肌细胞免受过氧化损伤。

*P<0.01 compared with control group; #P<0.05, ##P<0.01 compared with H/R group图5 紫草素对H9c2细胞中γ-GCS、HO-1和NQO1 mRNA表达影响Fig 5 Effect of shikonin on the expression of γ-GCS, HO-1 and NQO1 mRNA in H9c2
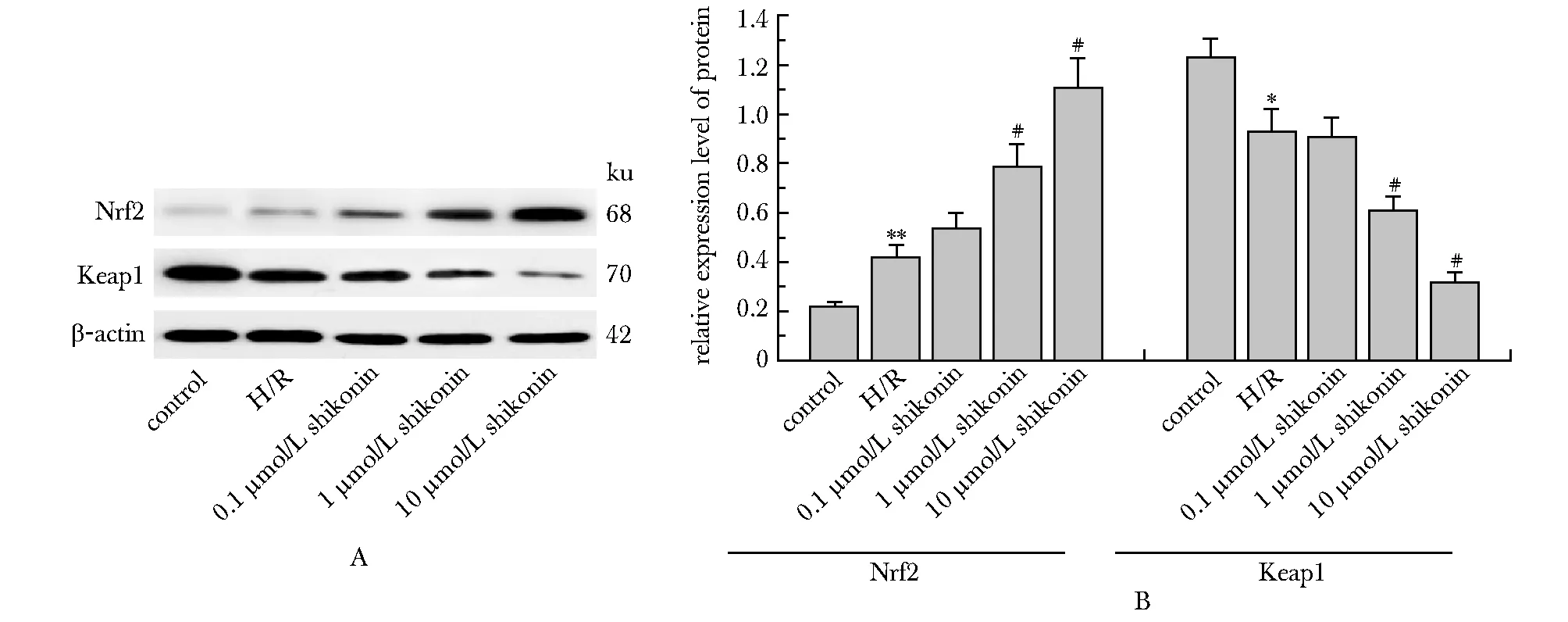
A.protein band; B.semi-quantitative statistics of protein bands; *P<0.05, **P<0.01 compared with control group; #P<0.01 compared with H/R group
在正常心肌细胞内存在抗氧自由基酶系统。抗氧自由基酶包括CAT、γ-GCS、SOD、HO-1及NQO-1等。本研究发现紫草素可提高因H/R损伤导致的心肌细胞中降低的GSH含量以及γ-GCS、HO-1、NQO1 mRNA表达,提示紫草素可通过改善心肌细胞内抗氧化系统保护心肌细胞免受H/R造成的过氧化损伤。
Nrf2-ARE信号通路被激活后可诱导HO-1、γ-GCS和NQO1等大量保护性基因的转录,进而抵抗各种刺激对机体产生的氧化应激损伤[10]。在正常状况下,Keap1与Nrf2相结合,抑制Nrf2进核。在氧化应激状态下Keap1与Nrf2解离,Nrf2激活进入细胞核启动抗氧化基因转录,增强细胞的解毒及抗氧化能力,发挥保护作用[11-12]。
本研究发现H/R可使心肌细胞内Keap1蛋白含量降低,Nrf2蛋白含量升高,而紫草素可进一步使心肌细胞内Keap1蛋白含量降低,Nrf2蛋白含量升高,并促进Nrf2蛋白大量进入细胞核。提示紫草素可通过进一步激活Nrf2-ARE信号通路,促进抗氧化酶的表达,保护心肌细胞免受H/R造成的过氧化损伤。

图7 紫草素对H/R损伤的H9c2细胞中Nrf2蛋白进核的影响Fig 7 Effect of shikonin on Nrf2 protein nucleation in H9c2 cells injured by H/R
综上紫草素可通过激活Nrf2-ARE信号通路保护心肌细胞免受H/R损伤。但是其是否还可通过其他代谢途径保护心肌细胞免受H/R损伤,尚待进一步研究。

