PRRSV/LPS共刺激抑制小鼠雌二醇分泌与苦参碱的改善作用
扆妍妍,裴亚萍,侯雅鑫,曹志刚,孙 娜,李宏全
(山西农业大学动物医学学院,山西 太谷 030801)
感染性疾病常常扰乱雌性动物正常的卵巢周期活动,包括卵泡发育异常和卵巢囊肿,延长发情期和黄体期,造成生殖障碍。猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的母猪繁殖障碍主要表现为妊娠母猪的流产、早产和死胎、弱胎、木乃伊胎等。研究报道,高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV)造成的生殖障碍极大可能是由于破坏生殖激素的平衡引起的[1]。临床生产中,猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)多与其他猪病混合感染,引起或继发一系列更复杂和严重的病理变化[2-3]。其中与猪圆环病毒(Porcine circovirus type 2,PCV2)共感染是导致母猪繁殖失败的一个原因[4]。在大多数哺乳动物生产过程伴随着大量细菌的感染,细菌脂多糖(Lipopolysaccharide,LPS)是革兰阴性菌壁的主要成分。LPS作用于下丘脑或垂体,抑制促性腺激素的释放,或直接影响促卵泡激素受体(Follicle-stimulating hormone receptor,FSHR)和促黄体生成素受体(Luteinizing hormone receptor,LHR)蛋白的表达,从而影响动物生殖功能[5-6]。此外,LPS对卵巢有直接影响,包括卵泡成分,如卵泡膜和颗粒细胞或卵母细胞。研究报道,LPS可以引起雌激素的分泌紊乱[7-11]。本实验室前期研究表明,与单独感染相比,PRRSV 5′UTR RNA与LPS共刺激猪肺泡巨噬细胞可以加重炎症反应[12]。虽然PRRSV不能感染小鼠,但是可以促进小鼠体内PCV2的复制[13]。PRRSV单独作用小鼠,可以引起小鼠脾脏氧化应激,显著增加促炎因子的表达[14]。但PRRSV与LPS共刺激小鼠是否影响雌激素分泌方面的研究目前仍有待进一步研究。
苦参碱(Matrine,MT)是存在于苦参、山豆、苦豆子等植物组织中的一种生物碱。本实验室前期研究表明,苦参碱在体外可抑制PRRSV的复制[15-17],改善PRRSV与PCV2共感染引起的间质性肺炎[13],对LPS诱导的小鼠急性肺损伤具有保护作用[18],并且抑制PRRSV 5′UTR RNA 与LPS共刺激诱导的炎症发生[12],显著改善PRRSV和LPS共刺激诱导的小鼠间质性肺炎(数据未发表)。然而,苦参碱对雌激素的分泌是否有影响依然未知。因此,本试验的目的是观察LPS与PRRSV共刺激对小鼠体内雌二醇E2的影响并探讨苦参碱可能发挥的作用。
1 材料与方法
1.1 实验动物与病毒 雌性昆明小鼠,(20±2) g,SPF级,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。PRRSV(JS-1)由江苏省农业科学院馈赠,病毒TCID50为10-5.86。
1.2 试剂与仪器 主要试剂与药物:苦参碱,购自南京泽朗有限公司,批号:ZL20171212SCZS,含量98.0%;LPS,购自北京索莱宝科技有限公司,批号:810P031;2×SYBR Green Low ROX qPCR Master Mix,购自上海Selleck-Bimake公司;TRIzol和PrimerScriptTMRT reagent Kit with gDNA Eraser,均购自大连TaKaRa公司;Mouse Estradiol(E2)Elisa Kit,购自上海Blue Gene,批号:20180706。主要仪器:离心机(Sigma,德国);7500定量PCR仪(Applied Biosystems,美国);酶标仪(MD,美国);ND-1000核酸蛋白浓度测定仪(NanoDrop,美国)。
1.3 试验设计 将小鼠适应性饲养1周后,随机分为3组,每组8只。空白对照组(Control):腹腔注射等剂量生理盐水;PRRSV/LPS共刺激组(PRRSV/LPS):单次腹腔注射20 mg/(kg·bw) LPS和0.5 mL/只PRRSV(10倍稀释);苦参碱组(MT):同PRRSV/LPS共刺激组,共刺激30 min后,腹腔注射40 mg/(kg·bw)苦参碱,连续注射3 次,每次间隔24 h,其他组注射等剂量生理盐水。给药7 d后收集血液,测定血清E2含量。冻存卵巢组织,保存于-80 ℃备用。
1.4 血清中E2的测定 小鼠眼眶采血,置于4 ℃至血清析出,3 000 r/min离心5 min,收集分装血清,-80 ℃保存备用。使用ELISA法测定血清中E2含量。主要步骤为:取出酶标板,按照标准品顺序依次加入空白微孔中;依次加入100 μL样品,每个样品重复3次,PBS为空白对照孔;各孔加入50 μL 酶标记液(不含空白对照孔),37 ℃孵育1 h;洗涤液充分洗板5次,最后一次拍干残留液体;各孔分别依次加入50 μL A液与50 μL B液,37 ℃避光反应15 min;加入50 μL终止液终止反应;使用酶标仪在450 nm处测定OD值。
1.5 实时荧光定量PCR 使用TRIzol法提取卵巢组织RNA,参照PrimerScriptTMRT reagent Kit with gDNA Eraser两步法反转录为cDNA。以cDNA为模板,qPCR检测Star、3β-HSD、17β-HSD、CYP11a1、CYP19a1、Caspase-3、Bax、Bcl-2 mRNA相对表达量。根据NCBI上GenBank中公布的基因序列,利用Primer 5.0软件设计用于实时荧光定量PCR的特异性引物,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.6 数据分析 试验数据均使用GraphPad Prism 5软件进行单因素方差分析(One-way ANOVA)分析,数据均采用平均数±标准误表示,P<0.05表示差异显著。
2 结果
2.1 苦参碱对PRRSV/LPS引起的小鼠E2变化的影响 给药7 d后采集血液,ELISA法检测血清中E2含量的变化。如图1所示,与空白对照组相比,PRRSV/LPS共刺激组E2含量显著降低(P<0.05),苦参碱作用后,E2含量显著升高,恢复到正常水平(P<0.05)。此结果表明,PRRSV/LPS共刺激小鼠后可以引起小鼠血清中E2含量的降低,而苦参碱对PRRSV/LPS诱导的E2降低具有保护作用。

图1 苦参碱对小鼠血清中E2的影响Fig.1 Effect of matrine on serum E2 in mice注:不同字母表示差异显著,P<0.05,相同字母表示差异不显著,P>0.05;下图同Note:The difference letters indicate significant differences,P<0.05,the same letters mean not significant difference,P>0.05.The same as below
2.2 苦参碱对PRRSV/LPS诱导的小鼠E2合成相关基因变化的影响 qRT-PCR检测小鼠E2合成过程中相关基因的表达。由图2可知,与空白对照组相比,PRRSV/LPS共刺激组显著降低StaR、CYP11a1、CYP19a1 mRNA的表达(P<0.05),苦参碱处理组显著升高CYP11a1 mRNA的表达(P<0.05),对PRRSV/LPS共刺激造成的StaR、CYP19a1表达降低没有改善作用,3β-HSD和17β-HSDmRNA在各处理组间差异不显著(P>0.05)。表明PRRSV/LPS可能是通过改变E2合成过程中相关酶影响E2的分泌,苦参碱发挥保护作用也是因为对相关酶产生影响引起的。
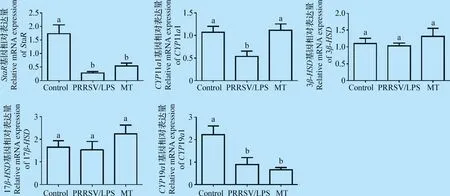
图2 苦参碱对小鼠E2合成相关基因变化的影响Fig.2 Effect of matrine on the changes of E2 synthesis related genes in mice
2.3 苦参碱对小鼠卵巢凋亡相关基因的影响 qRT-PCR检测给药7 d后卵巢凋亡相关基因的表达,结果如图3所示,各组之间Caspase-3、Bcl-2/BaxmRNA表达均无显著差异(P>0.05)。提示PRRSV/LPS共刺激引起的E2变化不是通过细胞凋亡引起的,苦参碱不通过此途径发挥保护作用。

图3 苦参碱对小鼠卵巢凋亡相关基因变化的影响Fig.3 Effect of matrine on the changes of ovarian apoptosis related genes in mice
3 讨论
PRRSV可以引起妊娠母猪的流产、死胎、木乃伊胎等,同时可能继发细菌感染。PRRSV单独作用小鼠时,能引起氧化应激与炎症反应[14]。PRRSV与PCV2共同作用小鼠时,促进PCV2的复制,并诱发更为严重的肺脏病变[13]。PRRSV 5′UTR RNA与LPS共刺激猪肺泡巨噬细胞,促进炎症因子的表达[12]。同时大量研究报道,LPS对雌性类固醇激素分泌有重要影响,进而影响生殖功能。但PRRSV与LPS共刺激对小鼠E2分泌的影响尚不清楚。因此本试验通过使用PRRSV/LPS共同刺激小鼠,ELISA法检测小鼠血清中E2含量。结果发现,PRRSV/LPS共刺激后显著抑制了小鼠E2的分泌。大量研究表明,苦参碱具有抗炎、抗病毒作用[12-13,16-18],但是对雌激素分泌的影响尚不清楚。因此本试验探究了苦参碱对PRRSV/LPS共刺激诱导的血清E2分泌降低是否有保护作用,结果显示,给药7 d后苦参碱显著抑制PRRSV/LPS诱导的E2降低,表明苦参碱对于PRRSV/LPS引起的E2降低具有改善作用。
卵巢类固醇激素主要由卵泡膜细胞和颗粒细胞合成,包括孕激素、雄激素和雌激素,在卵泡发育和排卵过程中起关键作用。类固醇激素生成酶和卵泡膜细胞、颗粒细胞对E2合成至关重要。胆固醇首先被类固醇生成急性调节蛋白(Steroidogenic acute regulatory protein,StaR)从线粒体外膜转运至内膜,在CYP11a1基因编码的细胞色素P450胆固醇侧链裂解酶(Lesterol side-chaincleavage cvtochrome P450,P450 scc)催化下合成孕烯醇酮,随后被3β-羟类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)代谢为孕酮。孕酮在细胞色素P450 17a-羟化酶(17a-hydroxylage cytochrome P450,P450c17)的催化下转化成雄激素。CYP19a1基因编码的细胞色素P450芳香化酶(P450arom)和17β-羟类固醇脱氢酶(17β-hydroxysteroid dehydrogenase,17β-HSD)催化雄烯二酮或睾酮合成雌二醇。在此过程中,StaR被认为类固醇激素合成过程中的第1个限速酶。P450arom是雌激素生成的限速酶,P450arom的激活是通过促卵泡激素(Follicle-stimulating hormone,FSH)与颗粒细胞上FSH受体结合引起的。此外,雌激素与其合成相关酶、其他激素之间存在负反馈调节。在本试验中PRRSV/LPS共刺激降低E2的分泌,但对于其作用机制并不清楚。因此通过检测类固醇合成相关基因探究其可能的机制,结果发现PRRSV/LPS显著降低StaR、CYP11a1、CYP19a1 mRNA 的表达。表明PRRSV/LPS可能是通过影响其合成过程关键酶的基因表达来降低E2的分泌。小鼠腹腔注射苦参碱后卵巢组织CYP11a1 mRNA的表达量显著升高,StaR、3β-HSD、17β-HSDmRNA有升高的趋势,但是差异不显著。因此,本试验结果证明苦参碱可以通过调节雌激素合成过程中相关酶发挥改善作用。苦参碱可能是直接影响酶的合成发挥作用,也可能是影响类固醇激素合成的上游信号通路如cAMP/PKA发挥作用,其具体机制仍有待进一步研究。此外,我们探究了PRRSV/LPS诱导的E2分泌降低是否与卵泡细胞凋亡有关,通过检测凋亡相关基因(Caspase-3、Bcl-2、Bax)的mRNA表达发现,PRRSV/LPS诱导E2的分泌降低以及苦参碱的改善作用并不通过细胞凋亡发挥作用。
综上所述,PRRSV/LPS共刺激可以降低小鼠血清中E2的分泌,主要是通过影响雌激素合成过程中编码StaR、P450 scc和P450arom的基因表达来发挥作用。而苦参碱可以通过影响编码P450 scc的基因发挥改善作用。

