青岛地区犬流感的流行病学调查及H3N2亚型流感病毒的分离鉴定
刘佳卉,马清霞,杨海燕,李军伟,单 虎,张传美
(青岛农业大学动物医学院,山东 青岛 266109)
犬流感病毒(Canine influenza virus,CIV)属于正黏病毒科流感病毒属A型流感病毒,主要引起犬的呼吸系统疾病,表现为发烧、流鼻液、食欲不振、精神沉郁等。近年来发生了多种亚型的流感病毒感染犬的事件:2004年,美国首次发生H3N8马流感病毒跨种族传播感染赛犬,表现出明显的临床症状并导致赛犬死亡[1];2007年,韩国首次发现犬感染禽源H3N2流感病毒[2];我国于2006—2010年分离了多株H3N2亚型犬流感[3-4];2009年,我国发现犬感染H1N1亚型流感病毒,与当时流行的人甲型H1N1流感病毒高度同源[5];2015年,H3N2亚型犬流感病毒从亚洲传播到了美国[6],随后在多个地区均出现报道;我国自2016年以来H3N2亚型犬流感流行毒株的抗原性发生了很大变化,取代了之前的流行毒株[7];2017—2018年,在加拿大发生多起H3N2亚型犬流感疫情,出现104例确诊病例,作者认为从亚洲进口的犬只是感染源[8]。
犬作为重要的伴侣动物,与人类接触密切,并且可以感染多种流感病毒[9],其在流感病毒跨物种传播过程中有重要的公共卫生学意义。为了解当前青岛地区CIV的流行情况,本研究对青岛及周边地区犬进行血清学调查,分离得到1株H3N2亚型流感病毒,对其遗传进化特性进行了分析,为青岛地区犬流感的疫情监控和病毒进化情况提供了参考依据。
1 材料与方法
1.1 样品和SPF鸡胚、小鼠 2017年11月—2018年4月采集了青岛地区犬只繁育场、流浪犬基地以及动物医院的134份犬血清、120份犬的鼻咽拭子样品。9日龄SPF鸡胚,购自济南斯派福瑞禽业科技有限公司;8周龄雌性BALB/c小鼠,购自济南朋悦实验动物繁育有限公司。
1.2 主要试剂 受体破坏酶(RDE),购自日本Denka Seiken公司;H5、H7、H9亚型血凝抑制抗原与阳性血清,均购自哈尔滨维科生物技术开发公司;H1、H3亚型血凝抑制抗原与阳性血清为本实验室保存。AIV荧光RT-PCR检测试剂盒,购自QIAGEN公司;高保真酶、T载体试剂盒,均购自北京擎科新业生物技术有限公司;核酸提取试剂盒、反转录酶、胶回收试剂盒和E.coliDH5α,均购自TaKaRa公司。
1.3 血清抗体的检测 为调查青岛地区犬只中各种亚型流感病毒的感染情况,参照国标方法(GB/T 18936-2003)进行血凝抑制(HI)试验,检测采集血清中H1、H3、H5、H7和H9亚型流感病毒的抗体。按照说明书操作处理血清:将1体积犬血清加3体积受体破坏酶(RDE)37 ℃处理过夜(18~20 h)后,56 ℃水浴灭活1 h,加6体积生理盐水,即为10%待测血清样品。HI滴度大于20即为抗体阳性。
1.4 引物合成 比较GenBank中多个H3N2亚型CIV基因序列,由青岛擎科梓熙生物技术有限公司合成8对基因片段的引物(如表1)。

表1 试验所用引物Table 1 Primers used in this study
1.5 病毒的分离鉴定 采集犬鼻咽拭子,接种于9日龄SPF鸡胚,收取接种鸡胚的尿囊液进行血凝试验(HA)测其血凝价,HA阳性的尿囊液提取核酸,参照试剂盒说明书进行荧光RT-PCR检测AIV病毒。
1.6 全基因组序列测定及分析 病毒尿囊液提取核酸经反转录制备cDNA,采用流感病毒各片段特异性引物分别扩增8个片段,PCR扩增产物经琼脂糖凝胶电泳检测,回收目的片段产物,克隆于T载体,由青岛擎科梓熙生物技术有限公司进行序列测定。分别将测序结果导入NCBI网站,在线BLAST比对各基因片段的同源序列。从GenBank中下载犬H3N2流感病毒参考序列,应用 MEGA7软件进行遗传进化分析,使用Neighbor-Joining方法基于遗传距离构建系统发育进化树,Bootstrap值为1 000。
1.7 鸡胚半数感染量(EID50)测定 将病毒尿囊液用进行10倍系列稀释,每个稀释度接种5枚9~10日龄的SPF鸡胚,0.2 mL/胚,37 ℃孵化,每12 h观察鸡胚的死亡情况,记录鸡胚的死亡时间。连续观察至120 h,将存活的鸡胚在4 ℃冷冻致死后,收集所有鸡胚的尿囊液,用血凝试验测定鸡胚的感染情况,参照 Reed and Muench的方法[10]计算病毒的EID50。
1.8 小鼠致病性试验 将24只6周龄雌性BALB/c小鼠随机分为试验组和对照组,其中试验组18只,对照组为6只,隔离饲养。将小鼠用乙醚轻微麻醉,试验组小鼠经鼻腔途径接种病毒的鸡胚尿囊液50 μL,对照组按相同方法和剂量接种无毒SPF鸡胚尿囊液作对照。攻毒后每日观察小鼠的临床表现,固定时间测量体温与体重,记录其采食量与饮水量。持续观察14 d。第3、5、7、9、11天和第14 天分别剖杀3只小鼠,观察各组织病理变化;无菌采集肺组织,用于病毒的荧光定量PCR测定。
2 结果
2.1 血清流行病学调查 HI试验结果显示,所有被检血清样品中8.2%(11/134) 对H1亚型流感抗原呈阳性反应,7.5%(10/134)对H3亚型流感抗原呈阳性反应,0.7%(1/134)对H5亚型流感抗原呈阳性反应,没有样品对H7亚型流感抗原呈阳性反应,4.7%(6/134)对H9亚型流感抗原呈阳性反应。如表2。
表2 犬血清中抗体检出情况Table 2 Detection of antibodies in canine serum
2.2 病毒的分离鉴定 从1例有呼吸道症状的患犬鼻咽拭子中分离得到1株流感病毒,命名为A/Canine/Qingdao/0309/2018/H3N2。荧光定量RT-PCR结果显示,有特异性扩增曲线,Ct值为21.668。测得该病毒的鸡胚半数感染量(EID50)为10-4.75/0.2 mL。
2.3 全基因序列分析 对病毒的8个基因片段分别扩增,电泳检测可见扩增得到了与预期大小相符的目的条带,如图1。BLAST及遗传进化分析结果显示,该毒株并未发生重组,8个片段的核苷酸序列均与2017年国外流行毒株的同源性较高,比对同源性最高的序列均为A/Canine/Georgia/89750.1/2017(H3N2)。
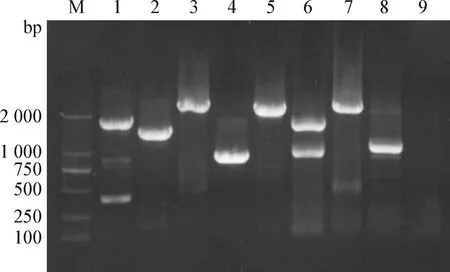
图1 病毒8个基因片段的RT-PCR扩增产物Fig.1 RT-PCR amplification products of 8 gene fragments of virusM:DL-2 000 DNA marker;1:HA基因;2:NA基因;3:PB2基因;4:NS基因;5:PA基因;6:NP基因;7:PB1基因;8:M基因;9:阴性对照M:DL-2 000 DNA marker;1:HA gene;2:NA gene;3:PB2 gene;4:NS gene;5:PA gene;6:NP gene;7:PB1 gene;8:M gene;9:Negative control
2.3.1HA基因序列分析 该株病毒HA基因由1 701个 核苷酸组成,编码566个氨基酸。HA基因裂解位点(340~348)氨基酸序列为PERQTRGLF,仅含有2个碱性氨基酸,符合低致病性禽流感的特征。共有6个潜在糖基化位点,分别为38 NGT、54 NAT、61 NSS、97 NET、181 NVT、499 NGT。该分离株受体结合位点226位氨基酸是Q,具有与α,2-3和α,2-6唾液酸受体结合的特性。由绘制的系统进化树(如图2)可以看出,该毒株与近年在美国等地流行的H3N2亚型CIV的亲缘关系较近,而与中国、韩国等地的流行毒株相对较远,这表明近几年在中国H3N2亚型CIV在流行过程中HA基因发生了很大的变异。
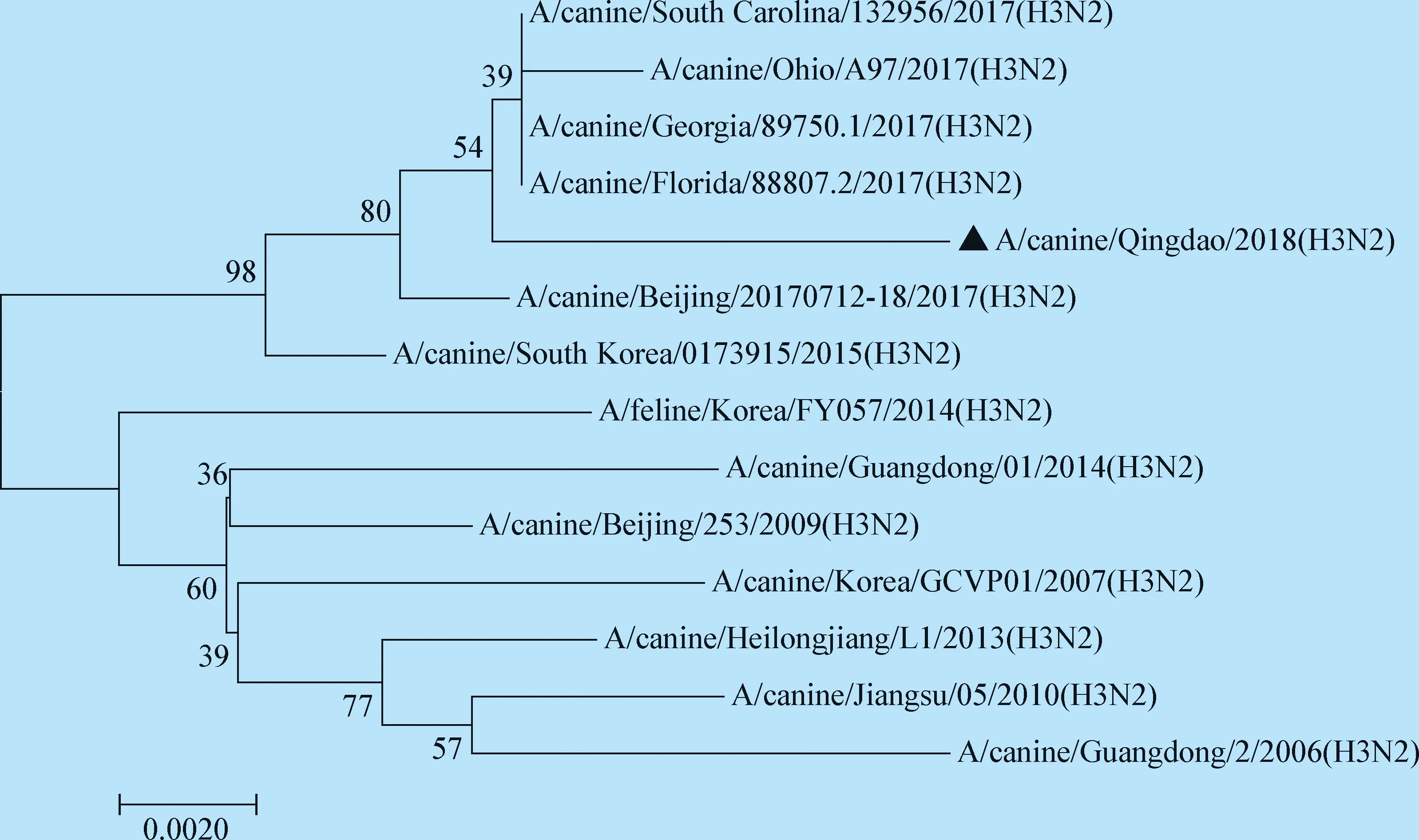
图2 HA基因的遗传进化树Fig.2 Phylogenetic analysis of the HA gene▲:本分离株▲:The isolated strain
2.3.2NA基因序列分析 该株病毒的NA基因有7个潜在的糖基化位点:61 NIT、70 NTT、86 NWS、146 NST、200 NAT、234 NGT、402 NWS,NA基因上与神经氨酸酶抑制剂耐药性相关的位点均没有发生突变,因此推测这株病毒对神经氨酸酶抑制剂敏感。遗传进化分析结果表明,该毒株与2016—2017年美国各州分离株的同源关系较近(见图3)。

图3 NA基因的遗传进化树Fig.3 Phylogenetic analysis of the NA gene▲:本分离株▲:The isolated strain
2.4 小鼠致病性试验 攻毒小鼠第2天即开始出现采食量下降,体温降低,精神沉郁,聚堆现象,体重下降明显。持续到第5天体温、体重开始回升,至第10天基本恢复正常。攻毒期间发病小鼠未出现死亡,对照组小鼠未出现任何临床症状,体重与体温均正常。攻毒组与对照组体温与体重的变化情况见图4。
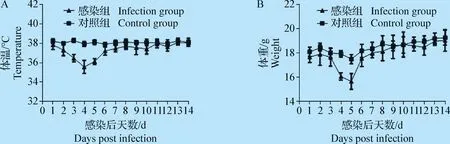
图4 感染后小鼠体温、体重变化Fig.4 The changes of body temperature and body weight of infected miceA:小鼠体温变化;B:小鼠体重变化A:Changes of body temperature in mice;B:Changes of body weight in mice
剖检攻毒小鼠见肺部水肿、淤血和出血,体积增大;支气管内有血色泡沫状液体。心、肝、脾、脑和肾脏未见明显的眼观变化。对照组小鼠各脏器未见明显异常。
肺组织中病毒含量的荧光定量RT-PCR检测结果显示,攻毒后第3天小鼠肺脏可以检测到病毒,持续到第7天,第9天未检测到病毒。
3 讨论
目前已有报道犬感染H1N1[5]、H3N8[1]、H3N2[2-4,6-8]、H5N2[11]、H9N2[12]等多种亚型流感病毒[9,13]。研究发现[14-15],禽型和人型流感病毒受体Sia α2-3Gal和Sia α2-6Gal广泛分布于犬的各个组织器官,犬具备同时感染禽型和人型流感病毒的分子基础,这提示我们犬可能成为不同流感病毒的潜在靶细胞,使得流感病毒在其体内重组从而产生新的病毒。通过对青岛地区犬流感的流行病学调查发现,青岛地区部分犬只的血清中含有H1、H3、H5、H9亚型流感病毒抗体,说明有上述病毒的暴露风险。H1和H3亚型流感病毒在犬中的感染和传播情况已有大量报道[4-8,16-17],但H5和H9亚型的报道相对较少。在134份犬血清中仅检测到1份H5阳性和6份H9阳性的血清,回顾发现这些血清检测阳性的犬均采集自青岛市的宠物市场。在调查过程中发现,宠物市场的犬只来源于不同的犬舍,市场上还有各种鸟兽被饲养在一起待售,这些犬只可能在犬舍中感染,也可能在市场上与其他鸟兽混养导致感染流感病毒,有待于进一步调查。不同亚型的流感病毒在犬只之间流行,增加了流感病毒发生重组的风险,因此进一步加强犬流感病毒的监测对犬类健康和人类公共卫生具有重要意义。
H3N2亚型犬流感最初源自水禽中的禽流感病毒,近年来,H3N2亚型犬流感病毒在中国、韩国、加拿大和美国等地犬群中广泛流行,且不断发生变异[4,6-8]。吕艳丽等研究发现,自2016年以来,具有新型遗传进化和抗原性的H3N2亚型犬流感病毒已在中国某些地区的犬中流行,已经取代了之前的流行毒株[7]。遗传进化分析发现,本研究中分离得到的这株H3N2亚型流感病毒与2017年北京和美国分离株的亲缘关系较近,这与之前的研究一致,而与2015年以前我国和韩国的分离株的亲缘关系则较远,属于2016年以后国内流行的H3N2的新型毒株。
小鼠致病性试验表明,该分离株可以感染BALB/c小鼠,体温、体重均下降,但不致死,属低致病力的毒株。流感病毒感染小鼠后会导致小鼠体温下降,引起肺炎的症状。该分离株的8个基因片段目前均未出现重组,但仍需警惕该病毒长期在犬群流行的过程中可能与人类季节性流感病毒发生重组,从而获得感染人的能力,可能会对人类健康产生较大的潜在威胁,应当引起人们的广泛关注。

