基于碳量子点荧光恢复检测牛奶中多巴胺残留
王腾飞,朱嘉薇,霍梅俊,唐佳琪,武文英
(1.山西农业大学 食品科学与工程学院,山西 太谷 030801;2.山西农业大学 外事处,山西 太谷 030801;3.山西农业大学 资源环境学院,山西 太谷 030801)
我国是一个食品生产和消费大国,食品安全问题不容忽视。兽药残留是全球最受关注的食品安全问题之一,兽药残留对人体、环境都有很大危害,导致人体中毒事件比比皆是,牛奶作为每个家庭必不可少的食品,需求量也越来越大,然而目前乳制品的安全问题并不乐观[1,2]。
盐酸克伦特罗(俗称“瘦肉精”)作为一种饲料添加剂,可以促进蛋白质的合成,进而提高动物饲料利用率,但其在动物性食品中的残留给人体健康带来威胁[3]。欧盟和美国先后在1988年、1991年禁止将克伦特罗作为兽药饲料添加剂, 中国在1997年明确禁止将该类药物添加在饲料中添加。中国农业部第235号公告《动物性食品中兽药最高残留限量》中规定, 克伦特罗在所有动物性食品中不得检出[4]。盐酸多巴胺又称多巴胺盐酸盐,是“瘦肉精”的一种。目前较为常用的检测方法有高效液相色谱紫外检测法、高效液相色谱-质谱联用法、气相色谱检测法、电化学分析、化学分析法、分光光度法等,而以上检测方法都存在仪器昂贵、检测范围受限制、不够灵敏快速、前处理复杂、成本高等缺点[5~7]。荧光碳量子点检测不仅快速、成本低,还具有高效准确、灵敏度高等突出优点,在检测领域应用也越来越广泛[8~10]。本文旨在从原料上对碳量子点合成进行创新,用绿色环保、价格低廉的生物材料作为碳源合成量子点[11]。
本文利用小麦、大米、玉米作为3种碳源,通过水热法一步合成3种碳量子点,根据碳量子点的发光特性,与不同浓度铁离子结合后碳量子点的荧光强度降低,再利用盐酸多巴胺与铁离子络合作用,将铁离子剥离下来释放量子点,同时碳量子点荧光恢复的原理来实现检测牛奶中的兽药盐酸多巴胺残留[9,12,13],尽可能的防止人类食用有盐酸多巴胺残留的动物性食品而引起的中毒,保障人的食品安全。
1 材料与方法
1.1 材料与试剂
小麦、大米、玉米和牛奶(市售),FeCl3、FeCl2、KCl、NaCl、MgCl2、CuCl2(分析纯,天津市凯通化学试剂有限公司),盐酸多巴胺标准品(98%)、50%三氯乙酸(阿拉丁试剂(上海)有限公司)。
1.2 试验仪器与设备
AR224CN型电子天平:奥豪斯仪器(常州)有限公司;LK100型粉碎机:武汉理科光电技术有限公司;WF型聚四氟乙烯水热反应釜:威海自控反应釜有限公司;YHG-400-BS-Ⅱ型电热鼓风干燥箱:上海跃进医疗器械有限公司;F96S型荧光分光光度计:上海棱光技术有限公司;Cary60型紫外分光光度计:安捷伦科技(中国)有限公司;SC-3610型低速离心机:安徽中科中佳科学仪器有限公司。
1.3 试验方法
1.3.1 量子点的合成
本试验运用水热法制取碳量子点。称取4 g小麦加入40 mL水,放入粉碎机中粉碎3 min,将粉碎好的溶液倒入50 mL聚四氟乙烯水热反应釜中,旋紧盖子后置于电热鼓风干燥箱,180 ℃下加热5 h。将制取的量子点溶液冷却至室温,用5 mL的一次性注射器吸取量子点溶液,通过滤膜过滤到用铝箔包裹好的离心管中,4 ℃避光条件下保存备用。
取2 mL稀释1 000倍的量子点溶液于比色皿,扫描其紫外吸收光谱图和在λex=365 nm、λem=440 nm处的荧光光谱图。
1.3.2 铁离子与量子点的结合
配置浓度范围为1 000~20 000 μmol·L-1的FeCl3溶液。取100 μL稀释100倍的碳量子点溶液和100 μL FeCl3溶液于具塞比色管中,在室温下混合并定容至10 mL,静置30 min。取2 mL混合液于比色皿中检测其在λex=365 nm、λem=440 nm处的荧光强度,确定使碳量子点荧光强度猝灭的铁离子线性浓度范围。
1.3.3 盐酸多巴胺的检测
用盐酸多巴胺标品配置不同浓度的盐酸多巴胺溶液(浓度分别为1、10、50、100和110 μmol·L-1),取100 μL稀释100倍的碳量子点、100 μL一定浓度的FeCl3溶液、100 μL的盐酸多巴胺溶液于具塞比色管中,在室温下混合并定容至10 mL,静置30 min。取2 mL上述混合液于比色皿,检测混合液在λex=365 nm、λem=440 nm处的荧光强度找到使碳量子点荧光强度恢复的盐酸多巴胺线性浓度范围及检出限。
1.3.4 实际样品的应用
取8 mL牛奶于15 mL离心管中,加入3 mL三氯乙酸(50%)进行去蛋白,放入低速离心机离心5 min,取上层清液备用。取100 μL稀释100倍的碳量子点、100 μL一定浓度的FeCl3和100 μL上述离心上清液于具塞比色管中,室温下混匀并定容至10 mL,静置30 min。将2 mL上述混合液于比色皿中,检测其在λex=365 nm、λem=440 nm处的碳量子点荧光强度。
2 结果与分析
2.1 碳量子点的选择
碳量子点合成原料不同,合成的碳量子粒径和发光特性也有可能不同,本试验分别用小麦、大米、玉米作为3种生物碳源,按照相同的合成方式制取3种碳量子点,分别比较它们的紫外吸收光强度和荧光强度(图1~图3)。试验发现3种碳量子点在435~445 nm处荧光强度有一个特征峰。比较3种碳量子点荧光强度,结果显示小麦量子点的荧光强度远高于其他两种碳量子点。并且以上3种量子点荧光强度在15 d内都趋于稳定,光稳定性好。

图1 稀释1 000倍小麦碳量子点的紫外吸收光谱图(A)和荧光光谱图(B)Fig.1 Ultraviolet absorption spectra (A) and fluorescence spectra (B) of wheat carbon quantum dots diluted 1 000 times

图2 稀释1 000倍大米碳量子点的紫外吸收光谱图(A)与荧光光谱图(B)Fig.2 Ultraviolet absorption spectra (A) and fluorescence spectra (B) of rice carbon quantum dots diluted 1 000 times in rice
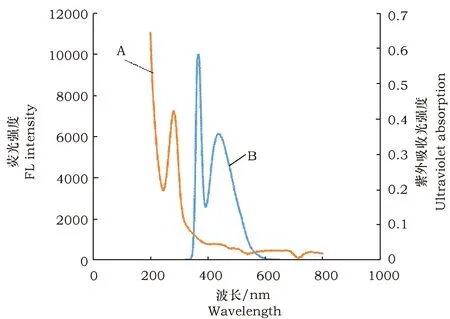
图3 稀释1 000倍玉米碳量子点紫外吸收光谱图(A)和荧光光谱图(B)Fig.3 Ultraviolet absorption spectra (A) and fluorescence spectra (B) of rice carbon quantum dots diluted 1 000 times in corn
2.2 铁离子及其浓度的确定
试验发现铁离子的浓度对碳量子点的荧光强度影响较大,并选择牛奶中可能存在的其它金属离子:Na+、Mg2+、Fe2+和Cu2+进行干扰测试。取2 mL铁离子(130 μmol·L-1)与稀释1 000倍碳量子点的混合液检测其荧光强度,再按相同方法检测同浓度的其它离子与碳量子点混合溶液的荧光强度。试验结果表明,有上述离子存在时对碳量子点的荧光强度影响微乎其微。
本试验用小麦碳量子点分别与不同浓度FeCl3结合,检测小麦量子点的荧光强度变化。试验结果表明,碳量子点的荧光强度随铁离子浓度增大而降低(图4),铁离子浓度线性范围为10~150 μmol·L-1(图5)。本试验选择铁离子的浓度为130 μmol·L-1。(注:F0为CQDs荧光强度、F为CQDs-Fe3+荧光强度)
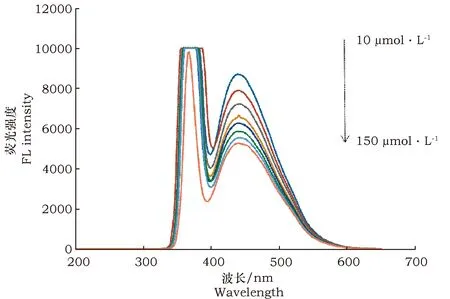
图4 不同浓度铁离子对碳量子点的荧光猝灭情况Fig.4 Fluorescence quenching of carbon quantum dots by iron ions at different concentrations

图5 铁离子浓度与碳量子点荧光强度线性关系Fig.5 Linear relationship between iron ion concentration and fluorescence intensity of carbon quantum dots
2.3 盐酸多巴胺的检出限和线性范围
盐酸多巴胺表面含有丰富的羟基、氨基,向猝灭后的小麦碳量子点溶液中加入不同浓度盐酸多巴胺,碳量子点荧光强度会有所恢复,推测是盐酸多巴胺与铁发生离子络合,产生比静电作用力更强的作用力,将碳量子点释放出来,荧光信号被恢复,碳量子点荧光信号“打开”。
为了提高检测结果的准确性,本试验进行了反应时间的优化,待测物质定容到具塞比色皿中,室温下混合均匀,分别检测其静置0、10、30、40、60 min后的荧光强度,试验结果显示,混合均匀后,静置30 min后溶液荧光强度趋于稳定,推测30 min后盐酸多巴胺与铁离子反应完全,碳量子点荧光恢复完成,因此本试验选择静置30 min后进行检测。结果表明随盐酸多巴胺浓度增大,碳量子点荧光强度恢复的越高(图6),在1~110 μmol·L-1范围内呈很好的线性,检出限为0.3 μmol·L-1(图7)。(注:F为CQDs-Fe3+荧光强度、F1为CQDs-Fe3+加入盐酸多巴胺的荧光强度)

图6 加入不同浓度盐酸多巴胺后碳量子点的荧光恢复情况Fig.6 Fluorescence recovery of carbon quantum dots after adding different concentrations of dopamine hydrochloride
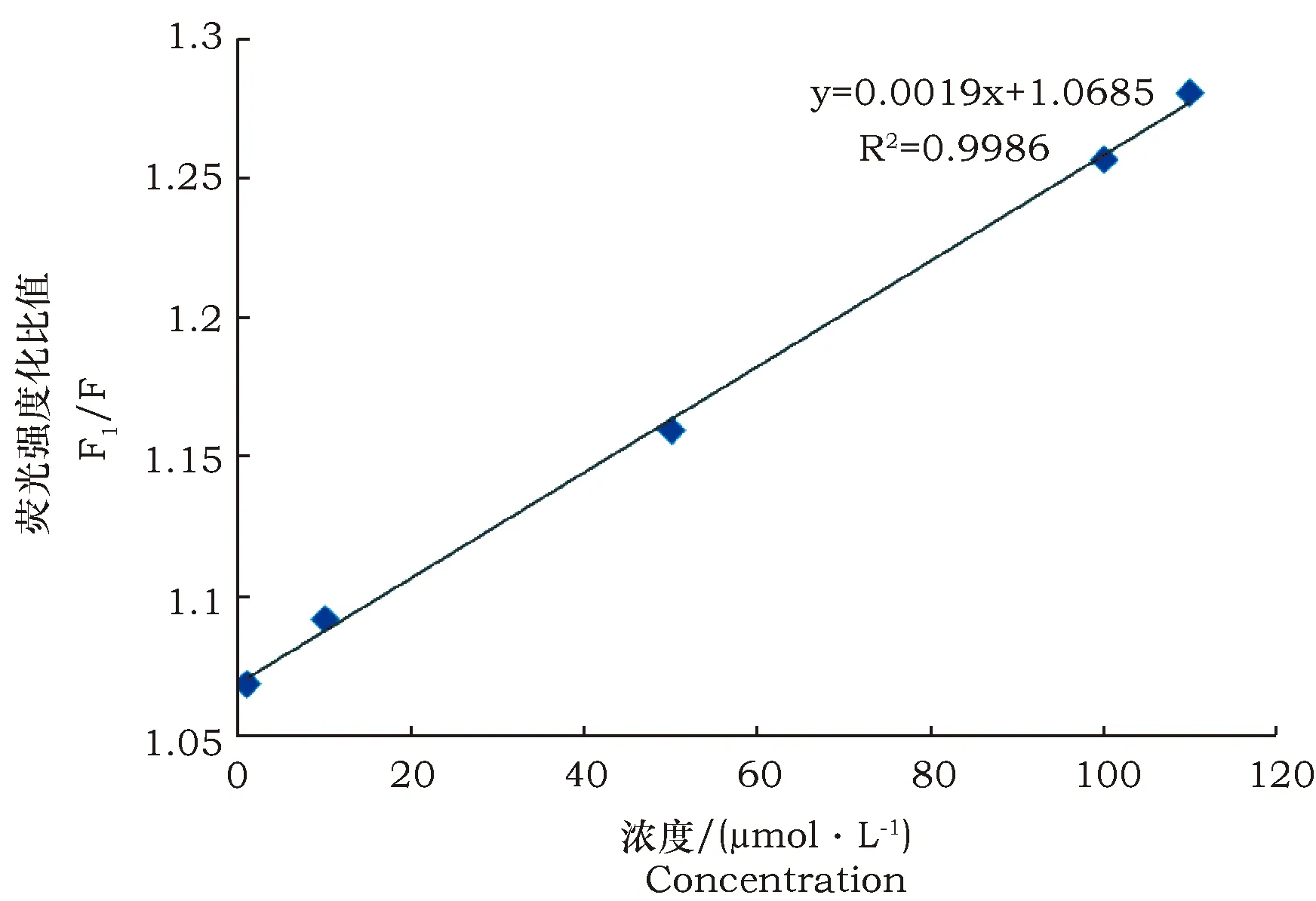
图7 盐酸多巴胺浓度与碳量子点荧光强度线性关系Fig.7 Linear relationship between dopamine hydrochloride concentration and fluorescence intensity of carbon quantum dots
2.4 实际样品检测分析
本试验选择当地生产的纯牛奶作为检测样品,用三氯乙酸(50%)去蛋白后离心,取上清液分别加入不同浓度盐酸多巴胺,使得盐酸多巴胺在牛奶中的浓度为10、50、100 mol·L-1,每个浓度做3个平行,按照上述检测方法检测,得到加标回收率为82.38%~104.2%,相对标准偏差为1.09%~2.01%(表1)。

表1 实际样品的回收率Table 1 Recovery of real samples
3 讨论与结论
兽药残留是是我国乃至全球食品安全的核心问题之一,根据近年来报告显示,我国人均饮奶量逐年上升,牛奶的需求量也大大增加[2]。随之而来的乳制品安全问题也受到极大关注,加强对牛奶生产链的安全监管刻不容缓,建立高效、灵敏的有害物质检测方法十分必要。
陈志兵等曾报道CdTe量子点与盐酸多巴胺组建二元体系检测盐酸多巴胺。目前已知合成量子点的材料多数为金属材料,甚至很多是有毒金属,不仅污染环境、操作过程复杂,原料价格也比较昂贵[14]。小麦、大米、玉米是3种常见的粮食,为人类日常食用的种类,拥有易获取、价格低廉、低毒性等特点。本文通过水热法一步合成3种不同的碳量子点,对构建先进、可持续和环境友好型光电检测提供了新思路。
荧光检测法具有高效快速检测的特点,目前为止,大多试验是运用荧光探针来检测一种金属离子,通过表面带负电的量子点基团与金属阳离子经静电作用力结合,引起量子点荧光强度变化,通过观察量子点的荧光强度变化来定量分析某种金属离子,检测物质的范围比较窄,有很大的局限性[15~17]。本文采用“开-关-开”荧光检测原理来检测牛奶中的兽药盐酸多巴胺。利用碳量子点自身发光的原理,与带正电的铁离子以静电力结合,通过发生电子转移,从而发生碳量子点的荧光猝灭现象,导致碳量子点的荧光强度降低,“关闭”碳量子点荧光信号[13]。在猝灭后的体系中加入一定浓度的盐酸多巴胺,可以将铁离子从碳量子点表面剥离下来并与盐酸多巴胺结合,释放被猝灭的碳量子点,量子点荧光强度上升,荧光信号被“打开”[12]。通过观察碳量子点的荧光强度先下降后上升来实现对牛奶中盐酸多巴胺的检测。此方法大大拓宽了量子点痕量检测的范围,建立了一种新的检测痕量物质的机理,使得量子点在检测痕量物质方面发挥更大的意义。
本文以常见粮食小麦、大米、玉米作为碳源材料制备了一种新型荧光探针,利用铁离子与碳量子点电子转移引起碳量子点荧光猝灭以及盐酸多巴胺与铁离子之间的络合作用,检测牛奶中的兽药盐酸多巴胺残留。最优条件下,盐酸多巴胺在1~110 μmol·L-1浓度范围内与碳量子点荧光强度变化呈线性关系,检出限为0.3 μmol·L-1,牛奶中的回收率为82.38%~104.2%,相对标准偏差为1.09%~2.01%,证明了该方法的灵敏性、适用性和准确性。
综上所述,本文采用日常食用的粮食作为量子点的原料,避免了使用重金属作为原料的污染。通过量子点-铁荧光探针检测盐酸多巴胺,构建了三元体系,可用于检测与量子点没有直接相互作用的目标物,为建立更多无荧光物质的荧光检测新方法提供理论依据,大大拓展了量子点在分析检测方面的应用。在今后的研究中,通过修饰量子点表面的官能团,建立选择性更强,灵敏度更高的荧光探针方法具有广阔的发展前景。

