破骨细胞融合分子机制的研究进展*
杨文杰 李耀玺 段莉 王大平*
[关键字] 破骨细胞;细胞融合;分子机制
破骨细胞(osteoclast,OC)是一类由骨髓造血干细胞来源的单核/巨噬前体细胞融合分化而来的多核巨细胞(含有3 ~100 个细胞核,细胞直径可达100 m),是体内介导骨吸收的主要细胞。破骨细胞体积越大,其所含的骨降解相关酶(如基质金属蛋白酶9、组织蛋白酶K 等)就越多,其骨吸收能力也越强,所以破骨细胞体积大小是评估或衡量衡量破骨细胞骨吸收能力的重要指标。破骨细胞的体积与破骨细胞核的数量成正相关[1]。研究表明,单核细胞与单核细胞、单核细胞与多核破骨细胞以及多核破骨细胞之间均可相互融合,其中以单核细胞与多核破骨细胞融合为主,以形成破骨细胞或细胞核数目更多的破骨细胞,所以细胞间融合是生成破骨细胞的关键[2]。随着近年来对破骨细胞相关研究的不断推进,人们对破骨细胞融合分子机制的认识也不断加深,这为治疗破骨细胞功能亢进所致的骨破坏过多疾病(如骨质疏松、类风湿性关节炎、骨关节炎等)寻求新的突破点。
正常情况下,细胞的脂质双分子层之间通过疏水作用、静电斥力和膜蛋白质的空间相互作用使自身结构稳定下来。破骨细胞前体细胞被招募、迁移到骨表面时,各细胞生物膜之间的初始距离较大(>20 nm),融合蛋白必须使预融合细胞间的脂质双层局部弯曲,使最强的膜间排斥面积最小化,从而使预融合细胞间紧密接触(几纳米的距离),下游的融合事件才得以进行[3]。细胞融合过程可归纳如下:首先,细胞识别其融合伴侣细胞,然后细胞质膜中的磷脂双层相互接触形成半融合结构,随后半融合结构进一步形成融合孔,最后融合孔扩张、细胞内容物混合完成细胞融合[4-5]。
1 细胞识别
细胞识别(cell recognition)是指细胞通过其表面的分子选择性地和其他细胞表面分子结合的现象。这些表面分子主要是蛋白质和糖蛋白。研究表明,发生融合的破骨细胞前体(即破骨细胞融合伴侣,osteoclast fusion partners)间存在互补分子的差异,融合前融合伴侣间存在选择性,故破骨细胞融合伴侣间存在细胞间的相互识别[6]。
抑制或敲除CD47 可分别抑制鼠OCs 以及巨噬细胞的融合[7]。Frendo 等[8]在Syncytin-1 反义RNA 存在或不存在情况下研究人类滋养层细胞融合时对所得细胞的核数量进行终点分析发现3 ~5 个核的合胞体的比例明显增加,而6 个核以上合胞体的比例显著降低。Møller 等[7]在研究破骨细胞融合不同阶段中CD47 和Syncytin-1 的参与情况,共分析了1 808 个破骨细胞前体个体融合事件,发现CD47 和Syncytin-1 在破骨细胞融合中具有不同的作用,其作用取决于融合伴侣的核数目。CD47 促进单核破骨细胞前体间融合,Syncytin-1 可促进2 个多核破骨细胞间的融合。因此,CD47和Syncytin-1 可能介导破骨细胞前体间的识别。此外,破骨细胞融合伴侣间融合主要通过2 种不同类型的细胞接触进行:吞噬杯状结构和宽接触表面。CD47 主要通过融合伴侣细胞膜间的宽接触表面来介导融合,而Syncytin-1 则通过吞噬杯状结构来介导融合。
破骨细胞前体细胞表达的CD47(又称整联蛋白相关蛋白)和信号调节蛋白(SIRP- )都是Ig 超家族的成员,其中CD47 可以作为SIRP- 的配体。CD47-SIRP 相互作用可抑制巨噬细胞的吞噬作用,并促进巨噬细胞融合形成破骨细胞[9]。
破骨细胞的树突状细胞特异性跨膜蛋白(DC-STAMP)是一种多次跨膜蛋白,是主导破骨细胞前体融合的主要蛋白质,是OC 融合的关键因素之一,其主要在单核破骨细胞前体的质膜上发现[10]。RANKL 可诱导破骨细胞前体表达DCSTAMP,在破骨细胞形成过程中DC-STAMP 的表达是逐渐降低的[11]。Mensah 等[10]研究DC-STAMP 在巨噬细胞和RAW264.6 巨噬细胞细胞系的融合中发现,这些细胞在用RANKL处理后可引起大约一半细胞细胞膜上的DC-STAMP转移至细胞质内,然后根据巨噬细胞和RAW264.6 巨噬细胞系细胞膜上DC-STAMP 含量分成DC-STAMPhi和DC-STAMPLo两个群体。当一个融合伴侣细胞膜上的DC-STAMPhi,另一个为DC-STAMPlo时,破骨细胞间才能有效融合[10,12]。Søe 等[2]在研究人类656 个破骨细胞的融合事件中发现人类破骨细胞前体(preOCs)和破骨细胞(OCs)在选择合适融合伴侣时的特征:融合伴侣通常包括一个不移动的融合受体细胞和一个可移动融合供体细胞; 不移动细胞主要是多核的,并且主要通过与含有一个细胞核的可移动细胞融合来增加它们的核数目; 较成熟的preOC / OC 趋向于和较不成熟的preOC 融合。RANKL 刺激preOC/OC 可诱导DC-STAMP-配体(该配体尚未被鉴定出来,可能是可溶性的或者是与膜结合的)的表达,随后DC-STAMP-配体通过自分泌和(或)通过G蛋白偶联受体(GPCR)信号传导介导的旁分泌来诱导融合基因表达[13]。因此推断DC-STAMP 可能参与破骨细胞前体间某些起识别(如CD47、Syncytin-1 等)或融合作用分子表达的调控。
2 融合中间结构的形成
当两个preOC / OC 相互识别后,细胞即将进入细胞膜脂质双层融合阶段(见图1 A),当然这需要某些特定融合蛋白的存在。对无蛋白质的脂质膜融合过程的研究中发现存在2 种重要的中间结构:半融合结构和融合孔[4]。其中半融合结构是形成融合孔的中间体[14]。
半融合结构表示相互黏附脂质双层间的外层小叶之间有联系,而内层小叶仍保持不变(见图1C)[4]。蛋白质通过诱导膜接触处的局部脱水和控制膜的弹性应力来促进半融合结构的形成。半融合结构是一种瞬时结构,它可解离形成2 个分离的(脂质双层)细胞,也可进一步融合形成融合孔[15-16]。
Chernomordik 等[3]对生物重塑表征良好的流感血凝素介导的融合现象和机制与无蛋白的脂质双层融合进行比较,认为脂质双层发生半融合和形成融合孔的倾向主要取决于脂质双层中脂质的组成。脂质双层中特定的脂质分子通过其分子结构和单层内的脂质相互作用形成有效的自发曲率,从而影响不同融合中间结构的形成。磷脂酰乙醇胺(PE)的脂质倾向于形成负自发曲率(呈锥形)(见图2A),磷脂酰胆碱的脂质倾向于形成略微负曲率,其自发曲率接近于零(近似圆柱形)(见图2B),溶血磷脂酰胆碱(LPC)倾向于形成正自发曲率(呈倒锥形)(见图2C)。当把倒锥形的LPC和锥形的PE 添加到接触小叶中时,可分别抑制和促进半融合,这表明半融合结构的形成与净负曲率相关;当把LPC和PE 添加到接触小叶外(即膜的非接触处)可分别促进和抑制融合孔形成,表明融合孔形成与非接触小叶的净正曲率相关[4]。说明半融合结构形成后,预融合的脂质双层在接触处要形成较大的净负曲率,而在非接触处则需形成较大的净正曲率,半融合结构才能进一步形成融合孔。
在生物物理学上,PE 的头基较少与水结合,使得相邻的富含PE 的脂质双层可以容易地彼此相互作用[5]。Kreutzberger 等[17]在对细胞胞吐过程的研究中指出PE 可促进膜变形和稳定融合孔。Irie 等[5]在通过定量PCR 和shRNA 介导基因敲除的方法研究破骨细胞形成过程中磷脂的动力学,首次证明了PE 在质膜中的重新分布(从脂质双层的内层小叶转移至外层小叶)是破骨细胞融合所必需的,其中ABCB4和ABCG1 负责PE 的重新分布。将单核细胞表面PE 固定,可使其不能融合形成多核破骨细胞[5,18]。在融合过程中融合蛋白的主要作用是产生和控制膜弹性应力[3]。融合蛋白引发脂质重排的关键步骤是将膜双层局部弯曲成指向即将与其融合的伴侣细胞的乳头状突起(见图1B);并且融合蛋白可通过降低半融合结构形成和融合孔开放的能障使乳头状突起的顶部融合[4,19]。所以,推测将破骨细胞前体质膜中PE 固定或抑制PE 在质膜中的再分配使破骨细胞前体不能形成多核破骨细胞原因可以解释为:即使融合蛋白使2 个破骨细胞前体间密切接触,但由于质膜外层小叶中无足够的PE,使得细胞前体间的相互作用力不足,致使二者不能进行融合;在破骨细胞前体间的接触小叶处不能形成有效的或足够大的负性曲率,从而抑制破骨细胞前体由半融合结构向融合孔方向发展。
融合孔是发生融合的2 个脂质双层膜间内、外层小叶之间的连接,它的形成在细胞间建立了水性连接(见图1D)。融合孔形成后相互融合的前体细胞间有内层小叶脂质和水内容物的混合[16,20]。融合孔的结构是由融合蛋白跨膜结构域(TMD)围成的完全蛋白质通道样结构,且其外层可能被脂质覆盖,从而在膜的接触小叶之间形成脂质连接[21]。
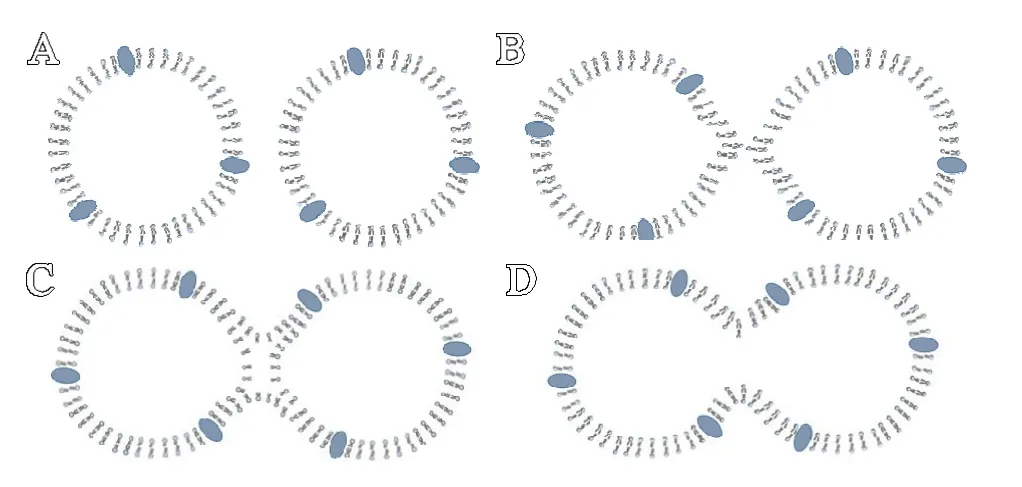
图1 两细胞脂质双分子层间的融合是通过半融合途径进行的(A→B→C→D)为两个细胞膜脂质双分子层的融合顺序)。A.2 个预融合细胞间在促融合剂作用下或相互识别后,逐步相互靠近或接触;B.2个预融合细胞膜脂质双分子层局部弯曲成乳头状突起;C.半融合结构形成:2 个细胞膜(脂质双分子层)呈乳头状突起,脂质双分子层中的外层小叶相互接触混合,而内层小叶仍各自保持独立; D.融合孔形成: 2 个细胞膜脂质双分子层中的内外层小叶以及2 个细胞的胞浆相互混合
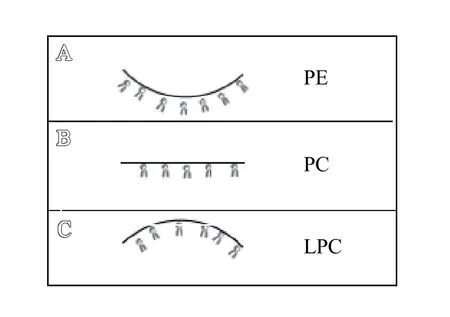
图2 不同的脂质分子可自发地形成不同的曲率的单层,从而表现为不同的子形状: A.磷脂酰乙醇胺(PE)可形成的锥形单层(单层向烃链的方向上膨胀);B.磷脂酰胆碱(PC)可形成几乎平坦的单层;C.溶血磷脂酰胆碱(LPC)可形成倒锥形的单层(单层向极性头的方向上膨胀)
ATP门控P2X7 受体是属于P2X嘌呤能受体家族的质膜受体,由造血起源的细胞表达,其活化后主要通过改变细胞膜对离子的通透性,从而触发多种细胞内信号传导事件,如细胞因子释放、炎症、免疫应答和细胞凋亡[22-23]。另外,有研究表明P2X7 受体参与多核巨细胞和细胞多核化的产生[24]。在体内、外人破骨细胞均可表达P2X7 受体,且P2X7 受体具有明显的成孔作用,用拮抗剂氧化ATP、用单克隆抗体阻断P2X7 受体或抑制P2X7 受体基因表达均可显著抑制破骨细胞前体间的融合,所以P2X7 受体可能参与破骨细胞间融合孔的形成[24]。
脂筏(lipid-raft)是位于质膜的外层小叶中由脂质—脂质(胆固醇,鞘脂和饱和脂肪酸[25-26])和脂质—蛋白质[27](膜—肌动蛋白细胞骨架)相互作用形成的动态结构域,大小约70 nm。stomatin 是脂筏的主要成分之一,在许多细胞类型中广泛表达(存在于质膜和外泌体中),具有疏水结构域、棕榈酰化和寡聚化等特殊结构,其可通过分子间相互作用来调节膜受体,并诱导不同类型的细胞融合形成多核细胞[28-29]。当外泌体与靶细胞膜融合或者以胞吞作用进入靶细胞后,stomatin 可在脂筏内形成高级寡聚体并执行其功能。stomatin可通过共聚效应促进促融合蛋白之间的相互作用,也可通过增加质膜渗透性来缓解膜弯曲应力,导致促融合分子聚集到肌动蛋白细胞骨架上,从而作为刚性支撑平台或肌动蛋白聚合位点以驱动融合孔的扩张;在破骨细胞形成过程中,stomatin 的增加可促进preOC 融合,stomatin 的减少抑制preOC 融合[30]。
3 展望
破骨细胞融合过程包括识别、融合中间结构和融合孔的形成。破骨细胞前体间的融合与破骨细胞大小及其骨吸收能力密切相关,故对其融合进行调控有望成为治疗骨吸收亢进性疾病的突破点。目前,已确定与融合中间结构形成有关的分子包括ABCB4、ABCG1、P2X7 受体等,然而,这些分子并非是preOC /OC 特异表达,如单用某种药物来长期抑制破骨细胞的形成可导致严重的不良反应。因此,深入研究破骨细胞特异性融合蛋白(或分子),可为研发治疗骨吸收亢进性疾病的特异性药物奠定基础。

