PD模型大鼠纹状体中等多棘神经元树突棘运动依赖可塑性研究
陈 平,刘晓莉,马婧,乔德才
(1.北京师范大学 体育与运动学院,北京 100875;2.吉首大学 体育科学学院,湖南 吉首 416000;3.国家体育总局体育科学研究所,北京 100061)
帕金森病(Parkinson’s disease,PD)是由于黑质致密部(substantia nigra pars compacta,SNc)多巴胺(dopamine,DA)能投射严重丢失,导致基底神经节(basal ganglia,BG)运动调节功能紊乱而引发的一种缓慢进展性神经系统退变疾病(Bastide et al.,2015),该疾病的主要临床表现为运动功能障碍。目前临床尚无治愈PD的有效疗法,患者随病情加重会完全丧失自主行为能力,直接影响了老年人的日常生活。近年来,学者开始关注运动对PD的防治效果,发现身体活动水平与PD发病间存在一定关联(Hou et al.,2017),适当的身体活动可显著改善PD患者的步态、平衡、协调等行为功能(Herman et al.,2007)。本实验室的前期研究也证实,中等强度运动干预对PD模型大鼠行为功能障碍有明显改善作用,其神经机制与运动促进内源性大麻素(endocannabinoids,eCB)配体合成,减轻纹状体神经元胞外谷氨酸(glutamine,Glu)过度增高引起的兴奋性毒作用(林湘明 等,2017),抑制皮层-纹状体Glu能突触传递效能(陈巍等,2015b),纠正基底神经节直接通路与间接通路的功能失衡有关(赵刚等,2020)。此外还发现,DA耗竭导致PD模型大鼠纹状体中等多棘神经元(medium spiny neurons,MSNs)树突棘脱落与运动功能障碍出现具有相关性,中等强度运动干预可使PD模型大鼠纹状体MSNs树突棘密度显著增加,并伴随着运动功能障碍的显著改善,推测纹状体MSNs形态可塑性可能在运动改善PD模型大鼠运动功能障碍中起重要作用(陈巍等,2015a)。MSNs约占纹状体神经元的95%,由于受体表达的特异性可分为2种亚型:表达多巴胺I型受体(do‐pamine1type receptors,D1R)的D1-MSNs和表达多巴胺型II受体(dopamine 2 type receptors,D2R)的D2-MSNs,它们分别调控基底神经节直接通路与间接通路的功能。PD状态下,DA耗竭引起纹状体D2-MSNs过度激活,被认为是导致基底神经节功能紊乱的主要原因之一;那么,纹状体MSNs树突棘运动依赖可塑性是否也可能选择性地发生在D2-MSNs,尚缺乏直接的实验证据。为此,本研究试图采用逆行神经示踪的方法,分别用荧光标记D1-MSNs和D2-MSNs,证实PD模型大鼠纹状体MSNs树突棘运动依赖可塑性发生的可能细胞靶点。
1 实验对象和方法
1.1 实验对象与分组
健康雄性清洁级SD大鼠,体重240±10 g(8周龄),购自北京华阜康生物科技股份有限公司[生产许可证号:SCXK(京)2009-0007]。大鼠分笼饲养,自由进食和饮水,12/12 h昼夜循环,动物房内温度控制在20℃~25℃,相对湿度为50%±10%。所有动物实验操作均经北京师范大学动物伦理委员会批准,还按照实验动物使用的3R原则,对实验动物给予人道主义关怀。大鼠适应性饲养1周后随机分为假手术安静组(Con组,n=12)、模型组(n=32);模型组经鉴定符合PD模型的大鼠随机分为PD组和PD运动组(PD+Ex组);各组再分为2个亚组,即D1-MSNs/D2-MSNs标记的安静对照组(Con+D1-MSNs组)/(Con+D2-MSNs组),D1-MSNs/D2-MSNs标记的6-羟基多巴胺(6-Hydroxydopamine,6-OHDA)安静组(PD+D1-MSNs组)/(PD+D2-MSNs组),D1-MSNs/D2-MSNs标记的6-OHDA运动组(PD+Ex+D1-MSNs组)/(PD+Ex+D2-MSNs组)。
1.2 PD模型的制备与评价方法
1.2.1 PD模型大鼠的制备
大鼠禁食24 h,自由饮水。腹腔注射10%水合氯醛(0.35 ml/100 g)麻醉大鼠。俯卧位将头固定于可调节的大鼠脑立体定位仪上,并用控温加热垫保持大鼠体温(37℃),充分暴露前后囟使之保持在同一水平面上。参照Paxionos等(1997)大鼠脑定位图谱确定右脑内侧前脑束(medial forebrain bundle,MFB)坐标(AP:-4.3 mm,R:1.5 mm,H:7.6~7.8 mm)作为6-OHDA注射点,将6-OH‐DA 溶于含 0.02% 抗坏血酸生理盐水中(2 μg/μL),以1 μL/min 匀速给药,药物总量为 8 μg/4 μL,注射完毕留针5~10 min,缓慢退针。Con组大鼠在相同注射点给予等量含0.02%抗坏血酸的生理盐水。手术完成待清醒后放置笼内单笼饲养。
1.2.2 PD模型大鼠的评价方法
药物诱导的旋转行为实验在6-OHDA注射后第7天实施,分别对各组大鼠颈部皮下注射阿扑吗啡(apomor‐phine,APO,0.5 mg/kg)诱导旋转行为实验,记录30 min内大鼠旋转圈数。本研究筛选净旋转圈数(向损伤侧旋转圈数与向健侧旋转圈数)的差值>100 r/30 min作为PD大鼠模型制备成功的标准(Jia et al.,2009),剔除不符合标准的大鼠。
1.2.3 黑质、纹状体酪氨酸羟化酶表达水平检测
所有实验结束后24 h,各组大鼠腹腔注射10%水合氯醛(0.35 mL/100g)麻醉,依次经心脏灌注预冷的生理盐水(250 mL)和多聚甲醛(4 g/L,300 mL),断头取脑组织放入固定液中固定24 h,转入30%的蔗糖溶液至沉底,修块,包埋。参照Paxionos等(1997)大鼠脑立体定位图谱确定纹状体和黑质位置,连续冠状切片,每隔3张选取1张切片在0.01 M的PBS(PH 7.4)中漂洗后,室温下置于0.3% Triton X-100的PBS中破膜30 min,3% H2O2中孵育10 min,PBS漂洗;脑片转入5%山羊血清的PBS中室温孵育1 h,鼠抗TH单抗隆抗体(1∶3 000)(Sigma,USA)孵育过夜;PBS漂洗3次后,室温下生物素化兔抗孵育1 h,亲和素-生物素-过氧化物酶复合物(ABC-Elitekit,Vector Laborato‐ries,USA)孵育1 h,PBS漂洗3次,DAB溶液中显色10~20 s。采用Olympus-DP72型显微镜拍照,Image-Pro Plus 6.0软件统计分析酪氨酸羟化酶(tyrosine hydroxxylase,TH)平均光密度,判断DA能神经元的损毁情况。
1.3 D1-MSNs/D2-MSNs胞体逆行示踪
6-OHDA注射完毕后,参照Paxionos等(1997)确定苍白球内侧部(globus pallidum internus,GPi)(BP:2.3 mm,R:2.8 mm,H:8.0 mm)、苍白球外侧部(globus pallidum ex‐ternal segment,GPe)(BP:1.3 mm,R:3.2 mm,H:6.5 mm)坐标,牙科钻钻孔,用微量注射泵将Retro-beads(注射计量为 500 nL,速度 50 nL/min)分别注入 GPi和 GPe(图 1)。注射完毕后均留针10 min,缓慢退针。用生物硅胶填充颅骨孔,医用碘伏和明胶海绵消毒止血后,缝合伤口,并用青霉素敷于伤口表面预防感染;待清醒后放置笼内,单笼饲养。

图1 D1-MSNs/D2-MSNs胞体逆行标记病毒注射位点(Gerfen et al.,2010)Figure 1.Virus Injection Sites of D1-MSNs/D2-MSNs Soma Retrograde Tracing
1.4 行为学测试
采用爬杆实验(pole test)评价大鼠四肢运动的协调性(Tajiri et al.,2010)。爬杆(高60 cm,直径0.7 cm)用医用纱布缠好,保证有足够的摩擦力;将大鼠头端朝下置于杆顶,记录大鼠从杆顶爬至杆底平面所需时间。每只大鼠测试3次,每次间隔5 s,取平均值。测试前引导每只大鼠自杆顶爬至杆底面,进行2次适应性训练。
1.5 运动干预方案
术后1周,采用Tajiri等(2010)建立的运动方案,对PD+Ex组大鼠进行跑台运动干预。训练方案为:11 m/min,30 min/d,5 d/w,共4周(周六、日休息)。运动干预时间为训练日下午16∶00—18∶00。Con组与PD组大鼠在相同时间段置于跑台内,但不进行跑台运动,使其处于自然安静状态。
1.6 D1-MSNs/D2-MSNs的荧光标记
大鼠腹腔注射10%水合氯醛(0.35 ml/100 g)麻醉后处死,迅速取脑,振动切片(300 μm),脑片放入34.5℃的人工脑脊液(artificial cerebrospinal fluid,ACSF)中孵育1 h;在膜片钳显微镜的紫外光激发下可以观察到被Retro‐beads逆行标记的纹状体苍白球内侧部或纹状体苍白球外侧部(Str-GPi或Str-GPe)神经元的胞体(图2)。用加入biocytin的电极内液钳制Retrobeads标记的神经元胞体,约patch 15~30 min,撤出电极,将脑片在含有4%PFA的PBS溶液中固定过夜(4℃),PBS洗10 min×3,0.5%triton破膜30 min,5%BSA 1 h,加入Avidin 555室温孵育2 h,PBS洗10 min×3;激光共聚焦扫描显微镜下拍照。
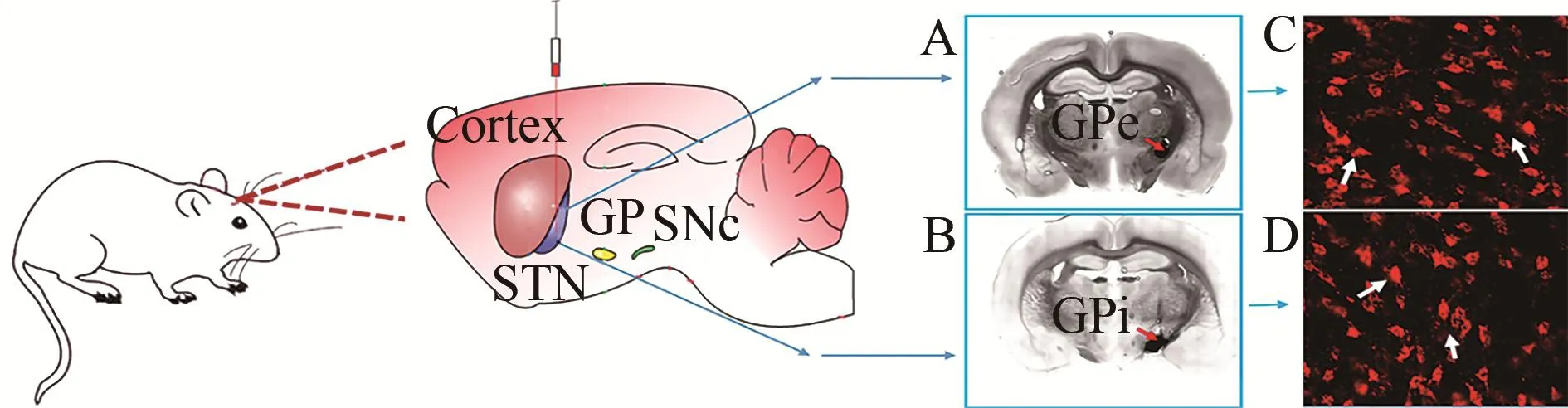
图2 D1-MSNs或D2-MSNs胞体逆行示踪标记Figure 2.D1-MSNs or D2-MSNs Cytosolic Retrograde Tracing
1.7 免疫印迹(Western blot)检测PSD-95和Syn蛋白
大鼠禁食24 h,腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉,断头取脑,迅速于冰面上剥离双侧纹状体。加入适量组织裂解液和苯甲基磺酰氟(PMSF)超声裂解,提取总蛋白;用BCA蛋白浓度测定试剂盒测定蛋白浓度后,加入5×SDS上样缓冲液,于沸水中煮5 min,冰上冷却,置于-80℃冰箱储存备用。取蛋白样本30 μg经SDS-聚丙烯酰胺凝胶电泳后,经电转膜仪转运蛋白至硝化纤维素膜上,室温下封闭1 h后,使用以下主要抗体对PSD-95和Syn进行检测:鼠 anti-PSD-95 IgG(1∶10 000,EMD Milli‐pore,Billerica,MA),兔 anti-Syn IgG(1∶5 000,Vector Lab‐oratory,Inc.,Burlingame,CA)。主要抗体用含有 2% 的NGS和0.05%TX进行稀释。组织在抗体溶液中4℃环境下孵育过夜后,TBS清洗3次。辣根过氧化物酶标记的兔抗 抗 体(1∶2 000;Vector Laboratories,Burlingame,CA,USA)作为二抗,37℃孵育过夜;洗后再转移到ECL化学发光显色液中,曝光后显影、定影,最后扫描并图像分析;计算目的条带PSD-95和Syn蛋白的吸光度值。为减少个体差异,以该大鼠损伤侧吸光度值/未损伤侧吸光度值的比值表示PSD-95和Syn蛋白表达的相对水平。
1.8 树突棘密度分析
用于分析的MSNs入选标准为:胞体为圆形或卵圆形,有3~8个1级树突。在Olympus激光共聚焦扫描显微镜下观察MSNs树突棘的密度,由于各级树突上树突棘的分布不均匀,因此,从神经元胞体发出树突的第1次分支开始,计算30~60 μm长度范围内树突棘的个数,再计算其树突棘的密度(每10 μm长度范围内树突棘个数)。
1.9 统计分析
所有数据采用SPSS 20.0统计软件包进行统计学分析,结果以均值±标准差(M±SD)表示,采用GraphPad Prism 6软件作图。组间均值的比较采用单因素方差分析(One-Way ANOVA),选择LSD检验对组间均值进行差异性比较;采用重复测量双因素方差分析(Repeated measure two-way ANOVA)比较组内各指标随时间变化;采用卡方检验比较组间百分比指标的差异性;以P<0.05视为有统计学意义。
2 研究结果
2.1 PD大鼠模型可靠性评价
6-OHDA注射后第7天对大鼠进行APO诱导的旋转行为检测,结果表明,6-OHDA损毁大鼠共32只,旋转次数>100 r/30 min(167.68±16.23 r/30 min)的共计24只,成模率75%,未达到模型评价标准的大鼠剔除(图3)。
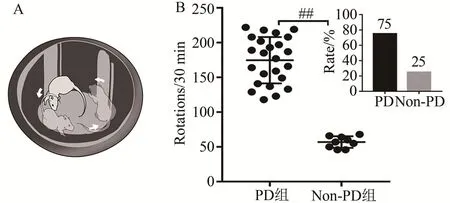
图3 APO诱导旋转试验测试结果及PD大鼠成模率Figure 3.Results of Apo-Induced Rotation Test and PD Molding Rate
最后1周行为学测试结束后,对纹状体和黑质进行取材并做免疫组织化学染色。结果显示,Con组双侧黑质TH免疫阳性细胞表达均匀且对称分布,双侧纹状体TH免疫阳性纤维终末含量均匀、密集、对称;PD组损毁侧黑质(右侧)TH免疫阳性细胞数量及损毁侧纹状体(右侧)TH免疫阳性纤维终末含量均出现严重丢失,双侧黑质、纹状体TH免疫阳性细胞表达、免疫阳性纤维终末含量均呈现明显的不对称性。与Con相比,PD组大鼠黑质TH免疫阳性细胞数量、纹状体TH免疫阳性纤维终末含量均显著降低(P<0.01);与PD组相比,PD+Ex组大鼠黑质TH免疫阳性细胞数量、纹状体TH免疫阳性纤维终末含量均无显著改变(P>0.05)(图4)。

图4 黑质与纹状体TH免疫组织化学检测结果Figure 4.Results of TH Immunostaining in SNc and Striatum
2.2 各组大鼠四肢协调能力的比较
爬杆实验结果显示,Con组大鼠爬杆过程中四肢并用,动作协调,能够一次性顺利从杆顶爬下;PD组大鼠爬杆过程中表现为笨拙、恐惧、抓杆不能,甚至有掉落现象,从杆顶爬至杆底的延迟时间较Con组显著延长(P<0.01);PD+Ex组大鼠爬杆过程中表现为螺旋向下爬行,四肢抱紧杆,有间歇停顿现象,自杆顶爬至杆底的延迟时间较PD组显著缩短(P<0.05)(图5B)。
对各组大鼠各周四肢协调能力进行比较,结果表明,与第0周相比,Con组大鼠各周爬杆延迟时间无显著变化(P>0.05);PD组大鼠各周爬杆延迟时间随着6-OHDA毒素损伤时间的延长而显著增加(P<0.01);PD+Ex组大鼠各周爬杆延迟时间也表现出增加的趋势,自第2周开始均低于PD组,第4周时呈现显著降低(P<0.05),第5周时降低更加显著(P<0.01),存在明显的时序性变化(图5C)。

图5 各组大鼠四肢协调能力的比较Figure 5.The Comparision of Movement Coordination in Each Group
2.3 各组大鼠纹状体MSNs树突棘密度的比较
激光共聚焦扫描显微镜下观察纹状体MSNs树突棘密度发现,与Con组相比,PD组和PD+Ex组大鼠D1-MSNs树突棘密度无显著改变(P>0.05);与Con组相比,PD组D2-MSNs大鼠树突棘密度显著降低(P<0.01)。与PD组相比,PD+Ex组D2-MSNs树突棘密度显著增加(P<0.05)(图6)。
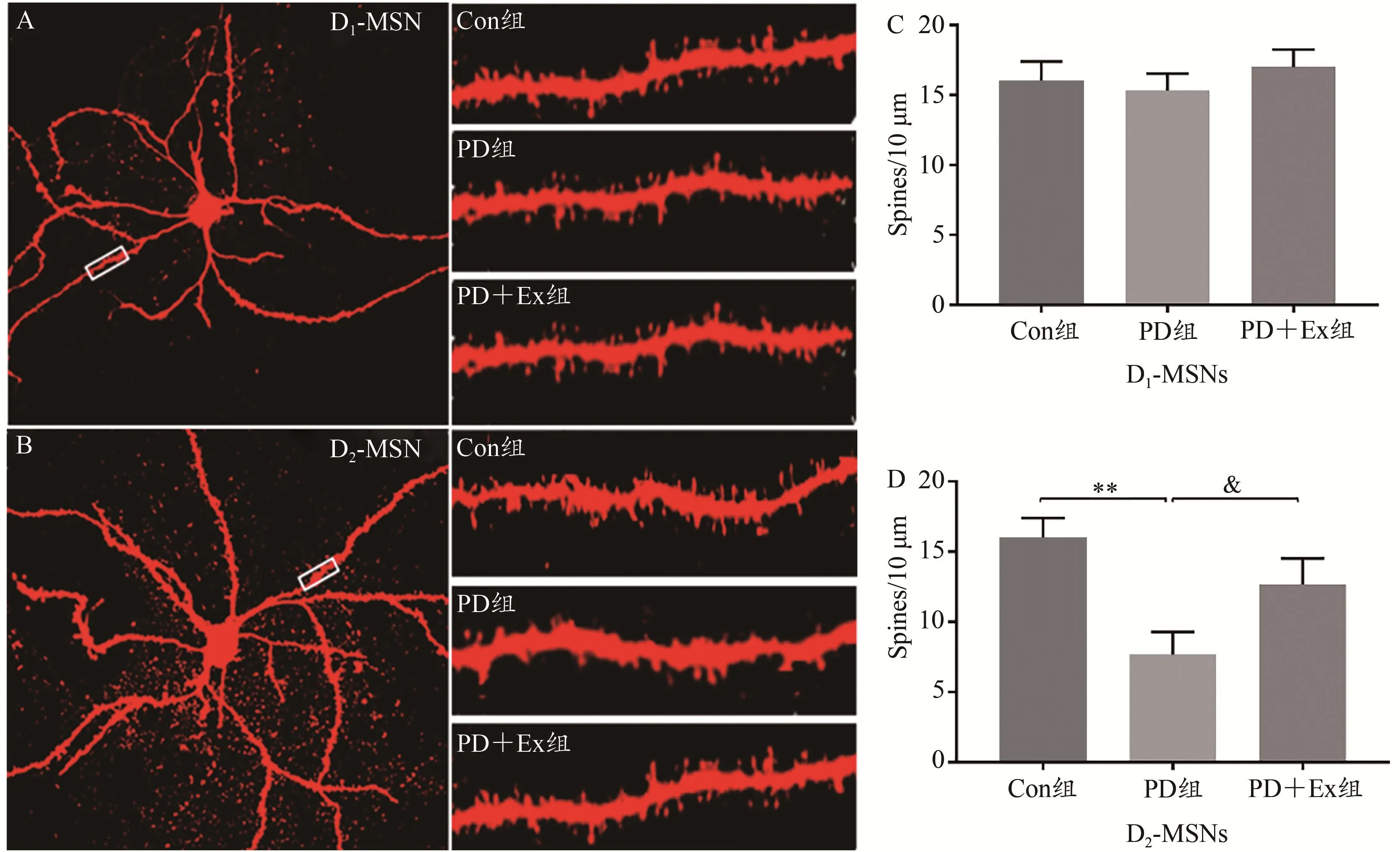
图6 各组大鼠纹状体MSNs树突棘密度的比较Figure 6.Effect of Exercise Intervention on the Density of Msns Dendritic Spines of Triatum
2.4 各组大鼠D1-MSNs/D2-MSNs形态学参数分析
Sholl分析结果显示,PD组与Con组相比、PD+Ex组与PD组相比,大鼠D1-MSNs和D2-MSNs一级树突分支数量、胞体面积、树突总分支数量和树突分支总长度均无显著改变(P>0.05,P>0.05)(图7、图8)。
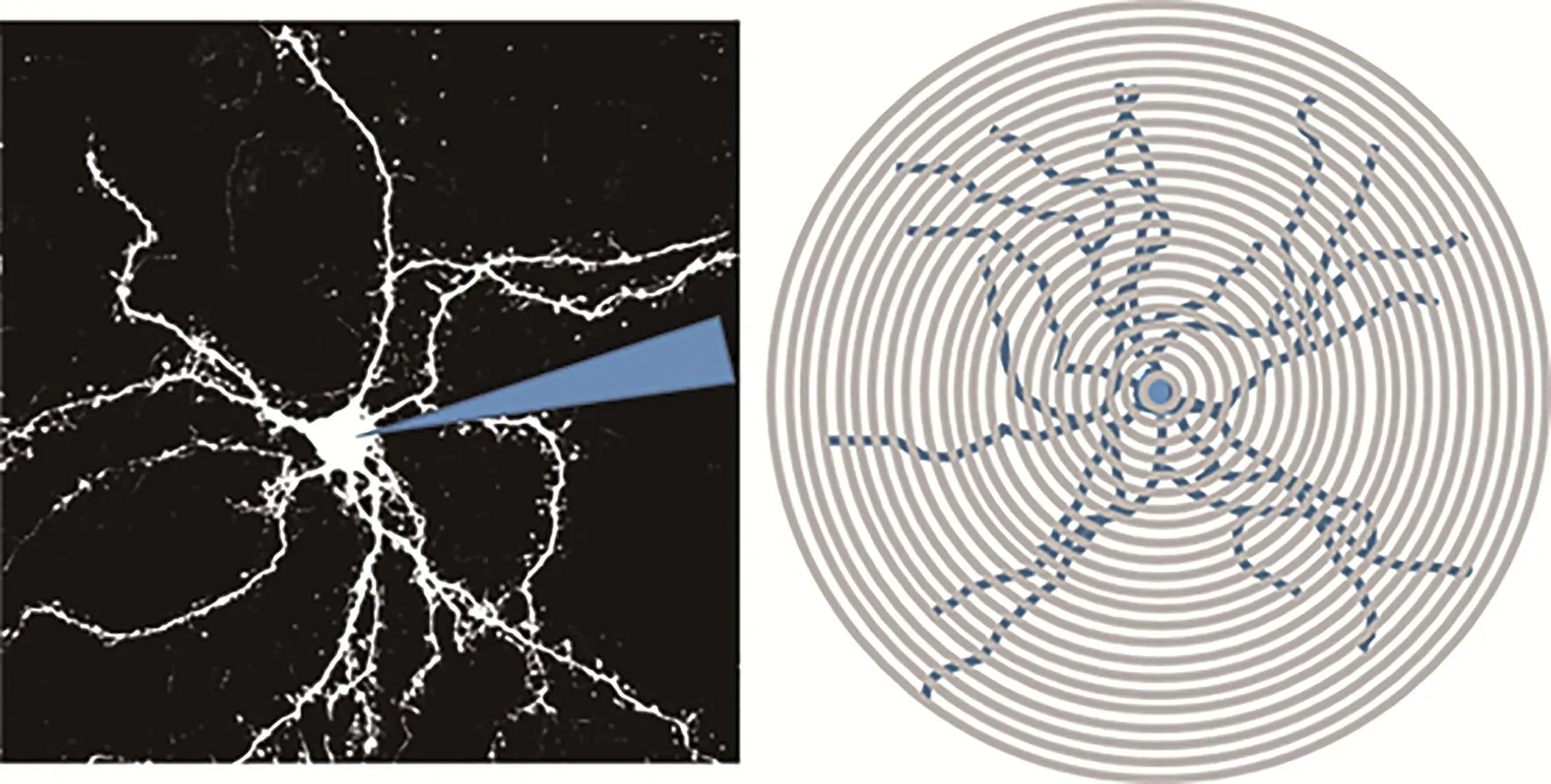
图7 纹状体MSNs Sholl分析模式图Figure 7.Pattern MSNs Sholl Analysis of Striatum
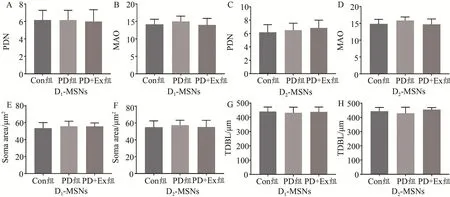
图8 各组大鼠纹状体MSNs树突分支、树突分支总长度及胞体面积比较Figure 8.Analysis of The Branch of Dendrite,Total Length and Cell Area of the MSNs in Striatum of Rats
2.5 各组大鼠纹状体PSD-95、Syn蛋白表达水平比较
免疫印迹结果显示,与Con组相比,PD组大鼠纹状体PSD-95表达水平显著下调(P<0.01);与PD组相比,PD+Ex组大鼠纹状体PSD-95表达水平显著上调(P<0.05)。与Con组相比,PD组大鼠纹状体Syn表达水平显著下调(P<0.01);与PD组相比,PD+Ex组大鼠纹状体Syn表达水平显著上调(P<0.05)(图9)。
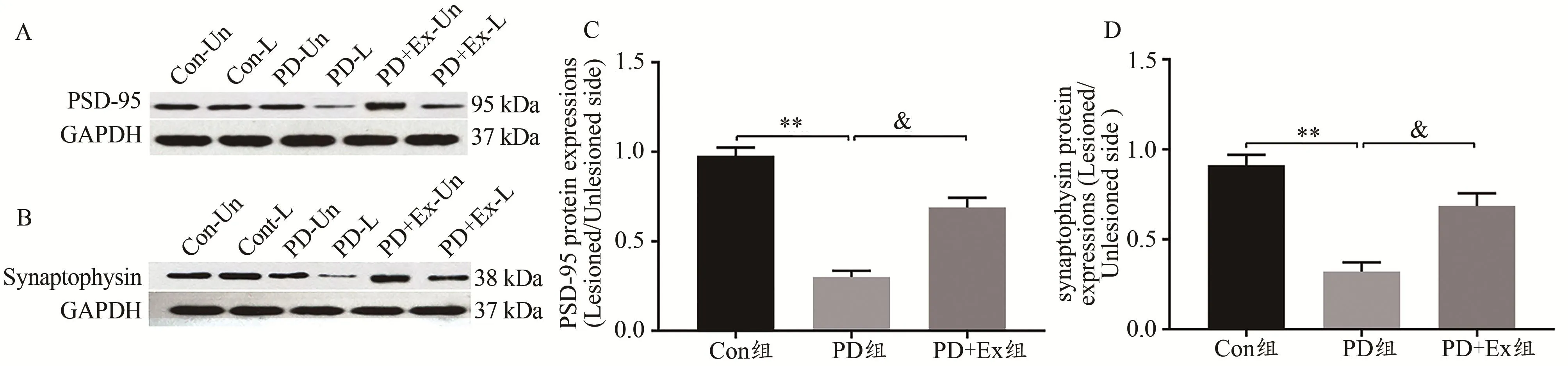
图9 各组大鼠纹状体PSD-95、Syn蛋白表达水平比较Figure 9.Expression of PSD-95 and Syn Protein in the Striatum of Rats
3 讨论
树突棘是构成记忆存储和突触传递的解剖学基础,具有很强的可塑性。在生命的整个周期中,哺乳动物大脑中神经元树突棘的数量和密度会随着发育的进展出现动态变化。多种神经系统疾病或丰富环境均可能引起树突棘形态结构的改变,并影响突触的可塑性。
3.1 PD状态下纹状体MSNs树突棘丢失
McNeill等(1988)、Stephens等(2005)和 Zaja-Milatovic等(2005)对PD患者的脑组织进行尸检结果发现,纹状体MSNs树突和树突棘存在萎缩或丢失现象。Nishijima等(2013)采用免疫电镜技术观察发现,6-OHDA偏侧损毁模型大鼠去DA神经支配后纹状体树突棘的数量、密度显著降低。Zhang等(2013)发现,6-OHDA偏侧损毁模型大鼠纹状体MSNs胞体远端和近端树突上的树突棘大约丢失40%。Soderstrom等(2010)采用Golgi染色的方法也得到了类似的结果。Suarez等(2014)和Antzoulatos等(2011)采用Golgi染色和免疫电镜观察发现,PD模型小鼠纹状体MNSs树突长度、分枝数量及树突棘数量、密度均显著降低;Villalba等(2011)和Smith等(2009)利用Golgi染色技术结合3D电子显微镜观察发现,非人灵长类PD模型纹状体MSNs树突棘丢失30%~50%。此外,有研究采用免疫组织化学结合超微结构分析发现,皮层与纹状体MSNs树突棘相突触的轴-棘突触体积增大,Glu能突触后致密区(PSD)厚度和穿通型突触数量增加,突触前Glu能轴突终端增大,这些形态变化是Glu能突触传递增强的解剖学基础,也代偿MNSs树突棘的丢失(Villalba,2009;Villalba et al.,2011)。然而,Day等(2006)利用细菌人工染色体(BACs)作为克隆载体,建立增强型绿色荧光蛋白(eGFP)标记多巴胺Ⅰ型受体(D1DR)和多巴胺Ⅱ型受体(D2DR)的转基因小鼠模型,给予利鲁平处理后发现,DA耗竭可使纹状体D2-MSNs树突棘数量明显减少,而D1-MSNs树突棘数量无显著改变。本研究采用逆行神经示踪技术分别标记D1-MSNs和D2-MSNs,利用激光共聚焦扫描显微镜观察到,PD模型大鼠纹状体MSNs树突棘脱落的部位主要发生在D2-MSNs,而D1-MSNs树突棘密度未出现显著减少这与Day等(2006)利用转基因PD模型小鼠获得的研究结果相同;通过Sholl分析发现,PD模型大鼠纹状体D1-MSNs和D2-MSNs一级树突分支数量、总树突分支数量、树突长度以及胞体面积均未显著改变。Kim等(2013)采用Golgi染色及电镜观察树突分支,发现PD模型小鼠纹状体MSNs树突分支长度和总树突分支数量呈显著降低。推测导致上述结果不一致的原因与研究方法不同有关,逆行神经示踪荧光标记方法能较好地保持神经元活性,其结果较Golgi染色获得的结果更真实可信。目前仍未完全阐明PD动物纹状体MSNs树突棘丢失的确切机制,有研究认为,可能与Glu兴奋性毒性、氧化应激、神经炎症等诸多因素有关(Villalba et al.,2010)。DA替代疗法不能阻止PD状态下纹状体MSNs树突棘丢失,说明DA耗竭并不是导致纹状体MSNs树突棘形态改变的主要因素。Garcia等(2010)研究表明,用6-OHDA同时损毁黑质与皮层可显著降低由DA去神经支配导致的纹状体MSNs树突棘丢失。Neely等(2007)发现,给予mGluR2/3激动剂抑制皮层-纹状体突触前Glu释放可阻止PD状态下MSNs树突棘脱落。Day等(2006)利用免疫电镜观察证实,抑制纹状体D2-MSNs上L-型钙通道蛋白Cav1.3α活性或基因敲除Cav1.3α亚单位后D2-MSNs树突棘脱落现象消失。上述结果表明,PD状态下纹状体MSNs树突棘数量和密度的选择性丢失可能主要与皮层-纹状体突触前Glu过度释放导致的兴奋性毒作用有关。
3.2 运动选择性降低PD模型大鼠纹状体MSNs树突棘丢失
树突棘形态与结构具有运动环境依赖可塑性。Petz‐inger等(2007)发现,运动干预可增加PD模型小鼠纹状体MSNs树突分枝长度、数量以及树突棘密度。Toy等(2014)采用转基因PD小鼠研究发现,6周递增跑台训练后纹状体D1-MSNs和D2-MSNs树突棘和树突分支数量均显著增加,PSD-95和Syn表达水平显著上调。本实验室前期研究表明,4周跑台运动干预可使PD模型大鼠纹状体MSNs树突棘密度显著增加,穿通型突触数量显著增多(陈巍等,2015a)。本研究利用神经元逆行示踪标记方法进一步研究证实,PD模型大鼠纹状体树突棘形态结构的运动依赖可塑性主要发生在D2-MSNs,支持了“PD模型大鼠纹状体树突棘形态运动依赖可塑性具有选择性,作用的细胞靶点可能在D2-MSNs”的研究假设;也为本研究团队基于在体或离体电生理学技术证实“跑台运动干预降低皮层-纹状体Glu通路的过度传导并抑制D2-MSNs兴奋性”的研究结论(赵刚 等,2019;Chen et al.,2017)提供了 新的形态学依据。
PSD-95是定位于突触后致密区的一种结构锚定蛋白,参与突触强度和突触可塑性调节(Black et al.,1990)。Syn是定位于突触前终端囊泡膜上的一种特异性膜蛋白(Takamatsu et al.,2010),是反映突触类型、突触数量的重要蛋白分子标记物(Hu et al.,2009)。Pagnussat等(2012)研究表明,体力活动和运动技能学习均可促进海马脑区的突触形成;Hu等(2009)研究表明,运动促进大鼠海马神经元突触结构重塑与PSD-95蛋白表达上调有关。Ribeiro等(2013)研究表明,适度运动增加黑质和纹状体脑区Syn表达和突触后PSD厚度,促进突触传递及突触可塑性。本研究发现,运动通过上调纹状体突触连接蛋白PSD-95和Syn蛋白表达,增加D2-MSNs树突棘数量和密度,这为纹状体MSNs运动依赖可塑性发生,进而改善PD模型大鼠四肢协调性奠定了良好的解剖学基础。
3.3 运动选择性降低PD模型大鼠纹状体D2-MSNs树突棘丢失的可能机制
运动选择性降低PD模型大鼠纹状体D2-MSNs树突棘丢失的可能机制与运动降低皮层-纹状体Glu突触传递效能有关。本研究团队通过离体脑片膜片钳场电记录技术研究证实,运动或D2R激动剂干预均可抑制D2-Cre小鼠PD模型皮层-纹状体Glu突触传递异常增高现象,推测D2R在运动降低皮层-纹状体Glu突触传递中起重要作用(赵刚等,2019)。D2R为G蛋白偶联受体,激活D2R引起Gi/o蛋白偶联反应,降低腺苷酸环化酶活性,使细胞膜电位超极化,抑制D2-MSNs兴奋性。此外,运动选择性降低PD模型大鼠纹状体D2-MSNs树突棘丢失的可能机制与运动降低皮层-纹状体Glu通路的兴奋性毒作用有关。Glu为兴奋性神经递质,PD状态下皮层-纹状体突触前Glu大量释放,激活突触后膜D2-MSNs上受体门控和电压门控钙通道,引起Ca2+内流,启动胞内信号级联反应,导致细胞骨架蛋白及D2-MSNs树突棘的形态与数量改变(陈平等,2017)。4周跑台运动干预通过上调纹状体mGluR2/3表达,下调纹状体MSNs膜上L-型电压门控钙通道Cav1.3亚基表达,降低了PD模型大鼠皮层-纹状体Glu过度释放介导的兴奋性毒作用(Chen et al.,2017)。内源性大麻素系统(endocannabinoid system,eCBs)介导的长时程抑制(eCB-LTD)是皮层-纹状体突触可塑性的主要表现形式之一(Kluger et al.,2015),eCB-LTD仅特异性存在于D2-MSNs且受D2R调控(Lerner et al.,2012)。PD病理状态下纹状体D2-MSNs膜上D2R功能受损,引起下游G蛋白信号转导调节子 4(regulator of G-protein signaling 4,RGS4)功能异常,从而抑制eCB配体合成,最终使eCB-LTD现象减弱或消失(Trusel et al.,2015)。4周跑台运动通过上调纹状体RGS4活性促进eCB配体(AEA/2-AG)合成,恢复皮层-纹状体eCB-LTD突触可塑性,调节突触前Glu释放水平,降低Glu的兴奋性毒作用,这也是运动选择性降低纹状体D2-MSNs树突棘丢失的又一因素(林湘明等,2017)。
4 结论
PD模型大鼠纹状体D2-MSNs树突棘丢失,跑台运动干预可选择性降低PD模型大鼠纹状体D2-MSNs树突棘丢失。运动通过上调突触连接蛋白表达促进PD模型大鼠纹状体MSNs形态结构重塑。纹状体MSNs树突棘发生运动依赖可塑性变化为PD模型大鼠运动功能障碍的改善提供了必要的解剖学基础。

