丙三醇对螺旋霉素I 发酵的影响及机理分析
梁培培, 高淑红, 姚开亚, 孙玲玲, 张志勇, 赖 珅
(1. 华东理工大学生物反应器工程国家重点实验室,上海 200237;2. 天方药业有限公司,河南 驻马店 463000)
螺旋霉素(Spiramycin)是一种16 元大环内酯类抗生素,是法国实验室Rhone-Poulenc 于1954 年从生二素链霉菌(Streptomyces ambofaciens)的代谢产物中分离所得[1]。螺旋霉素的化学结构主要由一个16 元内酯环及所连接的两个氨基糖福洛氨糖(Forosamine)、碳霉氨糖(Mycaminose)和一个中性糖碳霉糖(Mycarose)组成[2]。螺旋霉素通过将内酯环结合到细菌核糖体的大亚基上,在空间上阻断细菌新生肽链的延伸,从而达到抑菌效果。因其较强的抗菌活性及持续的抗生素后效性,已被广泛应用于临床感染性疾病的治疗[3-5]。依据C-3 位原子的酰化程度不同,又可将螺旋霉素分为未被酰化的螺旋霉素Ⅰ,乙酰化的螺旋霉素Ⅱ和丙酰化的螺旋霉素Ⅲ[6]。其中螺旋霉素I 生物效价较高,约是螺旋霉素II、III 的1.8 倍和1.4 倍[7]。
生二素链霉菌发酵产生螺旋霉素的发酵液中,产物以螺旋霉素I 为主,并有少量螺旋霉素II、III。除此之外,螺旋霉素发酵液中容易积累多种杂质组分,如杂质F(4'''-N-demethyl spiramycin I dipolymer),杂质A(Neospiramycin),杂质B(Spiramycin Ⅳ),杂质D(Spiramycin V)等,这些组分生物效价不高,且有一定的毒副作用,不仅影响提取收率,还降低了螺旋霉素的产量和品质[8-9]。因此降低杂质组分含量,也成为螺旋霉素生产中的重要指标。
螺旋霉素的合成以短链脂肪酸酰基辅酶A 为前体,在Ⅰ型聚酮合酶的催化作用下形成内酯环,内酯环经一系列后修饰步骤,最终形成具有抗菌活性的螺旋霉素分子,其中内酯环的形成被认为是主要的限制性因素[10-11]。发酵液中含量最高的杂质组分是D,其结构是螺旋霉素C-9 位上的福洛氨糖被碳霉糖取代[12]。对螺旋霉素生物合成基因簇的研究表明,与糖基合成相关的基因srm20 和srm33 是分别参与福洛氨糖和碳霉糖合成途径中的重要基因,分别编码氨基转移酶和甲基转移酶[13-14]。
为改善螺旋霉素的发酵水平,研究人员在前体添加和发酵工艺优化方面均进行了大量研究。其中朱凤、武培等[15-16]在发酵前期分别添加吐温-85 和金属离子Zn2+,促进了菌体代谢,增加了细胞膜的通透性,为螺旋霉素的合成提供了更多的前体物质,促使发酵效价分别提高了11.9%和17%左右,从前体物质增加的角度诠释了发酵效价提高的原因。Li 等[17]在发酵初期添加Al3+,增加前体物质的同时还提高了与内酯环合成有关的乙酰CoA 合成酶、乙酸激酶及乙酰磷酸转移酶等的活性,使螺旋霉素效价提高了19.51%。罗俊等[18]在发酵过程中添加氯化胆碱,增加乙酸等前体物质的浓度,增大了三羧酸循环(TCA)循环的通量,使发酵效价提高了15%左右,氯化胆碱作为甲基化试剂在提高效价的同时也显著降低了杂质F 的含量。胡蓉等[19]在发酵过程中添加丙三醇,增强了糖酵解途径EMP 途径和TCA 循环的代谢流,促进细胞的初级代谢,提高了螺旋霉素的生产速率和产量。上述文献从多个方面对螺旋霉素发酵工艺进行了优化,但并未从分子层面深入了解螺旋霉素产量提高及杂质含量降低的原因。Fondi 等[20]通过代谢建模研究发现,过表达srm4 基因能够增强CoA 代谢途径的碳流量,进而显著提高螺旋霉素的生产力。Yao 等[12]尝试从基因转录层面研究了不同糊精对生二素链霉菌发酵的影响,解释了螺旋霉素产量提高及杂质组分降低的原因。
本文研究不同发酵阶段添加丙三醇对螺旋霉素Ⅰ发酵的影响,优化其最佳添加时间和添加浓度,并进一步通过荧光定量PCR(Polymerase Chain Reaction)技术,从基因转录水平,研究与螺旋霉素I 发酵产量提高、杂质D 组分含量降低相关的原因。
1 材料与方法
1.1 材料和试剂
生二素链霉菌(Streptomyces ambofaciens),为本实验室贮存菌株;糊精、玉米浆、黄豆饼粉等来源于天方药业有限公司;氯化钠、氯化钾、磷酸二氢钾、硫酸镁、硫酸锌等常规试剂均为国产分析纯,乙腈、甲醇为色谱级。RNA 抽提试剂盒购自TIANGEN 生物科技有限公司,PrimeScript RT reagent Kit With gDNA Eraser 试剂盒购自日本TaKaRa 公司,SYBR Premix Ex TaqTMGC 试剂盒购自日本TaKaRa 公司。
1.2 仪器和设备
高效液相色谱仪Agil ent Technologies 1260 Infinity(安捷伦科技有限公司);15 L 发酵罐BSW-A(上海国强生物工程设备有限公司);摇床SPH-3222(上海世平实验设备有限公司);小型高速冷冻离心机Centrifuge5415-R(德国Eppendorf 公司);实时荧光定量PCR 仪CFX96(美国Bio-Rad 公司)。
1.3 培养基组分
一级种子培养基(g/L):糊精45,黄豆饼粉15,玉米浆10,碳酸钙5,pH 7.0。
二级种子培养基(g/L):糊精40,黄豆饼粉8,酵母粉5,硫酸铵2,氯化钠3,磷酸二氢钾1,玉米浆12,碳酸钙5,豆油20,pH 7.0。
摇瓶发酵培养基(g/L):糊精65,黄豆饼粉5,酵母粉5,硫酸铵4,氯化钠15,磷酸二氢钾4,硫酸镁1,硫酸锌0.1,玉米浆3,氯化钴0.003,碳酸钙10,豆油20,pH 7.0。
15 L 发酵罐培养基(g/L):糊精50,葡萄糖12,酵母粉2.5,硫酸铵2,磷酸二氢钾4,氯化钠3,硫酸锌1,硫酸镁1,氯化钴0.3,玉米浆20,碳酸钙14,豆油20,泡敌0.2,pH 7.0。
1.4 实验方法
摇瓶培养:将1 mL 冷冻保藏的种子液接种于装有30 mL 一级种子培养基的250 mL 三角瓶中,在转速220 r/min,温度(28.0±0.5) ℃下培养48 h。然后将一级种子液按6%接种量接入装有25 mL 发酵培养基的250 mL 三角瓶中摇瓶中,在转速220 r/min,温度(27.0±0.5) ℃下培养6 d。
15 L 发酵罐培养:将一级种子液按6%的接种量转接到装有60 mL 二级种子培养基的500 mL 三角瓶中,在转速220 r/min,温度(28.0±0.5) ℃下培养26 h。然后将二级种子液按照6%接种量接入15 L 发酵罐中,培养基装液量10 L,培养温度26.5 ℃,发酵6~7 d,并根据发酵过程中的参数变化调整转速和补料。
运用高效液相色谱(HPLC)法测定螺旋霉素效价与杂质含量:取发酵液1 mL,在转速12 000 r/min下离心10 min,取上清液用流动相进行稀释,经0.22 μm的滤膜过滤后进样。
色谱柱及测试条件:ZORBAX SB-C8 色谱柱(安捷伦科技有限公司,250 mm×4.6 mm×5 μm),流动相为9.3 g/L 高氯酸钠磷酸盐缓冲液和乙腈,高氯酸钠磷酸盐缓冲液和乙腈的体积比为7∶3;流速1 mL/min,柱温30 ℃,检测波长232 nm,进样量20 μL。外标法测定螺旋霉素Ⅰ效价。杂质D 质量分数为杂质峰面积除以螺旋霉素Ⅰ、Ⅱ、Ⅲ峰面积与杂质A、B、F、D 峰面积之和。
总RNA 提取、反转录及荧光定量PCR 反应:采取液氮研磨的方法获得总RNA,然后42 ℃水浴2 min将样品中的基因组DNA 去除,最后在37 ℃反应15 min,85 ℃加热5 s 终止反应,得到cDNA,并于-20 ℃保存。最后进行荧光定量PCR 反应,95 ℃预变性30 s,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共40 个循环。本实验以2-ΔΔCt法来考察基因的转录水平差异。
2 结果与分析
2.1 丙三醇添加时间与添加浓度的优化
螺旋霉素Ⅰ主要化学结构及化学组成分别如图1和表1 所示。本实验选择在摇瓶发酵0、24、48、72、96、120 h 这6 个时间点进行添加,添加体积分数均为0.55%。图2 示出了丙三醇添加时间及添加体积分数对螺旋霉素Ⅰ合成的影响(以CK 为对照组)。由图2 可知,添加时间为24 h 时,螺旋霉素I 效价比对照组显著提高10.87%(p<0.05),添加时间为0 时,螺旋霉素I 效价显著降低24.51%(p<0.01),其余时间点添加效果不显著。由上述发酵结果可知,丙三醇的最佳添加时间是24 h。
实验进一步选择丙三醇体积分数分别为0.2%、0.4%、0.55%、0.7%、0.9%和1.2%,添加时间均为摇瓶发酵24 h,研究其添加体积分数对螺旋霉素I 发酵的影响。由图2 可知,丙三醇最终体积分数为0.4%时,螺旋霉素I 效价显著提高17.12%(p<0.01),其他浓度添加效果不显著。
摇瓶发酵24 h 时添加最终体积分数为0.4%的丙三醇,提高了螺旋霉素I 效价,而螺旋霉素Ⅱ和螺旋霉素Ⅲ含量变化不显著(图略),同时杂质组分含量也有一定程度的降低(图3),其中杂质D 质量分数显著降低21.39%(p<0.01),其余3 种杂质的质量分数变化不大,因此后续主要研究杂质D 的质量分数的变化。
2.2 15 L 发酵罐放大实验
实验进一步在15 L 发酵罐中研究添加丙三醇对发酵过程的影响,与摇瓶相比,发酵罐的供氧条件较好,营养物质供应更为充足,菌体在发酵罐中生长更快,产素期提前。实验选择12、15、18、24 h 这4 个时间点一次性补入最终体积分数为0.4%的丙三醇溶液,实验结果如图4 所示。
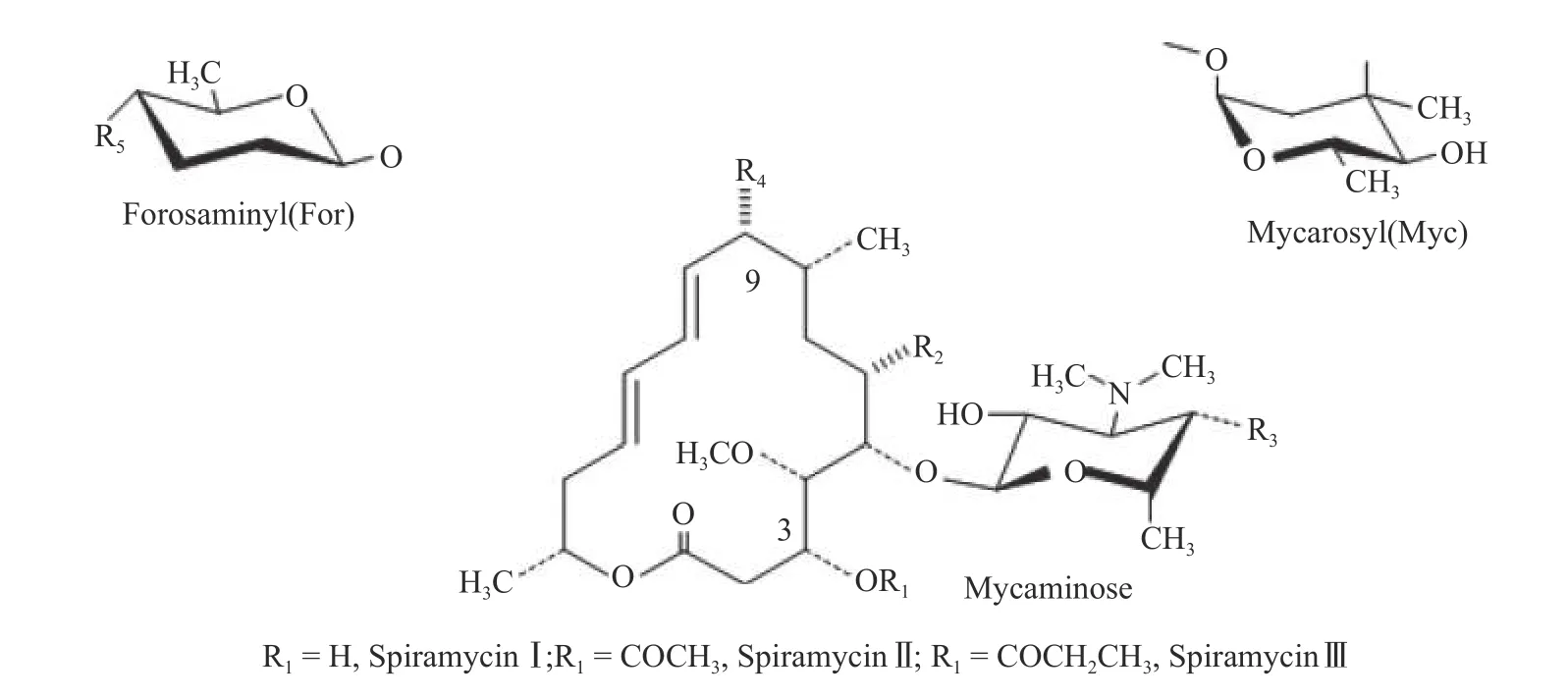
图 1 螺旋霉素的主要化学结构Fig. 1 Main chemical structure of spiramycin
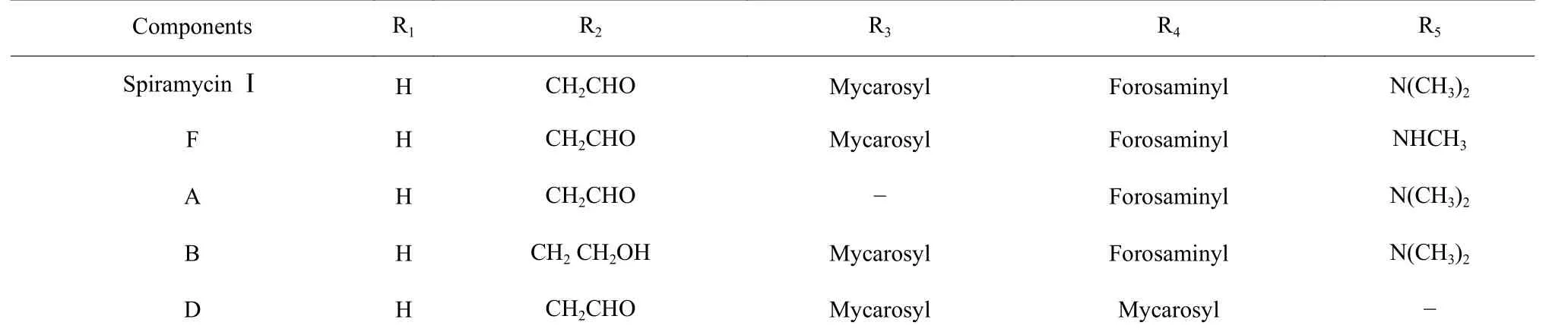
表 1 螺旋霉素的主要化学组成Table 1 Main chemical formula of spiramycin

图 2 丙三醇添加时间及添加体积分数对螺旋霉素I 合成的影响Fig. 2 Influences of the adding time and adding volume fraction of glycerol on the synthesis of spiramycinⅠ
由图4 可知,在上述4 个时间点添加丙三醇对螺旋霉素I 的合成均有一定的促进作用,其中15 h 添加促进效果最显著(p<0.01)。根据发酵结果,实验选择在分酵15 h 向15 L 发酵罐中添加最终体积分数为0.4%的丙三醇溶液作为最优添加条件。
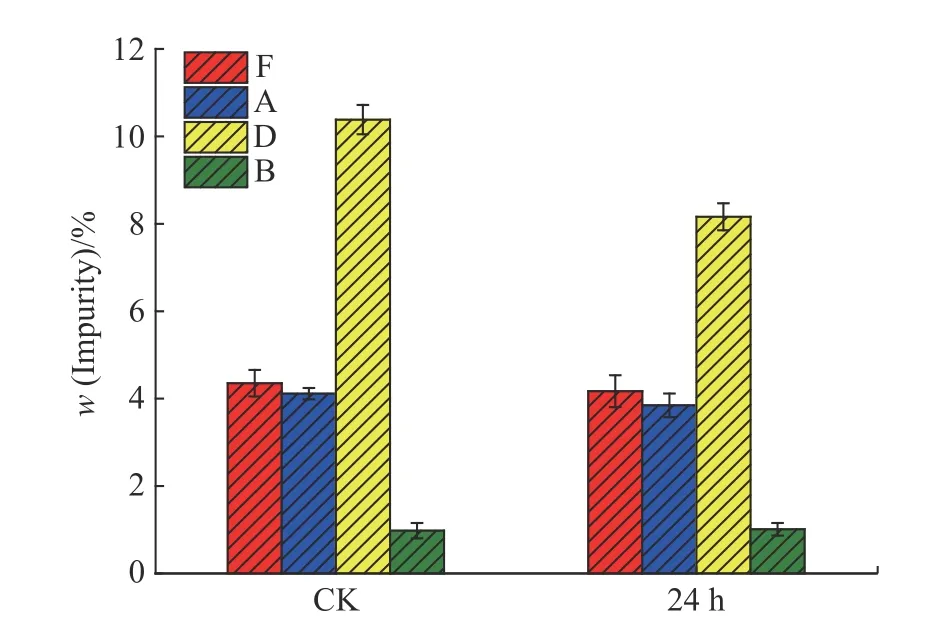
图 3 优化丙三醇添加时间和添加体积分数下杂质含量的变化Fig. 3 Change of impurity content at the optimal adding time and adding volume fraction of glycerol
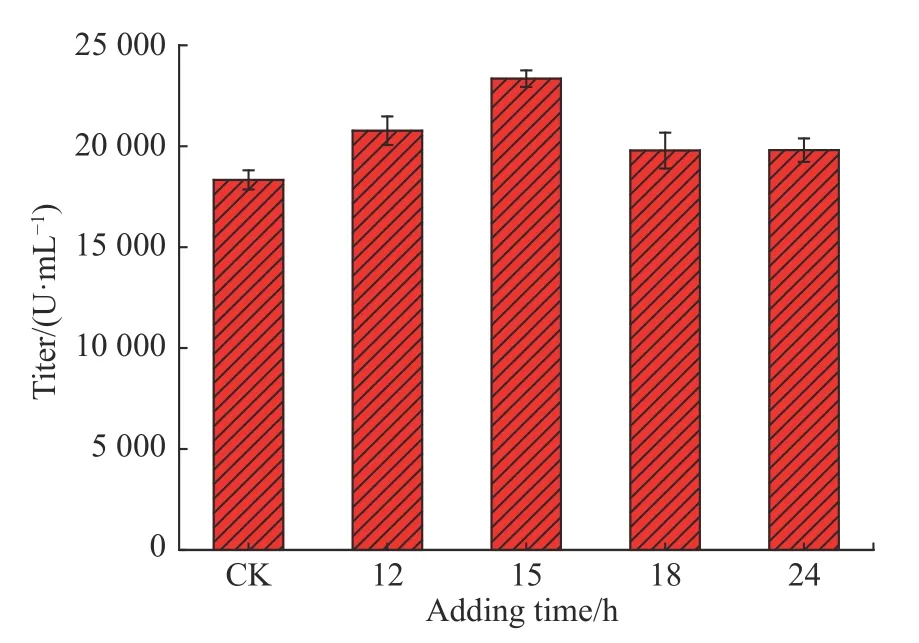
图 4 丙三醇添加时间对螺旋霉素Ⅰ合成的影响Fig. 4 Influence of glycerol adding time on the synthesis of spiramycin Ⅰ
未添加丙三醇的对照罐与15 h 添加最终体积分数为0.4%的丙三醇溶液的条件罐的发酵过程中效价和杂质D 的变化如图5 所示,可以看出,添加丙三醇罐螺旋霉素 I 起始效价高于未添加罐,并在整个发酵过程中保持较高的增长趋势,发酵结束时,添加丙三醇罐的螺旋霉素 I 最终效价(23 314 U/mL)相比未添加罐(18 329 U/mL)显著提高27.20%(p<0.01)。
添加丙三醇罐的杂质D 的质量分数在整个发酵过程中都不高于未添加罐,尤其120 h 以后,前者杂质D 质量分数的增长趋势明显低于后者,发酵结束时,前者杂质D 的质量分数(8.84%)与后者(11.99%)相比显著降低26.27%(p<0.01)。同时还测定了螺旋霉素Ⅱ和螺旋霉素Ⅲ的质量分数,结果如图6 所示,发酵过程中添加丙三醇罐二者质量分数比未添加罐稍低,发酵结束时两罐二者质量分数基本一致。
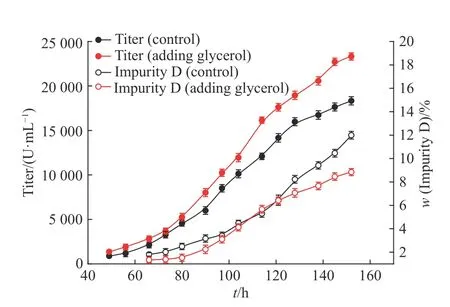
图 5 效价和杂质D 的变化趋势Fig. 5 Tendency of the titer and impurity D

图 6 螺旋霉素Ⅱ和螺旋霉素Ⅲ的变化趋势Fig. 6 Tendency of the spiramycin Ⅱ and spiramycin Ⅲ
2.3 添加丙三醇对螺旋霉素I 合成相关基因转录水平的影响
为从基因层面探究螺旋霉素I 内酯环合成、两种糖苷配基的合成与杂质D 组分合成之间的关系,实验以链霉菌初级sigma 因子编码基因hrdB 为参比,对螺旋霉素发酵过程中相关基因srm10(内酯环合成相关基因),srm20和srm33 转录水平进行了检测。
在螺旋霉素I 的生物合成过程中,限制性因素内酯环的合成通常在Ⅰ型聚酮合酶的催化作用下完成。图7 示出了发酵15 h 时添加最终体积分数为0.4%的丙三醇溶液的条件罐相对于未添加丙三醇的对照罐,srm10,srm20 和srm33 基因的相对转录结果。由图可知,发酵48 h 时,添加丙三醇后srm10 基因的转录水平是未添加罐基因转录水平的近3 倍,说明添加丙三醇能有效促进发酵早期srm10 基因的转录,发酵72 h 后两罐基因转录水平相当,说明72 h以后srm10 基因的转录水平变化不大。另外,添加丙三醇能显著提高发酵72 h 时srm20 与srm33 基因的转录水平(p<0.01);添加丙三醇对其他时间点的srm20 与srm33 基因转录无显著作用。
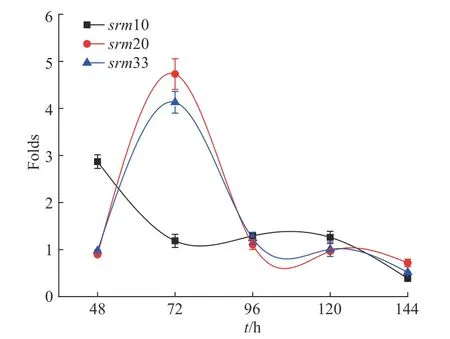
图 7 srm10,srm20 和srm33 基因相对转录结果Fig. 7 Relative transcription of genes srm10, srm20 and srm33
Karray 等[14]研究发现,螺旋霉素合成相关基因srm10、srm20 与srm33 有相似的转录模式,发酵36 h转录水平升高,之后转录水平下降。发酵生成螺旋霉素的过程是从40~48 h 以后开始持续合成至72 h。我们的实验结果显示,srm10 基因在48 h 大量转录,而与糖基合成的相关基因srm20 和srm33 在72 h左右达到峰值,说明在螺旋霉素合成过程中大环合成基因以及糖基合成基因存在时序变化,内酯环合成后连接糖基形成完整的螺旋霉素分子。
杂质D 与螺旋霉素I 结构上的差异在于C-9 位的糖苷配基由福洛氨糖错配成碳霉糖,当碳霉糖的相对合成增加或者福洛氨糖的相对合成减少,都会导致杂质D 的增加[12]。从srm20 和srm33 基因转录的时序变化来看,添加丙三醇对72 h 时srm20 的促进作用更大,猜测福洛氨糖合成相关基因的转录促进了福洛氨糖的合成,从而使得较多福洛氨糖连接在母环上,减少了螺旋霉素杂质D 的合成。
3 讨 论
为研究丙三醇的添加工艺,添加最终体积分数为0.4%的丙三醇摇瓶发酵24 h 能够有效促进螺旋霉素I 的合成,效价达到20 982 U/mL,与对照值(17 915 U/mL)相比提高了17.12%,杂质D 的质量分数 为 8.16%, 与 对 照 值 (10.38%)相 比 降 低 了21.39%。在15 L 发酵罐中进行放大实验,15 h 左右向罐中添加最终体积分数为0.4%的丙三醇溶液,发酵结束时,螺旋霉素I 最终效价达到23 314 U/mL,相比对照(18 329 U/mL)提高27.20%,最终杂质D 含量为8.84%,与对照(11.99%)相比降低了26.27%。
选择与螺旋霉素生物合成相关的基因进行转录水平的研究,实验选取与内酯环合成相关的基因srm10,福洛氨糖合成通路上的基因srm20 以及碳霉糖合成通路上的基因srm33[13-14]。结果显示,添加丙三醇罐的srm10 基因在48 h 转录水平明显高于未添加罐,同时srm20 与srm33 基因在72 h 转录水平明显高于未添加罐。
螺旋霉素生物合成过程中,限制性因素内酯环的合成需要诸多前体物质在众多酶的催化下产生。其中短链脂肪酸可作为前体物质在CoA 合成酶及与酰基磷酸转移酶耦联的酰基激酶两种酶系催化作用下可转化成内酯环合成所需的直接前体物质CoA[21]。胡蓉等[18]研究发现,丙三醇有利于乙酸和丙酸等前体物质的积累,从而提高了螺旋霉素效价。Khaoua 等[21]研究发现,短链脂肪酸能够诱导酰基激酶和酰基磷酸转移酶的合成,进而提高螺旋霉素产量。Ⅰ型聚酮合酶体系是螺旋霉素内酯环生物合成过程中最为重要的组成部分,已活化的酰基单元在其催化下聚合成内酯环[10]。Ⅰ型聚酮合酶基因簇由5 个亚单元组成,srm10 基因作为其中一个亚单元,其转录水平的高低与内酯环的合成密切相关[14]。猜测丙三醇的添加,促进了乙酸、丙酸等短链脂肪酸的积累,从而诱导了酰基激酶和酰基磷酸转移酶的合成,提高了短链脂肪酸转化成酰基CoA 的效率,为螺旋霉素合成提供更多的直接前体物质,同时丙三醇的添加提高了发酵前期Ⅰ型聚酮合酶亚单元合成基因srm10 的转录水平,对酰基单元缩合成聚酮类内酯环起促进作用,从而增加内酯环的合成。
螺旋霉素内酯环本身没有抑菌活性,已合成的内酯环还需在酶的催化作用下进行一系列的后修饰步骤才能形成具有抑菌活性的螺旋霉素分子,其中糖基是活化内酯环的关键基团,在抑菌方面发挥重要作用[22]。后修饰过程中,糖基的错配和缺失都会导致相关杂质的产生。其中杂质D 的产生与福洛氨糖和碳霉糖的不均一合成有关,当C-9 位的福洛氨糖被碳霉糖取代后形成杂质D[12]。srm20 和srm33 分别是福洛氨糖和碳霉糖合成途径上的基因,对两种糖基的合成起重要作用[13-14]。实验结果显示,添加丙三醇能使得发酵72 h 左右的srm20 和srm33 基因的转录水平大幅提高,且对srm20 的促进作用更大,进而促进了福洛氨糖对碳霉糖相对合成比例的增加,导致杂质D 组分的含量下降。上述实验结果为今后杂质D 组分含量的进一步降低提供了新的思路,万俊仙等[23]已通过过表达半胱氨酸合成途径中两个限速酶基因,提高了细胞内半胱氨酸水平。我们可以通过基因工程改造的办法提高srm20 基因表达,或降低srm33 的基因表达,降低杂质D 含量,提高螺旋霉素I 的品质。

