天然高分子材料水凝胶在伤口敷料中的应用
鲁手涛 ,周扬,徐海荣,刘黎明,曹文瑞,张兴燎,张军,张海军,3
(1.同济大学医学院,上海 200092; 2.生物医用材料改性技术国家地方联合工程实验室,山东德州 251100;3.同济大学医学院介入血管研究所,上海 200072)
随着社会发展和临床流行病学研究的精进和科学技术的进步,人们对伤口护理的重视程度逐渐增强,伤口护理已经成为临床护理工作的重要组成部分。伤口护理需要促进伤口快速愈合的敷料,以获得功能和美容效果。用于伤口护理的产品有很多种,例如吻合器、缝合线、敷料、绷带、手术密封剂或粘合剂、皮肤替代品和其它生物材料[1]。
人体皮肤是机体与外环境的主要屏障,能够防止微生物渗透和感染。然而,一旦在该屏障中形成伤口,就容易受到外来微生物的感染。伤口敷料是用于伤口的辅助物,以促进愈合并防止感染和进一步损伤[2-3]。
与人体内的所有其它组织相比,人体皮肤具有强大的自我再生能力。它不断用新的细胞取代旧细胞,使其能够自我修复。伤口愈合是一个复杂的生理过程,由3 个重叠阶段组成:炎症阶段,增殖阶段和重塑阶段。愈合过程在组织受损时便开始了,当血液成分来到损伤部位时,血小板与胶原和细胞外基质接触并释放凝血和生长因子。在炎症阶段,中性粒细胞是第一个出现在损伤部位的白细胞,以消除细菌污染。增殖阶段,单核细胞及其向巨噬细胞转化时,通过释放多种生物活性物质和生长因子来启动组织修复,所述生物活性物质和生长因子是开始形成组织所必需的。在第三阶段,成纤维细胞增殖并迁移至伤口部位并开始进行松散的细胞外基质沉积。内皮细胞与成纤维细胞在伤口处生长,同时形成血管。最后,通过分化角质形成细胞以及形成卵泡细胞,发生组织重塑以重建基膜[4]。
疤痕一般形成于伤口愈合过程中,当皮肤的皮下组织受损时,身体会沉积胶原纤维覆盖受损部位,这会产生明显的疤痕,因此,需要能够诱导无瘢痕愈合的敷料[5]。
传统的干燥伤口敷料被认为有利于愈合伤口,即伤口用纱布覆盖或保持开放。但是,现代研究表明[6],当伤口在没有任何敷料的情况下向空气敞开时,结痂即干燥层,覆盖伤口并降低上皮形成的速率。另一方面,如果使用湿敷料代替干敷料,则不会形成结痂,并且随着湿敷料提供低氧张力,愈合速度将增加,这有助于伤口愈合。这些敷料不仅可以使细胞保持活力,使其释放生长因子,同时保持细胞与愈合组织之间的接触,调节或刺激它们的增殖。这些敷料可减少休息、走路和换药期间的疼痛。同时,湿润环境可以快速有效地递送任何添加的抗菌剂,从而防止伤口被感染。现在认为产生和维持湿润环境的敷料为伤口愈合提供了最佳条件[7]。
1 理想伤口敷料的特征
理想的伤口敷料应该具备以下特征:①敷料应保持伤口部位的湿润,因为表面干燥不仅阻碍营养物的递送和伤口表面的免疫防御,而且还显著阻碍细胞在伤口表面上迁移的能力。上皮细胞的迁移和扩散需要湿润环境,在湿润环境下,细胞可以加速生长、分化和迁移,优化形成新的组织。保持伤口湿润可以防止形成结痂,使上皮细胞通过伤口渗出物水平向外扩散以快速闭合伤口。此外,在湿润环境中,伤口愈合(上皮形成和皮肤修复)的速度提高50%。②敷料应无毒且无过敏性,以免在伤口部位引起感染。③敷料应可以无痛去除,即它可以被移除而不会对伤口造成创伤。④敷料应能够阻菌,隔热和触摸柔软。⑤敷料应允许适当的气体和水蒸气交换。⑥敷料应能促进组织重建过程。⑦敷料的价格不能太昂贵[4]。
在所有敷料中,水胶体、藻酸盐和水凝胶,每种都有各自的优点和局限性,水凝胶具有理想伤口敷料所需的所有特征,是伤口敷料的最佳选择。
2 天然水凝胶的分类
水凝胶是一种新型功能高分子材料,具有亲水基团,是能被水溶胀但不溶于水的具有三维网络结构的聚合物。它性质柔软,能保持一定的形状,能吸收大量的水[8]。按其来源可分为天然和合成两大类。合成水凝胶包括聚丙烯酸、聚丙烯酸盐、聚丙烯酰胺类及其衍生物、聚氧化乙烯及其衍生共聚物、聚乙烯醇、聚磷腈和多肽等。天然水凝胶包括胶原蛋白、海藻酸盐、甲壳素和壳聚糖、透明质酸盐、明胶和纤维素等。很多天然水凝胶是人体组织器官的重要成分,如胶原广泛存在于骨骼肌及结缔组织中,血液中含有大量的纤维蛋白。天然高分子材料因其生物相容性较好,是制备水凝胶的首选高分子材料。
2. 1 胶原蛋白
胶原蛋白作为一种现代生物材料的使用始于1881 年[9]。在那一年,创立现代外科手术的Joseph Lister 和他的学生William Macewen 报道了一种可生物降解的缝合线,由绵羊小肠制备的一种富含胶原蛋白的生物材料。在大多数结缔组织中,胶原纤维及其网络构成了大部分细胞外基质(ECM)并形成围绕细胞的高度有序的三维(3D)支架。胶原蛋白在维持ECM 的生物学和结构完整性方面也起着主导作用,另外它是一种灵活的材料,通过不断重塑以改善细胞行为和组织功能[10]。
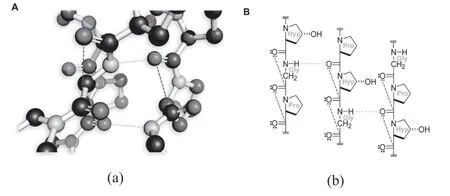
图1 三螺旋胶原蛋白的三维及结构图
S. Udhayakumar 等[11]开发了基于牛胶原蛋白的伤口敷料,该敷料具有良好的铺展性和稳定性,对革兰氏阳性和阴性细菌均具有抗菌活性。敷料具有良好的细胞相容性,并为细胞的附着、迁移和增殖提供了有利的环境。在全层开放切除伤口上验证了促进伤口愈合的功效,愈合曲线显示出增强的再上皮化,胶原沉积和伤口收缩,且伤口未形成纤维性瘢痕。O. Akturk 等[12]制备了一种新型胶原/金纳米粒子复合材料作为潜在的皮肤伤口愈合敷料,它可以抑制炎症反应,同时促进肉芽组织的形成,提高了伤口闭合的比例,14 d 后胶原/金纳米粒子复合材料处理的皮肤显示出较高的拉伸强度和拉伸弹性模量,表明皮肤愈合的过程更快。L.O’Neill等[13]用等离子体处理雾化的胶原蛋白溶液,将等离子体处理的胶原蛋白涂层成功地应用于伤口,该方法处理的胶原没有产生额外的炎症反应,并且还促进了血管生成,在第7 天观察到血管表面密度显著提高,促进了伤口愈合。Liu Ting等[14]制备了一种用石墨烯氧化物改性的胶原—壳聚糖复合膜,石墨烯氧化物提高了材料的热稳定性、力学性能及亲水性,复合膜生物相容性好,其还可以作为生长因子的释放载体,持续释放超过28 d,加速了伤口愈合的速度。
2. 2 海藻酸盐
海藻酸盐是一种天然存在的阴离子生物聚合物,由棕色海藻中提取,具有很好的吸湿性能、抗菌性能和生物相容性。海藻酸盐由1,4 键合的β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)残基组成,其结构图如图2 所示。
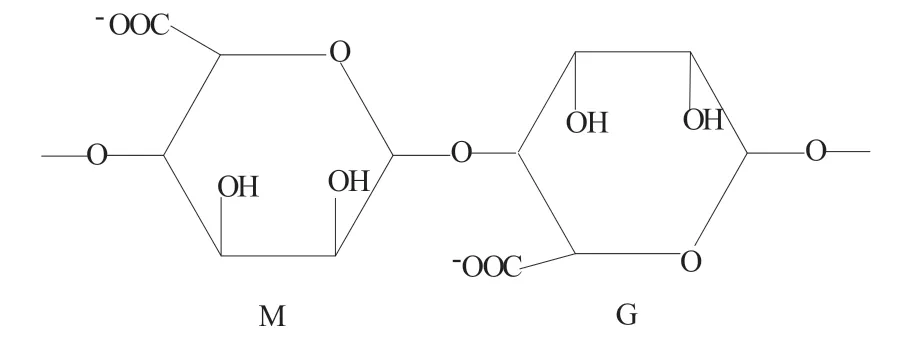
图2 D-甘露糖醛酸(M)和α-L-古洛糖醛酸(M)残基结构图
不同的比例和M 与G 残基的序列,决定了海藻酸盐的物理性质和分子量[15]。
Wang Tao 等[16]研究了海藻酸钙对糖尿病皮肤溃疡的作用机制,在糖尿病大鼠模型背面伤口上施用海藻酸钙敷料,通过蛋白质印迹评估胶原(I 型和III 型),并在创伤后3 d,7 d 和14 d 测定羟脯氨酸水平变化,通过增加伤口收缩,减轻炎症反应和增加I 型胶原和羟脯氨酸水平,加速伤口愈合过程,从而显著增加伤口的拉伸强度。M. Straccia 等[17]制备了由壳聚糖盐酸盐涂覆的海藻酸盐水凝胶,赋予水凝胶抗菌活性并延迟亲水性分子从海藻酸盐基质中的释放,并且细胞毒性测试表明不会引起间充质基质细胞的急性毒性作用。Zhou Qian 等[18]制备了新型二价离子交联海藻酸钠水凝胶(铜,锌,锶和钙),铜离子交联表现出最大的断裂强度,而锶和锌离子交联的水凝胶表现出优异的力学性能,锌离子交联水凝胶对金黄色葡萄球菌和大肠杆菌具有显著的抗菌能力,在皮肤再生过程中,从网络结构释放的离子刺激血管生成并促进毛细血管内皮细胞向伤口中心的迁移,离子交联水凝胶可以加速伤口修复,特别是锌和锶的交联水凝胶。
2. 3 甲壳素和壳聚糖
甲壳素是最丰富的天然氨基多糖(聚-N-乙酰基-葡糖胺),它是无脊椎动物,甲壳类动物和昆虫外骨骼以及真菌细胞壁的主要成分。壳聚糖是甲壳素的脱乙酰产物聚-N-乙酰基-葡糖胺聚糖,通过用氢氧化钠处理虾和其它甲壳类壳来获得。它由随机分布的β-(1 →4)-d-葡糖胺和N-乙酰基-d-葡糖胺组成。通过制备了甲壳素和壳聚糖的不同制剂可以获得止血、抗菌、抗炎和伤口愈合等性能[19]。
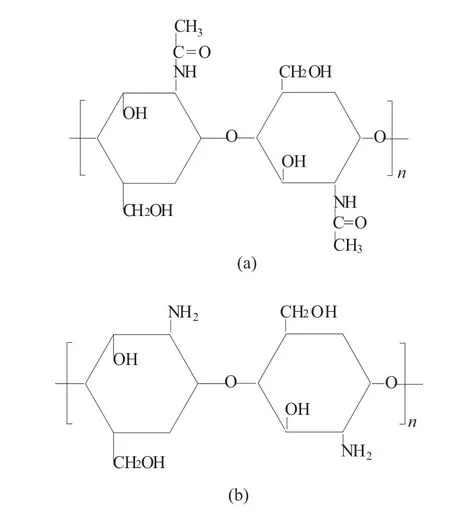
图3 甲壳素和壳聚糖的结构图
P. S. Patil 等[20]使用全氟碳改性壳聚糖构建用于治疗皮肤伤口的水凝胶敷料,该水凝胶显示出显著的氧运输速率,比非氟化水凝胶高出两个数量级,组织学分析显示改性水凝胶改善再上皮化和胶原合成,促进了羟脯氨酸和胶原合成的再生代谢过程,该研究的结果证实,改性水凝胶增加的氧输送增强了伤口愈合,代谢组学分析提供了评估伤口愈合生理学的有力工具。Zhao Xin 等[21]开发了一系列基于季铵化壳聚糖-g-聚苯胺和苯甲醛基官能化聚(乙二醇)-co-聚(甘油癸二酸酯)的抗菌、抗氧化的可注射导电自愈合水凝胶,可注射水凝胶敷料具有优异的抗菌活性,电活性和自由基清除能力,通过上调与伤口愈合相关的血管内皮生长因子(VEGF)、表皮生长因子(EGF)和转化生长因子-β(TGF-b)等主要生长因子,极大地促进了ECM 合成,增加胶原沉积和肉芽组织厚度,有利于促进伤口愈合过程。Xia Guixue 等[22]使用甲壳素晶须(CWs)改善羧甲基壳聚糖纳米粒子/热敏羟丁基壳聚糖复合水凝胶,发现CWs 提高水凝胶的刚度,储能模量提高了2.6 倍,离体大鼠皮肤试验也显示了力学性能显著改善,糖尿病大鼠的体内慢性伤口愈合评估显示该敷料导致更快的伤口愈合,并且还表现出优异的再上皮化,致密的胶原沉积和血管生成特性。H. S. Jung 等[23]通过静电纺丝制备了纳米纤维β-甲壳素膜,由墨鱼骨中提取了β-甲壳素,与聚(环氧乙烷)(PEO)混合显著提高了材料的电纺丝性。混合β-甲壳素/PEO 纳米纤维的纤维直径约400 nm,浸泡在水中除去PEO 后直径减小。组织病理学分析证实了再上皮化和胶原沉积的加速作用,β-甲壳素膜显示出比β-甲壳素/PEO 更好的伤口愈合。
2. 4 以透明质酸为基础的水凝胶
透明质酸(HA)首先由Karl Meyer 于1934 年从牛眼的玻璃体液中纯化,他将该分子命名为“透明质酸”。在20 世纪50 年代,Meyer 及其同事确定HA 是由重复的1,4-和1,3-键合的葡糖醛酸和N-乙酰基葡糖胺单元形成的线形多糖(图4)。
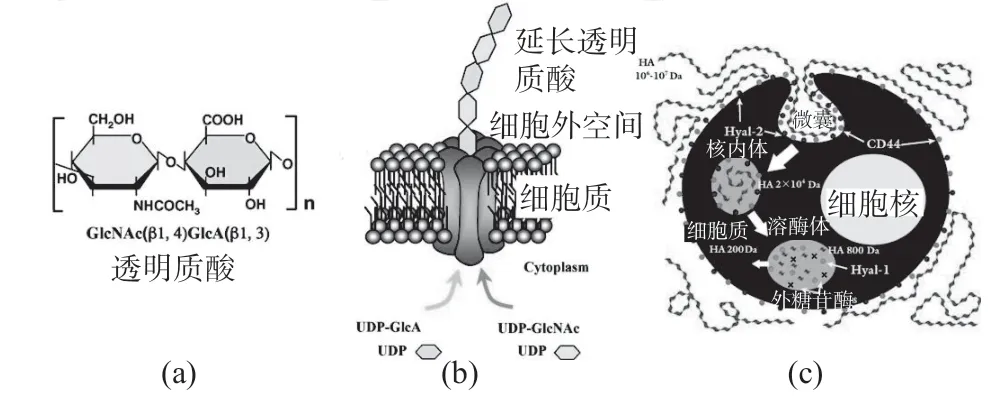
图4 HA 的化学结构、HA 生物合成和生物降解的示意图
HA 在所有脊椎动物组织的ECM 中普遍存在。尽管其具有简单的化学组成,但HA 具有几种不同的分子功能,这些功能不仅有助于组织的结构和生理特征,而且有助于在形态建成,组织重塑,炎症和疾病期间介导细胞行为。由于其独特的生物物理特性,HA 直接有助于维持组织稳态和生物力学。通过其与蛋白多糖和连接蛋白的相互作用,HA 组织并维持细胞外和细胞周围基质的结构完整性。作为信号分子,HA 与多种细胞表面受体和HA 结合蛋白相互作用,以激活细胞内事件介导细胞功能[24]。生物医学工程师正在创造一系列功能多样的基于HA 的水凝胶材料,用于组织再生等领域[25]。
Wang Chenggui 等[26]开发一种由改性HA、聚-ε-L-赖氨酸及泊洛沙姆F127 组成的可注射、自我修复和抗菌的多功能水凝胶,该水凝胶作为间充质干细胞外泌体释放的载体,用于促进慢性伤口愈合和完全皮肤再生。在体外,该水凝胶显著促进人脐静脉内皮细胞的增殖、迁移和管形成能力。在体内,该水凝胶显著增强糖尿病全层皮肤伤口的愈合效率,其特征在于伤口闭合率增加,快速血管生成,再上皮化和伤口部位内的胶原沉积。水凝胶处理的伤口中也出现皮肤附属物和较少的瘢痕组织,表明其有效实现了完全皮肤再生的能力。Y. Y. Hsu 等[27]制备了由HA 和明胶组成的负载人重组血栓调节蛋白(rhTM)的可生物降解水凝胶,具有在短期内缓慢释放rhTM 的特性,每3 天更换一次装载rhTM的水凝胶显著促进伤口愈合,增强了伤口修复中的肉芽组织形成以及再上皮化、胶原沉积和血管生成。开发的rhTM 水凝胶可以满足临床实践的需要,并且有望用于糖尿病患者的伤口护理。Lei Hong 等[28]制备了HA 和聚多糖交联的水凝胶,皮肤全层缺损动物模型中,水凝胶处理促进伤口人α 平滑肌肌动蛋白(α-SMA)的表达,其在术后最初几天缓解伤口炎症,并通过降低TGF-β1 水平减少瘢痕形成。并且,该水凝胶改善生长因子(VEGF)表达,通过新血管形成促进皮肤再生。
2. 5 其它类水凝胶
天然水凝胶原料来源广泛,除上述材料外,还包括明胶和纤维素等。明胶具有良好的生物相容性和生物降解性,其具有大量的细胞识别位点,吸附细胞能力强,能够促进细胞增殖。Wu Song 等[29]制备了明胶/HA 水凝胶,该水凝胶显示出适当的流体吸收能力和良好的水蒸气透过率和水蒸发速率,此外,明胶∶HA=8∶2 时,水凝胶具有促进细胞增殖的潜力。动物伤口模型证明水凝胶有效促进了伤口愈合。D. S. Yeon 等[30]开发了可喷雾的明胶基水凝胶作为伤口敷料材料,可以将细胞吸引趋化细胞因子传递到目标部位并诱导糖尿病伤口愈合。载有趋化因子的水凝胶促进细胞浸润到伤口区域,并促进伤口愈合,增强的再上皮化/新血管形成并增加了胶原蛋白沉积。
纤维素可用于慢性伤口敷料的愈合支架/基质,减少疼痛并缩短愈合时间。对于部分和全层皮肤缺损的伤口,它会刺激肉芽和上皮形成过程。S. P. Lin 等[31]制备了葡聚糖/细菌纤维素水凝胶,加入葡聚糖会影响细菌纤维素的网络结构,导致分解温度、含水量、拉伸强度及断裂伸长率降低,葡聚糖修饰的细菌纤维素水凝胶在增殖阶段促进成纤维细胞生长,并且还有助于重塑阶段的皮肤成熟,加速伤口愈合过程。M. Najwa 等[32]制备了含有人表皮角质形成细胞和人皮肤成纤维细胞的细菌纤维素/丙烯酸水凝胶,载有细胞的水凝胶促进了烧伤创面愈合,促进了胶原蛋白的沉积。
3 结语
在伤口敷料的研发中,水凝胶材料受到越来越多的关注,与生物体有相似结构的天然高分子材料水凝胶是目前最理想化的伤口敷料。然而,天然高分子材料存在力学性能差、功能化方面不足的缺点,针对这些问题,研究者们对天然高分子材料的水凝胶进行大量的改性研究,包括天然高分子材料的自身改性、天然高分子材料之间的复合改性,以及天然高分子材料和合成材料之间的复合改性等研究,取得了很大的进展,但要满足理想伤口敷料的要求,还需要进行大量的实验和探讨。随着高分子合成技术及材料认知的扩展和组织工程技术发展,有望获得理想的天然高分子材料水凝胶伤口敷料。

