运动诱导骨骼肌线粒体生物合成调控机制研究进展
赵永才 高炳宏
1 上海体育学院研究生部(上海200438)
2 上海体育学院体育教育训练学院(上海200438)
骨骼肌是能量代谢旺盛的器官,产生能量维持身体姿势和运动过程。骨骼肌细胞线粒体合成三磷酸腺苷(adenosine triphophate,ATP),不仅能维持人体的体力活动和竞技需要,还在调控身体整体稳态中起关键作用。骨骼肌线粒体对各类环境急性和慢性应激产生重塑变化,以维持细胞稳态,而线粒体生物合成效应加强是其对运动的常见应答表现[1]。线粒体生物合成不是一个从无到有的整体组装过程,而是组成线粒体的脂质、蛋白、线粒体DNA(mitochondrial DNA,mtDNA)等物质不断融汇到已有的线粒体中,实现线粒体物质增加,再通过线粒体分裂,实现数量上的增长[2]。无论是一次性运动,还是长期运动训练均可提高骨骼肌线粒体生物合成水平,有利于能量合成,关于这种应答表现已经形成共识。但目前对于运动诱导线粒体生物合成的机制探索还不够,前期运动科学领域研究更多的是关联性分析,各类调控因子在运动诱导线粒体生物合成中起何种作用,认识还不够清晰,近些年来相关基因敲除等技术涉及这类研究。本文检索相关文献,以“运动”、“训练”“体育活动”、“线粒体合成”、“线粒体生物合成”等为中文关键词;以“exercise”、“training”、“mi⁃tochondrial biogenesis”“mitochondrial synthesis”英文关键词,通过Pubmed、Cnki及万方等数据库检索文献,重点筛选基因敲除模型,分析线粒体调控因子在运动诱导线粒体生物合成(简称线粒体合成)中起到的作用,为运动干预骨骼肌能量代谢相关研究提供参考。
1 运动促进骨骼肌线粒体合成
线粒体合成需要一系列核基因和线粒体基因组双重转录,促进线粒体相关蛋白的合成,最终参与线粒体内膜复合物的组装[3]。调控核基因线粒体蛋白转录的因子有核呼吸因子1 和2(nuclear respiratory factor 1、2,NRF-1、2),它们能结合到相关核基因启动子上,促进基因转录,提高线粒体呼吸链蛋白的合成。NRF-1还能激活核基因,促进线粒体转录因子A(mitochondri⁃al transcription factor A,TFAM)的转录合成,有利于其转移至线粒体内,调节线粒体基因组转录。雌激素受体相关受体α、过氧化物酶体增殖剂激活受体也参与了线粒体脂肪酸氧化酶的核基因转录调节和线粒体合成[4]。目前认为调节线粒体合成,主要依赖于过氧化物酶体增殖物激活受体γ辅激活因子α(PGC-1α),PGC-1α在调节线粒体合成,维持骨骼肌线粒体网状结构中起不可替代的作用,PGC-1α对肌肉收缩诱发的线粒体合成比较敏感,与其它因子协同参与了运动促进线粒体合成的信号[5]。上世纪六十年代,Holloszy等[6]早期实验证明运动可以促进骨骼肌线粒体合成,跑台训练能有效提高大鼠骨骼肌线粒体抗氧化酶活性和呼吸能力,促进线粒体蛋白的合成。目前人体研究已经表明,一次性运动与运动训练均可促进骨骼肌线粒体合成因子表达升高,促进呼吸链复合物蛋白合成增强[7,8],近些年来较多研究探索运动诱导线粒体合成的机制,表明上述过程依赖于线粒体基因与核基因转录的精确协作。
2 PGC-1α依赖性信号参与运动诱导线粒体合成
2.1 PGC-1α参与运动诱导线粒体合成
PGC-1α是促进线粒体合成的核心调节因子。运动促进线粒体合成的上游信号有钙离子(Ca2+)、AMP/ATP 及活性氧(reactive oxygen species ,ROS),它们分别激活钙/钙调素依赖性蛋白激酶(Calcium/Calmodu⁃lindependentproteinkinase,CaMK)和一磷酸腺苷依赖的蛋白激酶(adenosine 5‘-monophosphate(AMP)-acti⁃vated protein kinase,AMPK),然后p38 丝裂原活化蛋白 激 酶(p38 mitogen-activated protein kinase,p38 MAPK)被上述激酶激活,通过提高PGC-1α表达或进行转录后修饰,促进线粒体合成[1]。因此,PGC-1α是评价运动中骨骼肌线粒体适应的核心指标,上述运动激活PGC-1α信号通路复杂,相关信号汇总见图1。骨骼肌过表达PGC-1α,则快肌纤维促进有氧代谢的基因和线粒体蛋白表达增加,电刺激收缩下,对抗肌肉疲劳能力更强,肌细胞氧化能力显著提高[9];而且小鼠骨骼肌过表达PGC-1α还促进血管密度提高,线粒体合成及氧化磷酸化提高,运动耐力增强[10],提示PGC-1α介导的线粒体合成增强有利于运动供能。相反,PGC-1α全身敲除小鼠骨骼肌柠檬酸合成酶(citrate synthase,CS))活性和线粒体合成水平下降,而且敲除模型小鼠运动后线粒体合成信号低于野生组[11]。小鼠骨骼肌PGC-1α特异性敲除后,肌纤维有氧代谢供能降低、无氧代谢供能升高,而且小鼠运动耐力下降,炎症因子表达提高[12]。PGC-1α特异性敲除后,小鼠骨骼肌运动训练后细胞色素c 氧化酶IV 亚基(Cytochrome c oxidase IV,COX IV)和细胞色素C(Cytochrome c,Cyt c)增幅减弱,血管增生被削弱,提示PGC-1α缺乏直接减弱运动训练诱导的线粒体合成水平[13]。急性运动还能促进PGC-1α与NRF-1和TFAM结合,分别促进核基因组与线粒体基因组的转录,提高电子链复合物蛋白的合成,协调线粒体与细胞核基因组转录[14]。以上表明PGC-1α在运动促进线粒体合成信号途径中起关键作用,其活性和表达增强有利于运动耐力的保持,PGC-1α被敲除,减弱了与运动诱发线粒体合成及能量代谢的适应。
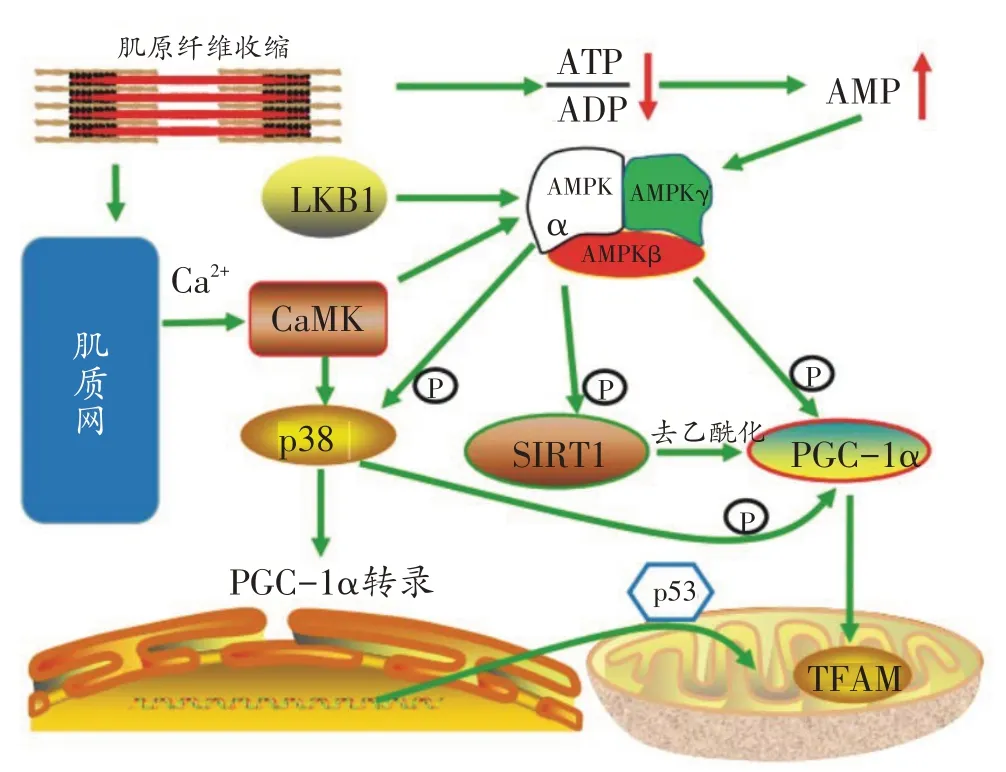
图1 PGC-1α参与运动诱导线粒体合成分子调节机制
2.2 Ca2+信号参与运动诱导线粒体合成
目前认为Ca2+通过CaMK 和p38 MAPK 产生级联信号,提高PGC-1α的表达或对其进行修饰,提高线粒体合成水平。运动中肌纤维收缩,引起肌质网Ca2+大量释放。提高细胞内Ca2+浓度,会增强运动引起的线粒体合成效应,而抑制细胞内部Ca2+浓度,安静状态下线粒体合成水平较低,提示Ca2+在运动诱导线粒体合成中的重要作用[1]。肌肉兴奋收缩偶联中,Ca2+可迅速激活CaMK,而CaMK能引起PGC-1α表达。小鼠单独CaMKⅣ过表达,证实骨骼肌mtDNA 复制水平、脂肪酸氧化分解相关酶表达增强,PGC-1α和线粒体蛋白表达也明显增加[15];单独CaMKⅡ过表达却不能引起大鼠骨骼肌线粒体合成增加[16]。Ca2+对CaMKⅡ的激活依赖于肌浆网Ca2+释放,而且肌浆网Ca2+释放对ROS 有依赖性[17]。运动也是产生ROS 应激的常见因素,运动可能通过兴奋收缩偶联及ROS多种途径增强Ca2+/CaMKⅡ信号,提高线粒体合成水平。如果抑制C2C12 肌细胞Ca2+的浓度,电刺激肌细胞收缩运动,Cyt c表达依然提高,提示Ca2+浓度升高并不是运动诱导肌细胞线粒体合成信号增强的唯一途径[18]。
p38 MAPK 调节线粒体合成。急性运动后,小鼠骨骼肌p38 MAPK 和PGC-1α mRNA 表达均提高;C2C12 细胞实验发现p38 MAPK 促进PGC-1α蛋白表达,抑制p38 MAPK减弱了线粒体合成效应[19]。人体研究也提示一次性蹬车运动和负重跑台行走均可显著提高PGC-1α蛋白和p38 MAPK(Thr180/Tyr182)磷酸化水平[20],表明运动刺激后两种蛋白和基因表达水平协同升高。Ca2+是激活p38 MAPK 的关键因素,Ca2+激活p38 MAPK 与上游CaMK 有关。提高肌细胞Ca2+浓度,p38 MAPK 磷酸化水平增强。而特异性抑制剂KN93抑制CaMK 活性后,Ca2+激发p38 MAPK 磷酸化也被抑制,表明p38 MAPK是Ca2+/CaMK Ⅱ的下游调控信使,p38 MAPK 调控线粒体合成依赖于Ca2+/CaMK Ⅱ的激活[21]。p38 MAPK 可激活下游靶蛋白MEF2,促进其定位于PGC-1α基因启动子,促进PGC-1α转录合成,刺激C2C12 细胞收缩能促进p38 MAPK 磷酸化表达增加[22]。有研究使用活体生物发光技术证实,小鼠运动能促进MEF2在肌细胞核的定位,启动PGC-1α转录[23],提示运动促进线粒体合成效应中,Ca2+/CaMK Ⅱ-p38 MAPK-PGC-1α信号轴在发挥作用。利用基因技术分别敲除小鼠p38α、p38β、p38γ MAPK基因,发现4周耐力训练后,只有p38γ基因敲除组骨骼肌毛细血管密度、COX Ⅳ、Cyt c蛋白和PGC-1α mRNA没有增长[24]。整体表明,运动激活p38γ MAPK 信号,是运动诱导骨骼肌线粒体合成的关键机制。
3 PGC-1α非依赖性信号参与运动诱导线粒体合成
作为一种肿瘤抑制因子,p53也参与线粒体合成的调控,其重要功能是转移到线粒体内与TFAM结合,定位于mtDNA D-loop 区域,促进线粒体基因组的转录,促进线粒体蛋白合成。研究发现敲除小鼠骨骼肌p53,小鼠一次性运动能力下降,骨骼肌TFAM mRNA 增幅被削弱,肌细胞无氧酵解供能比例更高,有氧氧化能力下降,骨骼肌mtDNA含量大幅降低,提示p53在骨骼肌线粒体合成及维持运动耐力方面起重要作用[25]。一次性运动能促进小鼠骨骼肌线粒体PGC-1α、TFAM、NRF-1 和COX-IV mRNA 表达升高,降低细胞核p53蛋白表达,提高线粒体p53蛋白表达,而且在运动恢复期内线粒体p53 与TFAM 结合水平显著增强,而敲除p53,削弱了运动后mtDNA转录物COX-I的表达[26]。人体研究也发现一次性运动后,骨骼肌p53与TFAM表达升高,呈显著正相关[20]。Safdar等[27]研究表明,对线粒体聚合酶缺乏的小鼠进行6 个月耐力训练,骨骼肌线粒体内p53表达增加,mtDNA拷贝数量增加的同时,变异mtDNA 大幅度减少,且COX 活性上升到正常水平;骨骼肌特异性敲除p53,上述效应被削弱。这提示运动训练具有类似线粒体聚合酶的功能,单独运动也可修复mtDNA,这种功效可能与运动促进p53 向线粒体内转运,提高线粒体合成信号有关。也有不同观点的报道。Beyfuss 等[28]发现p53 在维持基础状态下线粒体合成信号中起关键作用,但骨骼肌特异性p53敲除后,力竭运动距离、COX活性及PGC-1α蛋白表达增加并未被减弱,无论是整体还是骨骼肌特异性p53敲除,运动后线粒体合成表现无显著差异,提示p53 敲除不影响运动诱导线粒体合成的进行,可能存在其它代偿途径。
以上研究表明,运动能促进p53在线粒体内定位,促进p53-TFAM与mtDNA结合,促进线粒体合成;但骨骼肌p53 敲除后,运动诱导的线粒体合成增强效应是否减弱还有争议。对骨骼肌p53敲除小鼠进行一次性运动,仅发现削弱了COX-Ⅰ蛋白表达的提高[26],对骨骼肌p53敲除小鼠进行长期训练后发现削弱了COX的活性增强[27],评价线粒体合成的指标不是很全面。近期研究却认为p53敲除不影响运动诱导的线粒体合成[28]。p53在运动诱导线粒体合成中是必不可少还是冗余、可替代途径,还有待进一步研究。
4 PGC-1α转录后修饰水平参与运动诱导线粒体合成
4.1 AMPK磷酸化作用参与运动诱导线粒体合成
AMPK 在肌肉收缩中可被迅速激活,促进线粒体合成。运动中ATP 被消耗,分解产物二磷酸腺苷(ADP)和一磷酸腺苷(AMP)大量增加,AMP 与AMPK γ亚基结合,引起AMPK结构变化,提高AMPKα亚基激酶催化活性[29]。AMP/ATP比值升高反映了肌细胞能量消耗加速,AMPK 激活促进糖、脂分解代谢,促进ATP合成,减少ATP 波动[30]。基因敲除抑制大鼠骨骼肌AMPK 后,给大鼠喂食AMPK 慢性激活剂β-胍基丙酸(β-GPA)后没有观察到线粒体合成增强效应,而野生鼠骨骼肌线粒体合成增强效应正常发生;而且敲除AMPK 后,PGC-1α 和CaMK Ⅳ表达也不能被激活[31]。AMPKγ3 亚基主要表达于糖酵解类型肌纤维,研究发现γ3 亚基R225Q 突变,催化活性增强后,肌纤维中线粒体容量和PGC-1α表达显著增加,线粒体合成效应加速[32]。以上提示AMPK 是调节骨骼肌线粒体合成效应必不可少的环节。
AMPK可以磷酸化PGC-1α,直接提高线粒体合成水平,也可通过间接方式对组蛋白去乙酰化酶5(HDAC5)进行磷酸化,减轻MEF2的抑制状态,提高其对PGC-1α转录的激活[33]。5-氨基咪唑-4-羧基酰胺核糖核苷(5-Aminoimidazole-4-carboxyamide ribonucleo⁃side,AICAR)是AMPK特异性激活剂,模拟了AMP/ATP增加的效果,AMPK 直接对PGC-1α(Thr1722、Ser538)位点磷酸化,激活PGC-1α功能,这些位点发生突变,AICAR注射后,AMPK介导的PGC-1α磷酸化激活被抑制,提示AMPK 对PGC-1α磷酸化的重要性[34]。特异性敲除小鼠骨骼肌AMPK β1β2 亚基引起肌细胞线粒体合成能力下降,一次性运动耐力下降,运动中血糖摄取能力下降[35]。Lantier 等[36]同样发现AMPKα1α2 双敲除后小鼠日常活动能力减弱,且线粒体合成水平明显下降,力竭运动测试成绩下降。而且小鼠一次性运动测试中呼吸商相对较高,脂代谢能量下降,提示敲除小鼠AMPKα1α2 可引起有氧代谢能力降低[37]。以上研究提示AMPK介导的线粒体合成对运动能力的维持起关键作用,但研究均没有考察基因敲除动物运动后线粒体合成水平是否被抑制。人体研究发现高强度游泳运动后,肱三头肌AMPK(Thr172)磷酸化水平增加与PGC-1α蛋白表达同步升高[38],提示AMPK 激活可能在运动诱导人体骨骼肌线粒体合成中起作用。
AICAR 与运动激活AMPK 有相似之处,均能提高糖、脂的分解代谢。早期有研究通过注射AICAR 激活小鼠骨骼肌AMPK,下游PGC-1α、己糖激酶Ⅱ(hexoki⁃naseⅡ,HKⅡ)基因表达显著升高,但敲除AMPKα2 后这种效应被减弱,证明AMPKα2 缺乏抑制了AICAR 诱导的线粒体合成效应[39]。但这种效应在急性运动中并未发现。小鼠整体敲除AMPK α2 基因,一次性运动后,骨骼肌PGC-1α、丙酮酸脱氢酶激酶4(PDK4)、HKⅡ基因表达仍然呈现出与野生鼠类似的增长表现[39]。也有研究发现AMPK α2 敲除不能降低4 周主动转轮训练诱导的能量代谢反应,小鼠腓肠肌HKⅡ、COX-Ⅰ、CS 及葡萄糖转运蛋白4 蛋白表达与野生鼠无差异[40]。以上结果提示单独敲除AMPKα2还不足以阻碍急性运动和耐力训练诱导的糖代谢适应,但这几项研究缺乏对PGC-1α等关键因子的蛋白定量检测,对线粒体合成效应评价不全面。Fentz 等[41]报道骨骼肌特异性AMPKα1α2 双敲除小鼠急性运动后,股四头肌COX-Ⅰ、葡萄糖转运蛋白4和血管内皮生长因子mRNA表达被显著抑制,PGC-1α mRNA 增长也被削弱;4 周耐力训练后,股四头肌CS 活性、Cyt c 及COX-Ⅰ蛋白表达被显著抑制,但比目鱼肌未体现这种变化,提示AMPKα1α2敲除可阻碍运动训练诱导股四头肌线粒体的合成。
以上研究表明骨骼肌AMPKα缺乏,动物急性运动后,骨骼肌线粒体合成基因转录抑制不明显;长期训练后骨骼肌线粒体合成增长效应被抑制,但这种抑制在不同骨骼肌上存在差异。相关AMPK亚基敲除研究对调控线粒体合成的蛋白考察不是很全面,AMPK β和γ亚基敲除后,是否影响到运动诱导的线粒体合成,有待研究。
4.2 SIRT1、GCN5参与运动诱导线粒体合成
沉默信息调节因子2 相关酶1(NAD+-dependent sirtuin1,SIRT1)与乙酰转移酶5(general control nonde⁃repressible-5,GCN5)可能也参与了运动诱导骨骼肌线粒体合成的分子机制。SIRT1 主要通过对PGC-1α进行去乙酰化激活PGC-1α,促进线粒体合成调节;GCN5对PGC-1α能产生强烈的乙酰化作用,在肝细胞、肌细胞中发挥抑制线粒体合成的作用[42]。
SIRT1 对PGC-1α去乙酰化能促进线粒体合成,而运动能促进线粒体合成,运动可能通过提高SIRT蛋白表达及去乙酰化活性来加速线粒体合成效应。早期研究发现运动训练后,小鼠腓肠肌线粒体合成能力增强,mtDNA、SIRT 蛋白表达、PGC-1α去乙酰化水平同步增加[43]。Gurd 等[42]归纳发现,人体和动物一次性运动后,骨骼肌SIRT1 mRNA及蛋白表达均显著提高,24~48h恢复到基础水平。这提示SIRT1可能在运动诱导线粒体合成中发挥作用。但特异性敲除小鼠骨骼肌SIRT1后,20 天转轮主动训练同样引起小鼠骨骼肌mtDNA、PGC-1α及电子链复合物表达提高,与野生组无差异;一次性运动后PGC-1α表达、活性及去乙酰化水平同样升高,提示SIRT1缺乏并不影响运动诱导的PGC-1α去乙酰化及线粒体合成,但运动诱导PGC-1α去乙酰化水平增加的同时,伴随核内GCN5 表达减少,提示GCN5活性变化可能是运动诱导PGC-1α去乙酰化的关键因素[44]。而Park等[45]实验结果支持上述结论,shRNA技术分别抑制小鼠腓肠肌SIRT1和GCN5表达,对肌细胞进行电刺激收缩,发现SIRT1抑制不影响肌细胞PGC-1α去乙酰化水平。以上提示SIRT1 通过对PGC-1α去乙酰化作用参与运动诱导骨骼肌线粒体合成效应,但并不是唯一途径。目前认为SIRT1与AMPK关系密切,两者互相激活,SIRT1在运动诱导骨骼肌线粒体合成中依赖于AMPK。AMPK可通过提高骨骼肌细胞NAD+含量激活SIRT1 活性[30]。小鼠进行AICAR 注射,激活趾长伸肌AMPK的同时还能促进SIRT1蛋白表达持续升高,至少维持24h[46]。AMPK 也可以通过提高PGC-1α(Ser177、Ser538)的磷酸化来增强SIRT1 对PGC-1α的去乙酰化[47]。而SIRT1也能促进AMPK上游LKB1的去乙酰化作用,增强AMPK的活性,注射白藜芦醇可激活小鼠骨骼肌AMPK 活性和线粒体合成,但全身敲除SIRT1抑制了这种效应。敲除小鼠骨骼肌AMPKγ3,无论是饮食限制,还是急性运动,PGC-1α、FOXO1去乙酰化增长幅度被显著抑制,表明运动诱导PGC-1α激活依赖于AMPK对SIRT1的激活作用[48]。
由于GCN5 的乙酰化作用抑制了PGC-1α的活性,抑制GCN5 表达可能有利于运动诱导骨骼肌线粒体合成。但shRNA技术抑制GCN5表达,运动后PGC-1α去乙酰化水平不仅没有增强,还被削弱[45]。近年研究也发现骨骼肌特异性敲除GCN5,20 天主动耐力训练后,小鼠骨骼肌线粒体合成水平及PGC-1α表达上升与对照组一致,没有额外增强效应[49]。GCN5在运动诱导线粒体合成效应中起何作用,有待研究。
5 结论与展望
运动促进骨骼肌线粒体合成主要通过PGC-1α调节,PGC-1α缺乏限制了运动诱导线粒体合成水平。Ca2+/CaMKⅡ-p38γ MAPK-PGC-1α轴在运动诱导骨骼肌线粒体合成效应中发挥关键作用。运动促进线粒体合成与p53-TFAM 在mtDNA 定位增强有关,但p53 敲除模型结论矛盾,其在运动诱导骨骼肌线粒体合成中起何种作用有待研究。SIRT1 对PGC-1α的去乙酰化是线粒体合成的重要途径,但其不是运动诱导线粒体合成的必需途径。GCN5 通过对蛋白进行乙酰化影响线粒体合成,但运动科学领域对其研究还不够。AMPK对线粒体合成发挥强大调控作用,当前其敲除模型对线粒体合成调控因子考察不全面,AMPK β和γ亚基在运动诱导线粒体合成中起何种作用,还不知晓。线粒体合成还依赖于内膜蛋白转运通道复合物的功能,运动诱导骨骼肌线粒体合成是否与其表达有关,有待研究。
另外,线粒体合成与线粒体自噬共同维护线粒体的健康,AMPK不仅调控线粒体合成,也直接调控运动诱导的线粒体自噬[50]。因此,运动改善骨骼肌能量代谢,线粒体产生的良好适应不仅有线粒体合成提高,与自噬清除能力加强也有关。运动诱导骨骼肌线粒体合成过程中,线粒体自噬有何变化,调控线粒体合成的因子对线粒体自噬有何影响,有待进一步研究。

