耐力运动结合雷帕霉素对高脂膳食大鼠骨骼肌能量代谢相关基因表达的影响
廖八根 李燕飞
广州体育学院运动医学室(广州510150)
长时间高脂膳食可导致骨骼肌线粒体氧化功能和能量代谢紊乱,诱发肥胖和胰岛素抵抗,而运动则可协调改善骨骼肌脂肪酸和线粒体氧化代谢,降低肥胖,改善胰岛素敏感性[1]。运动可增加或上调高脂膳食时骨骼肌线粒体氧化和能量代谢有关蛋白的活性或基因表达[2],但运动改善高脂膳食时骨骼肌能量代谢相关蛋白活性或基因表达的分子机制目前并不完全清楚。
哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)是胰岛素/胰岛素样生长因子下游信号中的一个丝苏氨酸蛋白激酶,存在mTORC1 和mTORC2 两种功能形式的蛋白复合体,不仅参与调控细胞大小,而且参与调节细胞代谢,是胰岛素信号和能量信号的重要整合感受器[3-4]。高脂膳食肥胖可持续激活骨骼肌mTORC1/核蛋白体S6 激酶1(ribosomal pro⁃tein S6 kinase 1,S6K1)信号,在肥胖诱导的胰岛素抵抗中起重要作用[3]。研究[5-6]显示mTOR 可影响骨骼肌线粒体氧化能力和胰岛素敏感性。细胞学研究[7-8]表明mTORC1 促进骨骼肌细胞脂质合成,抑制酯解和脂肪酸氧化。对组织特异性的mTOR相关成份基因敲除小鼠[9-12]的研究结果显示,mTORC1 促进骨骼肌线粒体氧化功能,骨骼肌mTORC1 失活损害线粒体氧化功能并下调过氧化物酶增殖体激活受体β(peroxisome prolif⁃erator-activated receptorsβ,PPARβ)、过氧化物酶体增殖物激活体辅激活因子1α(peroxisome proliferater-ac⁃tivated receptor gamma coactivator 1α,PGC -1α)等基因表达。然而对于S6K1 敲除小鼠[13,14],喂食高脂膳食反而改善其糖耐量,增加骨骼肌脂肪酸氧化能力及能量支出,上调PGC -1α、PPARβ等基因表达。耐力运动则可降低肥胖大鼠慢肌mTORC1/S6K1活性,改善胰岛素敏感性[15]。我们之前的研究[16]显示耐力运动改善高脂膳食大鼠骨骼肌胰岛素抵抗,反而使快肌基础状态mTORC1/S6K1 活性升高。高脂膳食及运动时不同类型骨骼肌mTOR变化的结果仍不完全清楚。本研究采用高脂膳食模型大鼠进行耐力运动,并结合腹腔注射雷帕霉素(mTORC1抑制剂),以观察抑制mTOR信号通路是否影响高脂膳食大鼠耐力运动时骨骼肌线粒体氧化功能和能量代谢相关转录因子的基因表达。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验动物购于广东省医学实验动物中心,动物品种品系:SPF 级雄性SD 大鼠,体重/日龄:100~150 g/35~49 d。许可证号SCXK(粤)2008-0002。
1.1.2 主要试剂和仪器
雷帕霉素,Gene Operation公司产品;血糖试剂盒,ROBIO 公司产品;甘油三酯试剂盒,DONGOU 公司产品;血浆游离脂肪酸和BCA蛋白定量试剂盒,南京建成公司产品;胰岛素、β羟丁酸、瘦素ELISA 试剂盒,上海源叶公司产品;组织蛋白提取试剂盒、琥珀酸脱氢酶(succinodehydrogenase,SDH)活性试剂盒和TRlzon,康为世纪公司产品;细胞色素氧化酶(cytochrome oxi⁃dase,COX)活性试剂盒,BIOVISION 公司产品;反转录试剂盒为Takara 公司产品。血糖仪为GLUCOTMCardII血糖仪(日本,GT-1640)。
1.1.3 引物设计和合成
各PCR扩增引物,南京金瑞科技有限公司合成,内参为Ppia(Peptidylprolyl Isomerase A),具体见表1。

表1 扩增引物序列
1.2 方法
1.2.1 动物建模与干预
1.2.1.1 动物分组及模型建立
实验地点为广州市体育科学研究所SPF 级实验室,30只实验大鼠正常膳食适应性喂养1周后称重,淘汰体重增长最少的6 只大鼠,剩余24 只进行高脂膳食喂养。依据既往研究[16],大鼠高脂膳食喂养6周建立肥胖大鼠骨骼肌胰岛素抵抗模型。所有大鼠均进行适应性训练1周后,将24只高脂膳食大鼠随机分为4组:高脂膳食安静对照(H)、高脂膳食+运动(HE)、高脂膳食+雷帕霉素(HR)、高脂膳食+运动+雷帕霉素(HER),每组各6只。
1.2.1.2 实验干预
第8周开始,所有组继续给予高脂膳食4周。与此同时,H 组无其他任何干预;HE 和HER 组大鼠运动干预4 周,每周5 天跑台训练,周六、日休息,第8 至11 周每周的运动速度分别为20、23、25、25 m/min,运动时间分别为30、30~40、40、40 min/天。HR和HER组大鼠则在第10 周起每天腹腔注射雷帕霉素(如运动,则于运动前1 h 注射),剂量2 mg/kg 体重。部分大鼠干预期间由于注射雷帕霉素等因素而死亡,最终实验结束时H组6只,HE组4只,HR组5只,HER组4只。
1.2.1.3 糖耐量和胰岛素耐量试验
第11周,跑台训练结束后,各组随机取4只大鼠进行腹腔糖耐量试验[16]:禁食6小时后每只大鼠腹腔注入葡萄糖,剂量2 g/kg 体重,割尾静脉取血,用血糖仪分别测0、30、60、120 分钟血糖;腹腔糖耐量试验结束后第2天各组随机取4只大鼠进行腹腔胰岛素耐量试验:上午9~10 时,每只大鼠腹腔注入胰岛素,剂量0.75 U/kg 体重,割尾静脉取血,用血糖仪分别测0、15、30、60分钟血糖。糖耐量和胰岛素耐量用时间-血糖曲线对应的曲线下面积表示[16]。糖耐量曲线下面积计算公式:0 min血糖×0.25+30 min血糖值×0.5+ 60 min血糖值×0.75+120 min血糖值×0.5;胰岛素耐量曲线下面积计算公式:1×0.125+15 min 血糖值(相对于基础值)×0.25+30 min 血糖值(相对于基础值)×0.375+60 min血糖值(相对于基础值)×0.25。
1.2.1.4 取材
第11周大鼠停止训练至少48小时,禁食12~16小时左右后进行取材:大鼠麻醉后打开腹腔取腹主动脉血,再取脂肪并称重,同时快速取双侧比目鱼肌、趾长伸肌。动脉血用于分析空腹血糖(fasting blood glu⁃cose,FBS)、甘 油三酯(fasting plasma triglycerides,FTG)、血清游离脂肪酸(fasting plasma non-esterified fatty acids,FFA)、瘦素(leptin)、胰岛素(fasting plasma insulin,FINS)、β-羟丁酸(β-hydroxybutyrate,β-HB)。取双侧比目鱼肌和趾长伸肌置于液氮中保存,用于之后的PCR 检测、Western blotting 以及SDH 活性和COX活性测定。
1.2.2 指标检测
1.2.2.1 血清FBS、FTG、FFA、FINS、β-HB含量测定
按相关试剂盒操作方法测定。
1.2.2.2 骨骼肌SDH、COX活性测定
取冻存比目鱼肌和趾长伸肌,称量后用组织蛋白提取试剂盒提取,再用BCA 蛋白定量试剂盒测得胞浆浓度后,分别按相应试剂盒操作方法用比色法测定。
1.2.2.3 荧光实时定量PCR 法检测能量代谢相关转录因子mRNA表达
从液氮中取出适量骨骼肌约40 mg,在液氮中研磨后加入TRlzon 1 ml,按照试剂盒步骤提取总RNA。按照反转录说明书取Total RNA 2 μl(约1 μg),进行反转录,反应体系20 μl。 PCR 扩增反应体系20 μl,取反转录CDNA 模板 2.0 μl,加入预混合液SYBR green PCR Master MIX 10 μl,Forward primer(10 μm)0.4 μl,Reverse Primer(10 μm)0.4 μl,RNase free water 7.2 μl。反应条件:95℃30秒预变性,95℃5秒,60℃20 秒,40 循环收集荧光,60~95℃分析溶解曲线,获得Ct 值和溶解曲线。数据利用ΔΔCt 的方法处理,即以Ppia基因为内参(统计显示运动和雷帕霉素并不影响其Ct 值),依据Ct 值比较法进行相对定量分析。ΔCt=靶基因Ct 值−同样本内参Ct 值;ΔΔCt=处理组ΔCt−对照组ΔCt。最终,处理组目标基因相对于对照组目标基因的量通过公式2-ΔΔCt计算得到。
1.2.2.4 骨骼肌mTOR活性检测
本研究通过检测磷酸化核蛋白S6(Ser235/236)和磷酸化AKt(Ser473)蛋白含量分别间接反映mTORC1和mTORC2 活性[17]。蛋白含量用Western blotting 测定。简要步骤如下:取50~100 mg 骨骼肌加入含150 mM NaCl,5 mM EDTA,50 mM Tri-HCl(pH 8.0),1 %-NP 40,1 mM aprotinin,0.1 mM leupeptin,1 mM pepstatin 缓冲液中用生物样品均质仪(Bioprep-24)匀浆,然后13000 rpm 离心30 min 提取上清,蛋白定量后置于-80℃保存。样品用10% SDS-PAGE 电泳,湿式恒压电转转到PVDF 膜。剪下相应各带,膜封闭后加入一抗4℃孵育过夜。一抗分别为Akt(Sc-5298,Santa Crutz),p-Akt ser473(AF887,Biotechne);S6(sc-74459,Santa Crutz)和P-S6(#6194,Cell Sig⁃naling technology)。膜洗涤后加入相应二抗室温孵育1.5小时。最后用化学发光仪(Tanon)检测。
1.3 统计学分析
采用SPSS17.0 软件进行分析。表中数据用均数±标准差表示。用两因素析因设计方差分析对运动和雷帕霉素的主效应和交互效应进行统计分析。有主效应时,组间差异进一步用post hoc Turkey进行检验;如析因分析有交互影响,则固定其中一个因素(运动或雷帕霉素)分析另一个因素的效应。显著水平α=0.05 。
2 结果
2.1 运动和雷帕霉素降低高脂膳食大鼠体重、体脂以及血浆瘦素水平
由表2可知,运动和雷帕霉素对高脂膳食大鼠体重、体脂百分比(内脏脂肪重/体重)和血浆瘦素水平均有主效应,且HER 组大鼠体重、体脂百分比与血浆瘦素均显著低于H 组(P<0.05);运动及雷帕霉素对高脂膳食大鼠空腹血糖、甘油三酯、β-羟丁酸及胰岛素均无主效应。
由于体重变化与进食量密切相关,因此,我们同时测定了大鼠每天每只平均进食量,结果H组16.4 g,HE组15.7 g,HR 组15.2 g,HER 组14.2 g,各组间差异无统计学意义。
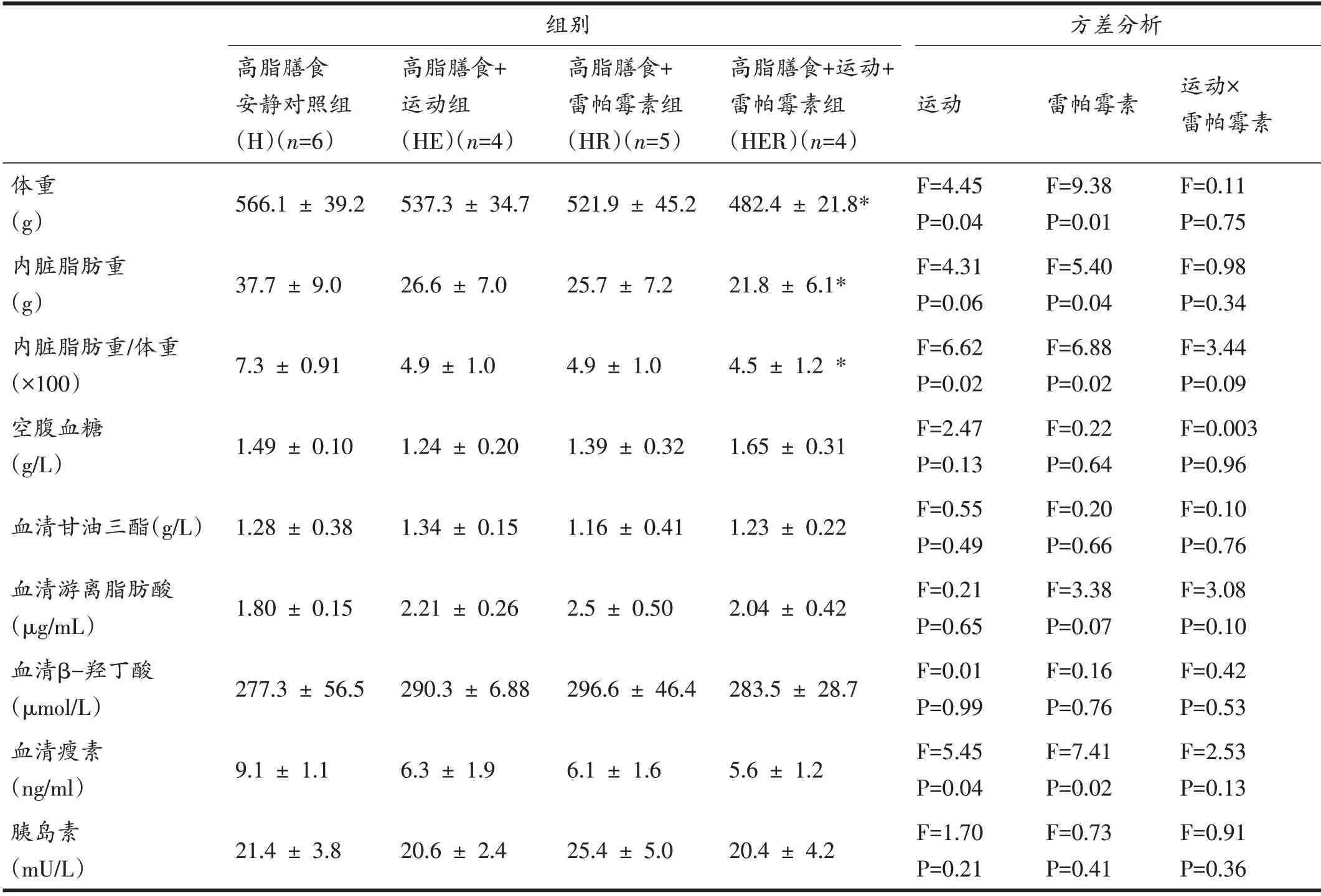
表2 运动和雷帕霉素对高脂膳食大鼠生理及血生化参数的影响
2.2 运动和雷帕霉素对高脂膳食大鼠糖耐量和胰岛素耐量影响
结果见图1。糖耐量试验中,HE 组的曲线下面积低于H 组、HR 组和HER 组(P<0.05),HR 组和HER 组的曲线下面积高于H组(P<0.05);胰岛素耐量试验中,HE组的曲线下面积低于H组、HR组和HER组(P<0.05)。
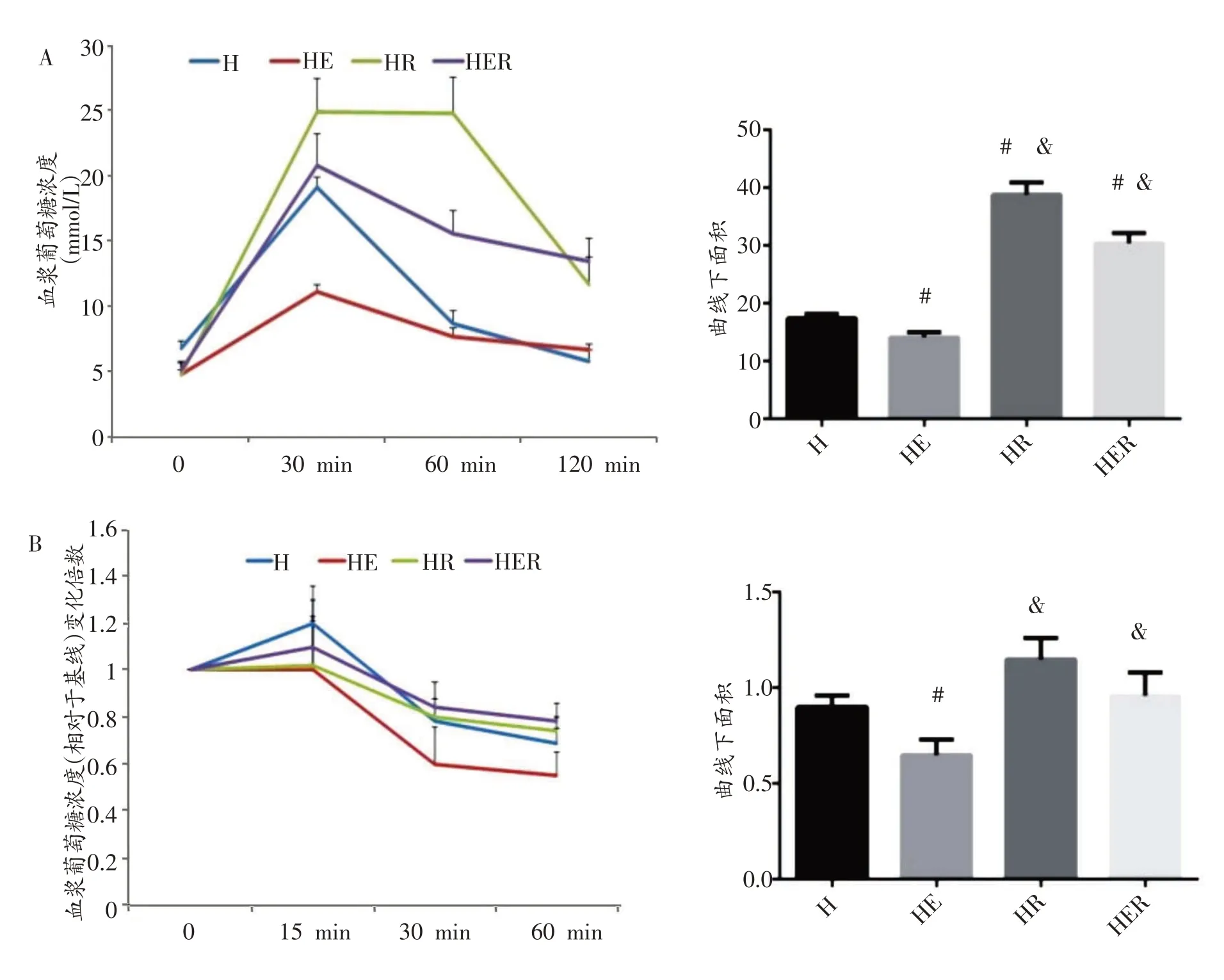
图1 各组大鼠葡萄糖耐量曲线(A)和 胰岛素耐量曲线(B)
2.3 运动和雷帕霉素影响骨骼肌能量相关代谢酶活性
运动和雷帕霉素对比目鱼肌SDH 活性均有主效应;进一步分析,HR组和HER组SDH活性均低于H组和HE组(P<0.05)。另外,运动对趾长伸肌COX活性也有主效应,但组间差异无显著性(表3)。
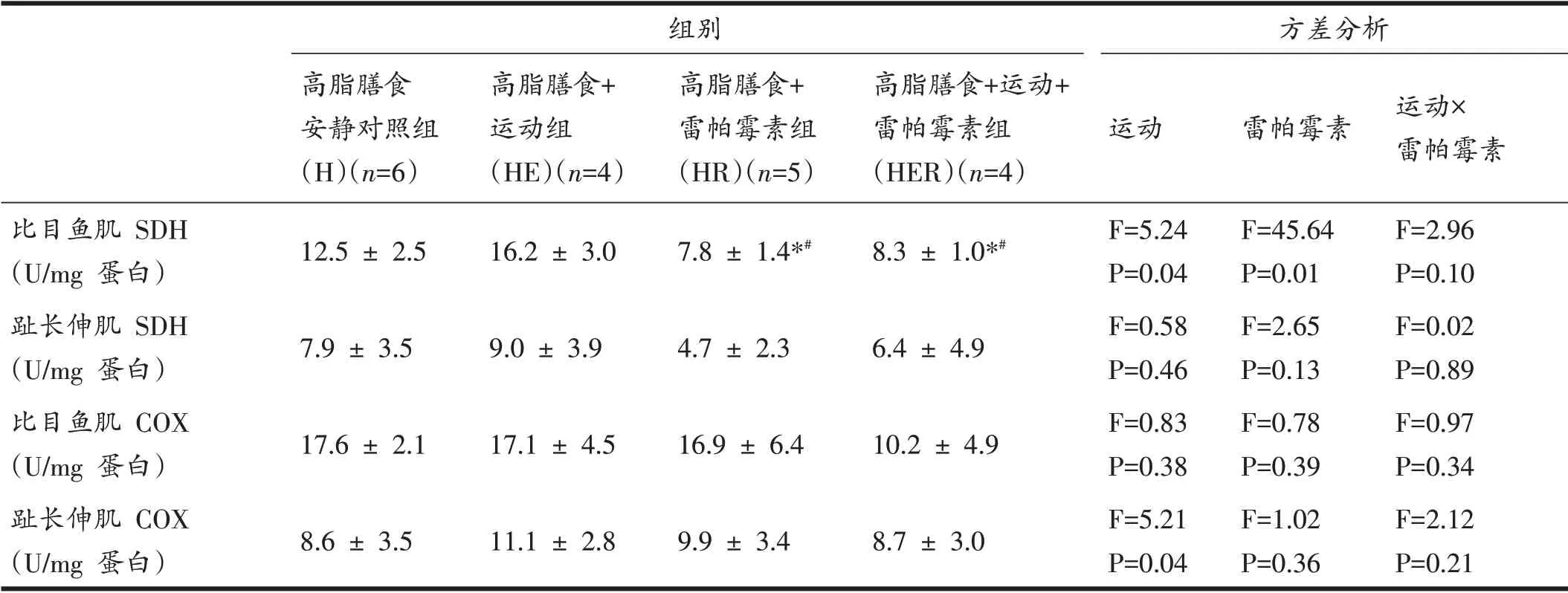
表3 运动和雷帕霉素对高脂膳食大鼠骨骼肌部分线粒体氧化代谢酶活性的影响
2.4 雷帕霉素影响高脂运动大鼠骨骼肌能量代谢相关基因表达
结果见图2。双因素方差分析结果显示,雷帕霉素对趾长伸肌PGC-1α和比目鱼肌PPARβ mRNA含量有主效应(P=0.01),进一步组间分析显示,HER组趾长伸肌PGC-1α mRNA 含量高于H 和HE 组(P<0.05),而HR 和HER 组比目鱼肌PPARβ mRNA 含量低于H 组(P<0.05)。雷帕霉素和运动对高脂膳食大鼠趾长伸肌和比目鱼肌PGC-1β和PPARα的基因表达无影响。
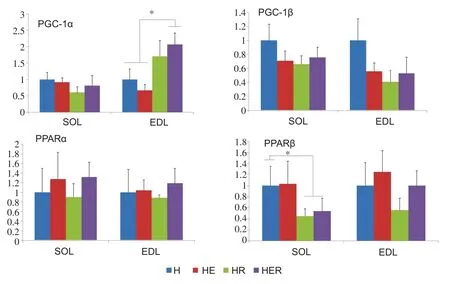
图2 耐力运动结合雷帕霉素对高脂膳食大鼠骨骼肌能量代谢相关基因影响
2.5 骨骼肌mTOR活性检测
结果见图3。P-Akt(Ser473)/Akt 含量在比目鱼肌和趾长伸肌各组间的差异均无统计学意义(P>0.05),但P-S6(Ser235/236)/S6含量在比目鱼肌中,HE组、HR组和HER 组均低于H 组(P<0.05);在趾长伸肌中,仅HR组P-S6(Ser235/236)/S6低于H组(P<0.05),其他组间差异无统计学意义(P>0.05)。
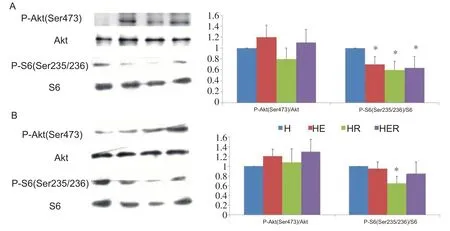
图3 耐力运动结合雷帕霉素对高脂膳食大鼠比目鱼肌(A)和趾长伸肌(B)Akt和S6蛋白影响
3 讨论
慢性mTORC1/S6K1 激活可通过负反馈抑制胰岛素信号,在肥胖诱导的胰岛素抵抗中起重要作用,相应地抑制mTORC1/S6K1信号可改善胰岛素敏感性[18]。雷帕霉素作为阻止器官移植排异反应的免疫抑制药,是mTORC1/S6K1 信号通路抑制剂。既往研究[19,20]表明,急性使用雷帕霉素可改善高脂膳食时骨骼肌胰岛素敏感性,而长时间(2周以上)应用雷帕霉素却可引发糖尿病样综合症副作用,出现高脂血症、脂肪减少、糖耐量异常等,然而也有研究[21-23]显示长时间应用雷帕霉素有良好效应。本研究采用6 周高脂膳食肥胖模型大鼠[16]进行4 周耐力运动,结果显示运动可显著降低高脂膳食大鼠体重、体脂百分比,提高高脂膳食大鼠比目鱼肌SDH和趾长伸肌的COX活性,提高线粒体氧化能力,并改善糖耐量和胰岛素耐量,这与既往研究结果一致[1]。我们进一步采用雷帕霉素靶蛋白抑制剂雷帕霉素(2 mg/kg体重,每日1次,腹腔注射,共2周)短期干预高脂膳食及高脂膳食+运动大鼠,结果使用雷帕霉素后除导致FFA 倾向升高外,并未显著影响大鼠FBS、FTG 和FINS 浓度,但雷帕霉素仍然显著降低高脂膳食大鼠体重和体脂,并进一步降低高脂膳食+运动大鼠体重和体脂,且同既往研究结果一样损害大鼠机体糖耐量。不过本研究结果显示雷帕霉素并未明显损害高脂膳食大鼠胰岛素耐量,但减弱运动对胰岛素耐量的改善作用,这从另一方面也说明运动并不能消除雷帕霉素的副作用。
目前研究认为雷帕霉素会损害胰岛素敏感性还是改善胰岛素敏感性与使用药物剂量、方法[21-24]和动物模型的胰岛功能状态有关[18]。Lamming 等[11]研究认为,雷帕霉素损害大鼠机体糖耐量和胰岛素耐量主要与长时间使用雷帕霉素可额外抑制各组织mTORC2有关。我们用Western blotting 技术测定了骨骼肌磷酸化S6(Ser235/236)和磷酸化AKt(Ser473)蛋白含量,探讨本实验中雷帕霉素对mTORC1 和mTOR2 的影响。结果显示雷帕霉素使P-S6 Ser235/236含量降低,但未影响P-Akt Ser473,这提示雷帕霉素使用时间相对较短,只抑制了骨骼肌mTORC1,并未抑制mTORC2活性。
雷帕霉素损害大鼠机体糖耐量和胰岛素耐量可能还存在其他因素。由于体重和体脂改变与摄食量有关,因此我们比较了各组大鼠进食量。虽然雷帕霉素使大鼠摄食量有所减少,但并无统计学意义,故并不能解释体重和体脂改变原因。瘦素是调节进食和体重平衡的关键激素,运动可以降低脂肪组织分泌的瘦素水平,然而在肥胖群体中血浆瘦素水平却异常升高,主要是由于机体产生了瘦素抵抗[25,26]。与这些文献一致,我们进一步检测血浆瘦素水平,结果显示运动和雷帕霉素均降低高脂膳食大鼠血浆瘦素水平,并且与大鼠体脂降低比例基本一致。这提示雷帕霉素不仅可以通过降低摄食量,还可能通过降低瘦素水平使高脂膳食大鼠脂肪组织合成受抑、分解增加或能量支出进一步增加,从而降低其体重和体脂水平。已有研究[20,27]表明,抑制脂肪组织mTORC1可直接抑制脂肪组织摄取脂质和合成脂肪。我们进一步分析了涉及骨骼肌能量代谢酶(SDH和COX)活性以及脂肪酸和线粒体能量代谢蛋白调节的核转录因子(PGC-1α、PGC-1β、PPARα、PPARβ)[28,29]在不同类型骨骼肌中的基因表达变化,结果表明雷帕霉素损害比目鱼肌SDH 活性,降低PPARβ mRNA 水平,这与小鼠肌肉特异性的Raptor 或mTOR基因敲除后小鼠[9-11]表现为骨骼肌线粒体氧化能力受损的研究结果相似。然而,本研究显示,雷帕霉素增加高脂膳食+运动大鼠趾长伸肌PGC-1α mRNA 含量,不过并未相应增加线粒体SDH和COX活性。既往研究[17,20]显示,小鼠用雷帕霉素或小鼠肝或脂肪组织特异性抑制mTORC1 会表现类似“饥饿样”变化,增加肝组织PGC-1α和PPARα表达和脂肪组织PGC-1α 表达[23,28,30],提示PGC-1α、PPARα等能量代谢相关转录因子基因的表达变化可能具有组织特异性。本研究进一步表明雷帕霉素对高脂膳食+运动大鼠骨骼肌能量代谢相关转录因子基因的影响具有肌纤维特异性差异。
4 总结
本研究结果表明,mTOR信号抑制剂雷帕霉素虽然损害高脂膳食大鼠糖耐量并妨碍运动改善高脂膳食大鼠胰岛素耐量,且雷帕霉素损害高脂膳食大鼠比目鱼肌线粒体氧化,然而其并未明显损害趾长伸肌线粒体氧化,并且还增加PGC-1α基因表达。本研究未同步测定这些能量代谢酶及调节因子的蛋白含量变化,结论存在局限性。
——雷帕霉素

