婴儿肝内胆管囊腺瘤1例并文献复习
葛 亮 张胜男 詹江华 包国强
肝内胆管囊腺瘤(Intrahepatic biliary cystadenoma)是来源于肝内胆管上皮细胞的罕见肝脏肿瘤,由Hueter于1887年最先报道,5年后Keen提出了手术切除肝内胆管囊腺瘤的报道,之后Edmondson首次描述了肝内胆管囊腺瘤的病理组织学特点[1,2]。既往研究提示肝内胆管囊腺瘤好发于肝左叶,男女发病比例约1∶4,占所有肝脏囊性病变病例总数5%以下[3]。此病在儿童中极其罕见,复习国内外文献,迄今为止已被报道的儿童病例仅13例[4-16]。天津市儿童医院收治的1例婴儿肝内胆管囊腺瘤是目前已有报道中年龄最小的患儿,笔者通过复习有关文献,旨在综合分析小儿肝内胆管囊腺瘤临床特点,提高小儿外科医生对该病的认识。
患儿男,38 d龄,因“超声发现腹部肿物8 d”入院。患儿自发病以来睡眠及精神良好,大小便正常。查体:发育可,营养中等,精神可,呼吸平稳,面色红润,皮肤及巩膜无黄染。腹部稍膨隆,未见肠型及蠕动波,未见腹壁静脉曲张,右上腹可扌门及一肿物,大小约5 cm×5 cm×3 cm,质韧,无压痛,无明显活动,全腹无肌紧张及反跳痛,肝脾未触及,移动性浊音阴性,肠鸣音正常。影像学检查:腹部超声示肝脏上界第5肋间,肋下21 mm,剑下0 mm。包膜光滑,边缘锐利,血管显示清晰,实质回声均匀;右上腹可见一5.7 cm×5.1 cm×2.7 cm无回声肿块,形态不规则,无包膜,内部可见大小不等分隔,CDFI内部未检出血流信号。超声诊断:腹腔囊性肿物,考虑为淋巴管来源。腹部CT平扫:右上腹部可见囊性低密度包块影,边界尚清,密度较均匀,大小约5.0 cm×4.2 cm×4.7 cm,与肝右叶关系密切(图1)。腹部MRI平扫:右中上腹可见一不规则长T1长T2信号包块,信号较均匀,其内可见多发线样低信号分隔,边界尚清晰,大小约5.5 cm×5.4 cm×4.1 cm,病变与肝下缘及周围肠管关系密切(图2)。MRI诊断:右中上腹多房囊性包块。实验室检查:肿瘤标志物AFP 630 ng/mL。肝炎病毒、梅毒、艾滋病毒及TORCH检查结果均正常。根据患儿病史、查体及辅助检查结果,初步诊断为右上腹囊性肿物。
患儿于全身麻醉下行开腹探查术,术中见该腹腔肿物来自肝脏右叶,以囊性为主,大小约5 cm×5 cm×4 cm,呈外生性生长,沿肿物边缘行肝脏右叶囊性肿物切除术。病理检查可见囊壁衬覆单层粘液柱状上皮及立方上皮细胞,其下可见粘液性纤维间质,周围可见空泡样变性的肝脏细胞及扩张的淋巴管(图3)。免疫组化结果:EMA(+),CD34部分(+),CD31部分(+),D2-40部分(+)。病理诊断为肝内胆管囊腺瘤。
患儿术后病情逐渐恢复,无并发症出现。门诊随访3年生长发育正常,腹部超声检查未见肿瘤复发征象。
图1 腹部CT示右上腹部可见囊性低密度包块影,边界尚清,密度较均匀,与肝右叶关系密切图2腹部MRI示右中上腹可见一不规则长T1长T2信号包块,信号较均匀,其内可见多发线样低信号分隔,边界尚清晰,病变与肝下缘及周围肠管关系密切图3镜下所见:囊壁衬覆单层粘液柱状上皮及立方上皮细胞,其下可见粘液性纤维间质,周围可见空泡样变性的肝脏细胞及扩张的淋巴管(HE染色,×200)
Fig.1 Abdominal CT showed a low-density cystic mass in the right upper abdomen with clear boundary and uniform density,closely related to the right lobe of the liverFig.2 Abdominal MRI showed an irregular mass in the right middle and upper abdomen.The mass was uniform and boundary was clear.Linear low signal septations were seen in the mass.The lesion was closely related to the liver and the surrounding intestineFig.3 Microscopically,the cyst wall is lined with a single layer of mucous columnar epithelium and cuboidal epithelium.Mucus fibrous stroma is visible beneath it.Vacuolar degeneration of hepatocytes and dilated lymphatic vessels are visible.(HE,×200)
通过PubMed及万方数据库检索关键词“肝内胆管囊腺瘤/肝胆管囊腺瘤(Intrahepatic biliary cystadenoma/ Hepatobiliary cystadenoma)”,本研究纳入文献发表时间截至2018年6月。
既往已发表文献中共有13例儿童肝内胆管囊腺瘤病例,结合笔者收治的1例,本研究一共分析了14例患儿的临床资料(见表1)。其发病年龄从38 d到16岁(中位年龄4.7岁),男9例,女5例。临床主要症状为腹部肿块(6例)及腹胀(3例),其他包括黄疸(2例)、腹痛(1例)、恶心(1例)、呕吐(1例)、食欲减退(1例)及便秘(1例)。也有患儿最初无明显症状,通过检查意外发现(3例)。术前诊断肝脏囊性肿物8例,腹部囊性肿物3例,肝脏间质错构瘤2例,结核性腹水1例(该例为早期病例,未行超声、CT等辅助检查)。肝内胆管囊腺瘤位于肝脏左叶8例,位于右叶5例,位于肝左右两叶1例。行肝脏肿物部分切除术1例,肿物剜除术1例,肿物完整切除术4例,肝左外叶切除术4例,左半肝切除术2例,右半肝切除术1例。肝脏左右两叶均受累的患儿Ⅰ期行肿物部分切除及去顶减压术,后行肝动脉栓塞术,待肿瘤缩小后行肝脏肿物完整切除术。除1例早期患儿术后因心力衰竭死亡外,其他患儿术后均恢复良好,无一例复发。
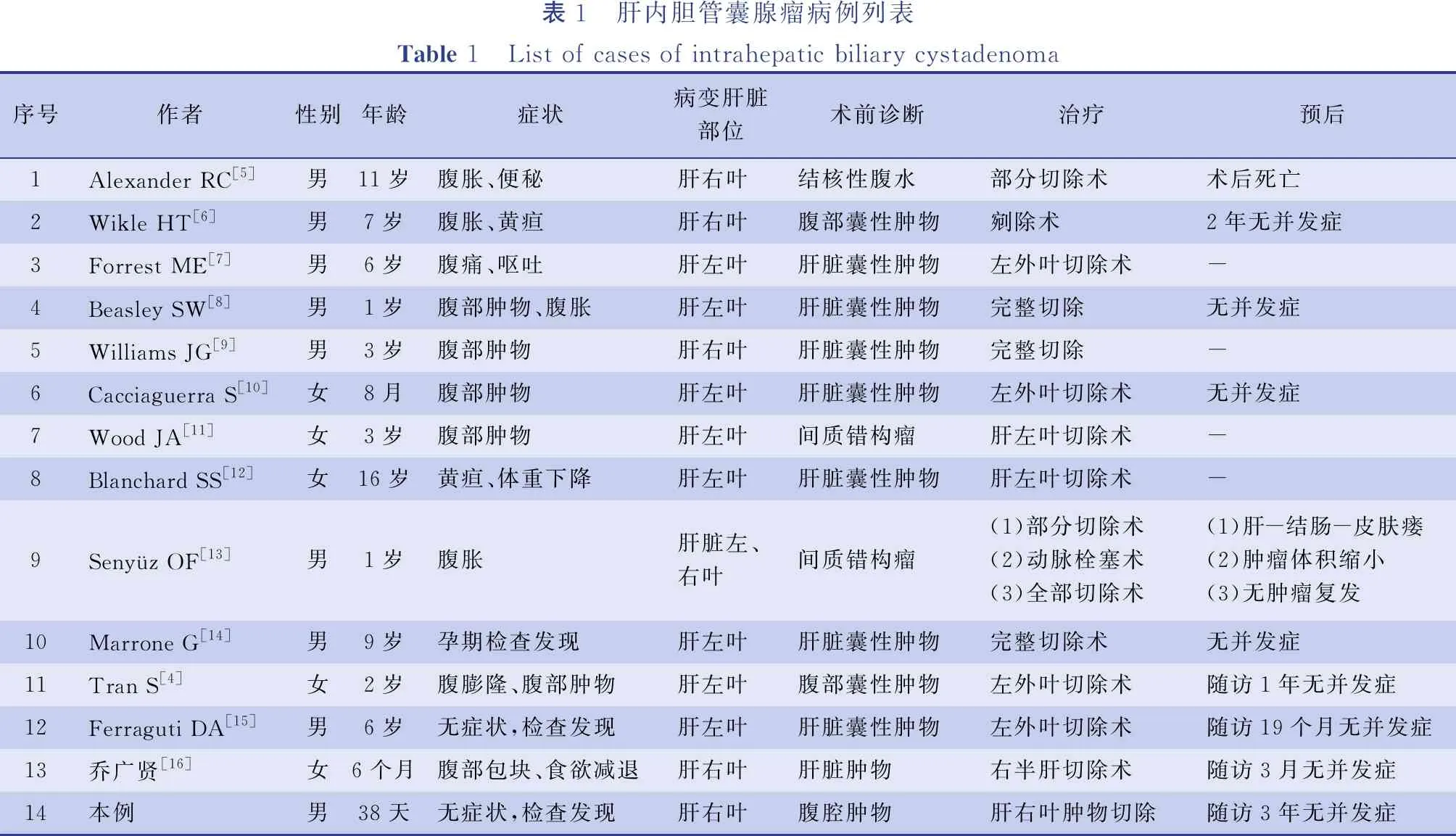
表1 肝内胆管囊腺瘤病例列表Table 1 List of cases of intrahepatic biliary cystadenoma序号作者性别年龄症状病变肝脏部位术前诊断治疗预后1Alexander RC[5]男11岁腹胀、便秘肝右叶结核性腹水部分切除术术后死亡2Wikle HT[6]男7岁腹胀、黄疸肝右叶腹部囊性肿物剜除术2年无并发症3Forrest ME[7]男6岁腹痛、呕吐肝左叶肝脏囊性肿物左外叶切除术-4Beasley SW[8]男1岁腹部肿物、腹胀肝左叶肝脏囊性肿物完整切除无并发症5Williams JG[9]男3岁腹部肿物肝右叶肝脏囊性肿物完整切除-6Cacciaguerra S[10]女8月腹部肿物肝左叶肝脏囊性肿物左外叶切除术无并发症7Wood JA[11]女3岁腹部肿物肝左叶间质错构瘤肝左叶切除术-8Blanchard SS[12]女16岁黄疸、体重下降肝左叶肝脏囊性肿物肝左叶切除术-9Senyüz OF[13]男1岁腹胀肝脏左、右叶间质错构瘤(1)部分切除术(2)动脉栓塞术(3)全部切除术(1)肝-结肠-皮肤瘘(2)肿瘤体积缩小(3)无肿瘤复发10Marrone G[14]男9岁孕期检查发现肝左叶肝脏囊性肿物完整切除术无并发症11Tran S[4]女2岁腹膨隆、腹部肿物肝左叶腹部囊性肿物左外叶切除术随访1年无并发症12Ferraguti DA[15]男6岁无症状,检查发现肝左叶肝脏囊性肿物左外叶切除术随访19个月无并发症13乔广贤[16]女6个月腹部包块、食欲减退肝右叶肝脏肿物右半肝切除术随访3月无并发症14本例男38天无症状,检查发现肝右叶腹腔肿物肝右叶肿物切除随访3年无并发症
讨论该病病因迄今不明,早期报道表明,肿瘤的产生和增长与病毒感染引起的炎症损伤有关,亦有学者发现肿瘤组织雌激素受体水平比周围肝组织显著增高;此外,口服避孕药的女性停止口服药物后,其肿块明显缩小[17,18]。但这不能很好地解释儿童患者(尤其年龄<2岁患儿)发病原因。目前普遍接受的理论是本病源于先天性胆管畸形(即本病是由于胚胎发育异常形成的肝内迷走胆管炎性增生或因液体潴留囊性扩张所致);胚胎时期原始前肠在肝内退化后残余组织异常增生;起源于肝内胚胎性胆囊组织的异位卵巢[17]。有研究认为小儿肝内胆管囊腺瘤与胆道、呼吸道、消化道及泌尿生殖道畸形均具有关联性[15]。
肝内胆管囊腺瘤无特殊临床表现,可无任何症状、体征,也可为一般性的腹部不适、腹部膨隆、上腹部钝痛、饱胀感、恶心、消化不良、呕吐及黄疸等表现。当肿物压迫肝组织、肝外胆管及血管时,会产生相应的症状(如腹痛、大便颜色变浅、皮肤黄染及尿色加深等)。是否产生压迫症状与肿瘤大小关系不明确,有病例报道患者肿物直径25 cm,但患者除腹部膨隆外,无任何不适及异常[15]。罕见症状包括囊内出血、囊肿破裂和感染[19]。已报道的13例患儿主要因腹部膨隆或无症状的腹部肿块就诊[4]。
文献报道的13例患儿几乎均由腹部X线片、超声和CT发现。由于肝内胆管囊腺瘤患儿例数太少,至今没有发现其影像学或者实验室检查特异性表现,导致术前几乎均不能确诊。一般认为:如果B超检查肝内占位呈囊性且伴有分隔,囊液有絮状回声,囊壁不光滑尤其有突起的时候需要考虑肝内胆管囊腺瘤。CT占位性病变表现为多房性,囊壁呈不规则增厚,囊内有增强的薄分隔,壁上有结节状突起和局部钙化,可考虑肝内胆管囊腺瘤。MRI 表现为囊壁、分隔、壁结节及实性部分均呈T1WI 稍低信号、T2WI 稍高信号,囊内液性部分均呈T1WI 低信号、T2WI 高信号[20,21]。有学者认为血清肿瘤标志物CA-199和CEA为有诊断意义的检查,但成人患者中,部分患者血清CA199与CEA并不升高,也有学者研究发现对于该病而言,囊液中CA199及CEA水平较血清具有更为优质的诊断意义[19]。报道的儿童患者中无论血常规、肝功能、凝血功能还是血清AFP均正常。部分患儿检测CEA及CA199均呈阴性结果。由于该病临床表现、实验室检查及影像学上均无特异性,故极易误诊为其他疾病。
在儿童中,该病通常需与肝囊肿、肝间叶性错构瘤、肝包虫病及肝未分化胚胎肉瘤鉴别: ①肝囊肿:可多发(但无多房表现),壁薄,厚度均匀,增强后病灶不强化。无分隔、结节。②肝间叶性错构瘤:在CT及MRI上也可表现为有间隔的多房囊性肿块,囊肿大,但大部分为实体。③肝包虫病:患儿通常有牧区疫区生活史,病灶多发,母囊内可见子囊,可出现“飘带征” 、“双边征”,囊壁可见蛋壳样钙化;实验室检查外周血嗜酸性粒细胞增高、肝包虫血清抗体阳性有助于其诊断。④肝未分化胚胎肉瘤:表现为有间隔的多房囊性肿块,CT 与B 超检查表现不一致是肝未分化胚胎肉瘤的重要特点,但术前与肝内胆管囊腺瘤鉴别困难[20,22,23]。本例患儿因B超检查发现腹部肿瘤,但被误诊为腹部淋巴管瘤,而CT平扫仅显示腹腔囊性肿物。腹部MRI平扫示囊肿内可见多发线样低信号分隔,边界尚清晰,这与其他文献描述基本一致。实验室检查发现AFP明显升高,余均正常,考虑AFP升高原因为患儿为新生儿,处于生理性AFP升高期,这与其他文献报道基本一致。
肝内胆管囊腺瘤明确诊断必须依靠病理学检查。我国学者报道该肿瘤的病理特征包括: ①位于肝脏包膜下单个肿块,界限清楚; ②病灶可见大量增生的小胆管,小胆管上皮细胞分化良好,无明显异型性,罕见核分裂象,伴广泛慢性炎细胞浸润; ③病变内无扩张的胆管,管腔内无胆汁; ④免疫组化Ki-67和p53阴性,CKl9、CK7和CK56阳性[21]。根据囊液性质分为黏液型和浆液型囊腺瘤。较多学者根据囊肿衬覆立方或柱状上皮下的基质类型将其分为三种亚型: ①Ⅰ型:显微镜下可见致密的卵巢样间充质基质,此为最常见类型,仅发生于平均年龄40岁左右的妇女,为良性肿瘤,基本无恶变倾向; ②Ⅱ型:显微镜下无卵巢样基质,其特征在于没有间充质层,但具有透明的纤维性粘液样基质,在平均年龄为50岁的男性中更常见,有恶变倾向; ③Ⅲ型:镜下也缺乏卵巢样间充质基质,但囊腺瘤内为与肝细胞相似的嗜酸性上皮细胞,此型最少见,为交界性肿瘤,仅发生于男性[4,24,25]。该患儿标本显微镜下可见囊壁衬覆单层粘液柱状上皮及立方上皮细胞,其下可见粘液性纤维间质,周围可见空泡样变性的肝脏细胞及扩张的淋巴管,应属于Ⅱ型,具有恶变倾向,定期门诊复查目前尚未见肿瘤复发。
既往,肝内胆管囊腺瘤的治疗方法包括简单的抽吸、引流、营养动脉栓塞、部分切除和完全切除。最近研究表明,虽然Ⅰ型肝内胆管囊腺瘤基本无恶变倾向,但逐渐进展仍可形成巨大占位,Ⅱ型及Ⅲ型均有恶变倾向,故主张此类肿瘤均行手术治疗。由于残留病灶可引起复发或者恶变,故肿瘤必须完全切除。在成人中若瘤体未完整切除,则肝内胆管囊腺瘤复发率可高达90%,恶变率约20%,故完全切除病灶已经被广泛接受[15,19]。有研究曾报道1例巨大囊腺瘤患儿,首先在影像学帮助下栓塞肿瘤的营养动脉,待瘤体缩小后再行手术完全切除,预后良好,其余报道的儿童患者均采取开腹手术,成人中已开展腹腔镜下囊肿完整切除术[13,26]。据报道成人术后出现的并发症包括腹腔内出血、胆瘘、感染等,均予以积极治疗后治愈[19]。儿童患者术后尚未见并发症报道。本患儿术前诊断不明,术中发现肝脏右叶囊性占位性病变,行肝脏右叶囊性肿物切除术,术后恢复良好,无并发症发生。术后随访至今生长发育良好,未见肿瘤复发。
肝内胆管囊腺瘤是儿童非常罕见的肝脏肿瘤,因临床表现缺乏特异性常导致误诊,治疗时应完整切除,避免肿瘤复发及恶变。在临床工作中,对于肝脏囊性肿物我们应该考虑到肝内胆管囊腺瘤的可能性,以期获得更好的治疗效果。

