儿童胸膜肺母细胞瘤38例诊治分析
张 旭 曾 骐 张 娜 陈诚豪 于 洁
胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)在组织胚胎学和疾病分类上等同于神经母细胞瘤,是一种罕见的、具有侵略性的儿童原发性恶性胸腔内肿瘤,可发生于肺、胸膜,也可同时发生于二者[1]。与成人肺母细胞瘤不同,儿童胸膜肺母细胞瘤缺乏恶性上皮细胞成分,只有间叶成分为肿瘤性。PPB的临床表现缺乏特异性,影像学表现不典型,难以与先天性肺囊性病区分[2]。近年来国内外PPB的发病率均有增高趋势,由于儿童肺部恶性肿瘤较为罕见,症状不典型,因此PPB的漏诊率、误诊率均较高。按病理类型PPB可分为3种,分别是Ⅰ型(囊性)、Ⅱ型(囊实性)和Ⅲ型(实性);Ⅰr型为Ⅰ型PPB的一种特殊类型,此型无上皮下恶性细胞聚集。纯囊性PPB(Ⅰ型和Ⅰr型)的预后较Ⅱ型和Ⅲ型好[3-6]。Ⅰ型和Ⅰr型PPB的5年生存率(91%)和无瘤生存率(82%)较高,但有可能进展为Ⅱ型或Ⅲ型PPB。Ⅱ型和Ⅲ型PPB本质为侵袭性恶性肿瘤,5年生存率和无瘤生存率较低,分别为:Ⅱ型(71%、59%),Ⅲ型(53%、37%)[7]。近年来研究发现并证实,PPB的发生与DICER1基因突变有关,PPB是DICER1胸膜肺母细胞瘤家族性肿瘤易感综合征的标志性疾病之一[8-13]。PPB的治疗方法包括手术、化疗和(或)放射治疗,完整的手术切除是PPB患儿治疗的主要目标,辅助治疗一直用于更具侵袭性的Ⅱ型或Ⅲ型病变患者,但研究显示化疗可降低复发风险,并改善Ⅰ型病变儿童的预后。
由于本病的发病率低,容易误诊、漏诊,且预后差,早期诊断和完整切除对于改善本病预后至关重要,可以为患者提供长期生存机会。本研究旨在通过回顾性分析国家儿童医学中心首都医科大学附属北京儿童医院胸外科收治的PPB患儿临床资料,分析PPB的发病年龄、临床表现、病理类型、危险因素、治疗方式及预后情况,以降低其误诊、漏诊率,为本病的早期发现、及时干预提供参考依据。
材料与方法
一、临床资料
2002年3月至2018年3月首都医科大学附属北京儿童医院收治PPB患儿38例,其中男18例,女20例,确诊时年龄18~156个月,中位诊断年龄37个月。其中,首诊诊断肺囊性病5例(13.2%),肺大泡1例(2.6%),肺脓肿1例(2.6%),呼吸道感染6例(15.8%),胸腔积液3例(7.9%),气液胸1例(2.6%),脓胸1例(2.6%),纵隔肿瘤10例(26.3%,考虑神经母细胞瘤2例、淋巴瘤1例),肺占位3例(7.9%),胸腔占位7例(18.4%,考虑肉瘤1例)。首诊考虑非肿瘤性病变者达47.4%。Ⅰ型、Ⅱ型、Ⅲ型PPB的首诊误诊率分别为100%(4/4)、58.3%(7/12)、31.8%(7/22),见表1。从出现症状到手术/化疗干预的时间为5~210 d,中位干预时间15 d,Ⅰ型PPB从出现症状到手术/化疗中位干预时间长达90 d。
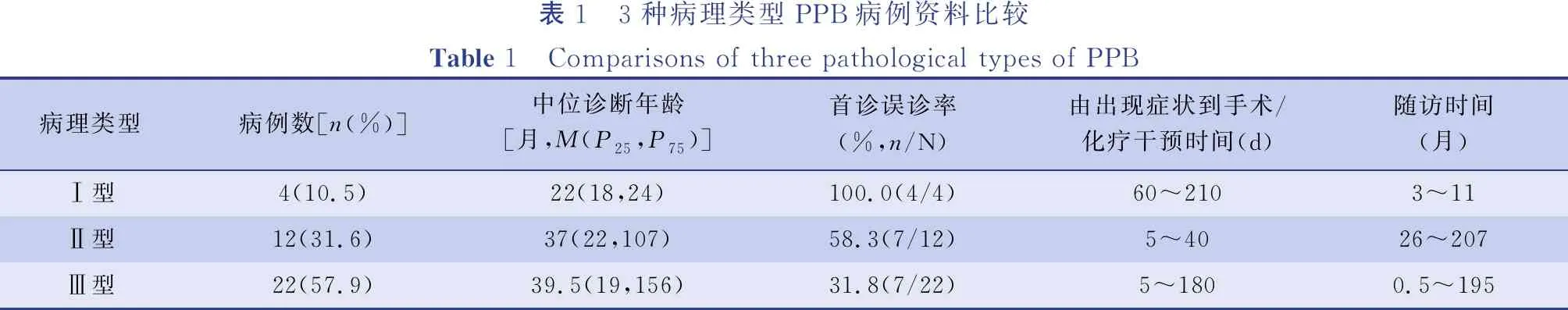
表1 3种病理类型PPB病例资料比较Table 1 Comparisons of three pathological types of PPB病理类型病例数[n(%)]中位诊断年龄[月,M(P25,P75)]首诊误诊率(%,n/N)由出现症状到手术/化疗干预时间(d)随访时间(月)Ⅰ型4(10.5)22(18,24)100.0(4/4)60~2103~11Ⅱ型12(31.6)37(22,107)58.3(7/12)5~4026~207Ⅲ型22(57.9)39.5(19,156)31.8(7/22)5~1800.5~195
二、研究方法
采用SPSS20.0进行统计学分析。描述性统计中,计数资料采用频数和构成比描述;计量资料因大多不服从正态分布,故采用中位数及四分位间距描述。
结 果
一、临床表现
本组病例中,患儿临床表现多样,包括咳嗽、发热、呼吸困难、呕吐、体表包块、胸痛、腹痛、背痛、饮水呛咳等,可以看出本病临床症状不典型,难以确诊,从出现症状到手术或化疗干预时间较长。
二、病理分型
PPB可分为Ⅰ型、Ⅱ型、Ⅲ型3种病理类型。本组病例中,Ⅰ型4例,诊断时年龄18~24 个月,中位诊断年龄22个月;Ⅱ型12例,诊断时年龄22~107个月,中位诊断年龄37个月;Ⅲ型22例,诊断年龄19~156 个月,中位诊断年龄39.5个月。
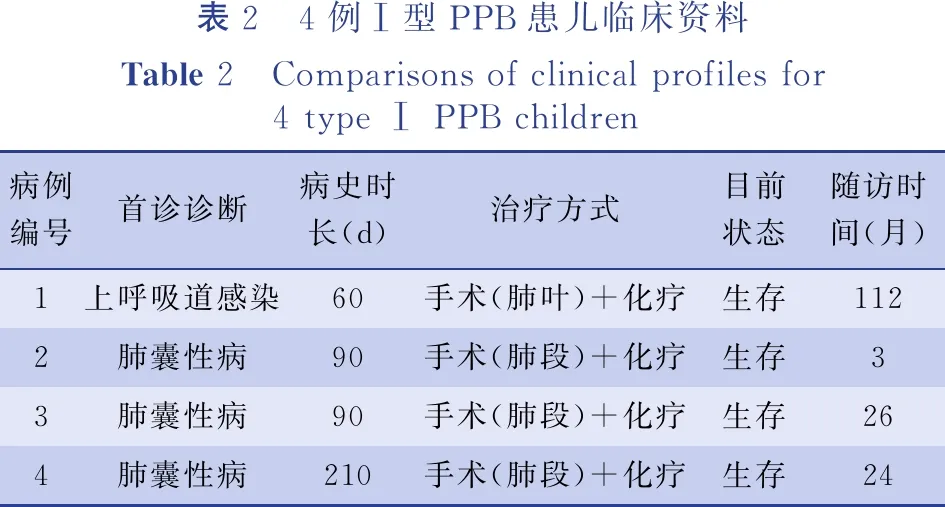
表2 4例Ⅰ型PPB患儿临床资料Table 2 Comparisons of clinical profiles for 4 type Ⅰ PPB children病例编号首诊诊断病史时长(d)治疗方式目前状态随访时间(月)1上呼吸道感染60手术(肺叶)+化疗生存1122肺囊性病90手术(肺段)+化疗生存33肺囊性病90手术(肺段)+化疗生存264肺囊性病210手术(肺段)+化疗生存24
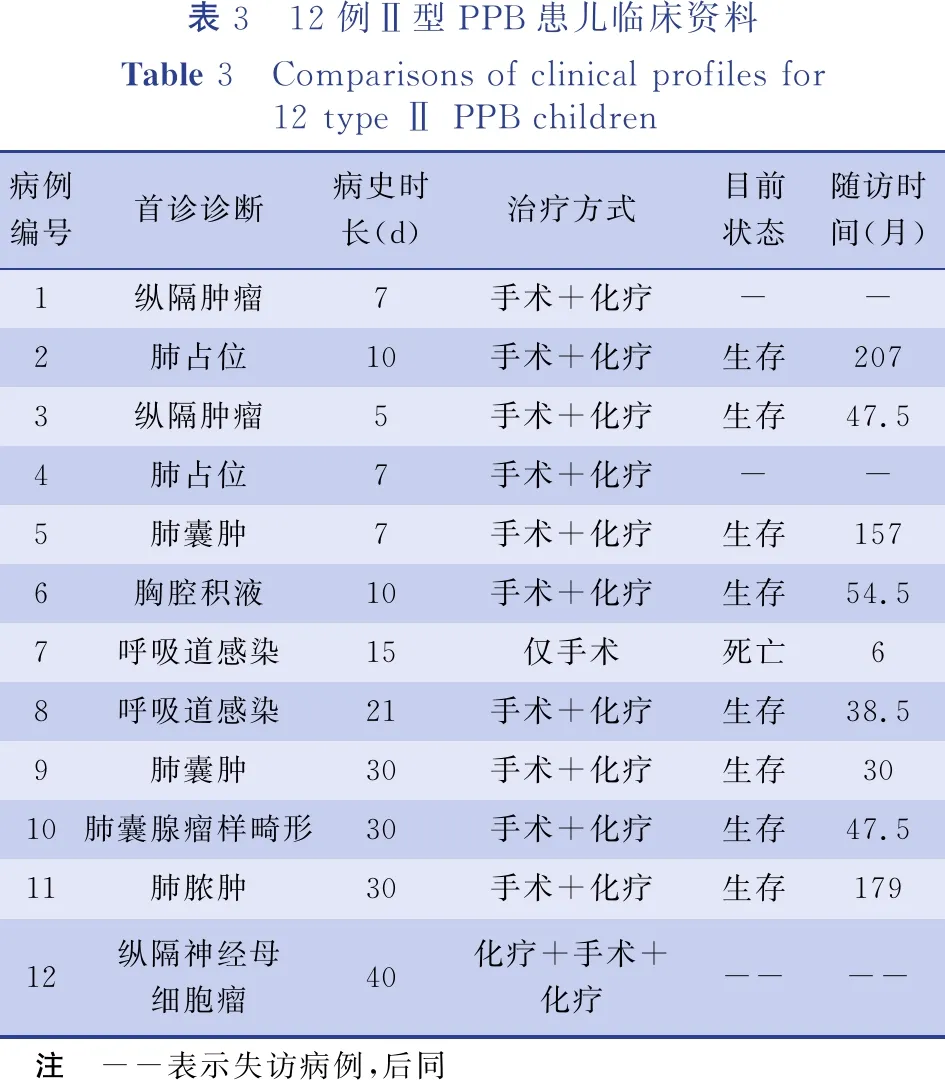
表3 12例Ⅱ型PPB患儿临床资料Table 3 Comparisons of clinical profiles for 12 type Ⅱ PPB children病例编号首诊诊断病史时长(d)治疗方式目前状态随访时间(月)1纵隔肿瘤7手术+化疗--2肺占位10手术+化疗生存2073纵隔肿瘤5手术+化疗生存47.54肺占位7手术+化疗--5肺囊肿7手术+化疗生存1576胸腔积液10手术+化疗生存54.57呼吸道感染15仅手术死亡68呼吸道感染21手术+化疗生存38.59肺囊肿30手术+化疗生存3010肺囊腺瘤样畸形30手术+化疗生存47.511肺脓肿30手术+化疗生存17912纵隔神经母细胞瘤40化疗+手术+化疗---- 注 --表示失访病例,后同
三、合并症
本组38例中合并胸腔积液10例(其中4例需行胸腔闭式引流以缓解症状;6例无明显症状,在辅助检查中发现),气胸1例,气液胸2例(均需行胸腔闭式引流缓解症状),心包积液1例。
四、既往病史及家族史
1例影像学检查提示双肺多发囊性病灶;1例于3年前行同侧囊性腺瘤样畸形切除术(肺段切除),1例于2年前行对侧先天性肺气道畸形(Ⅱ型)切除术(肺段切除),这2例患儿既往接受手术前均有气胸史。1例既往行同侧脓胸手术治疗;1例母亲患有甲状腺结节;1例母亲患甲状腺肿,祖父曾患胸腔积液。
五、治疗方式
手术后化疗24例,手术前化疗5例(按神经母细胞瘤方案化疗后接受手术者2例,化疗后瘤体均有缩小),仅接受手术治疗者3例,手术联合中药治疗1例,自动出院3例(活检后出院),早期死亡2例(活检后死亡)。
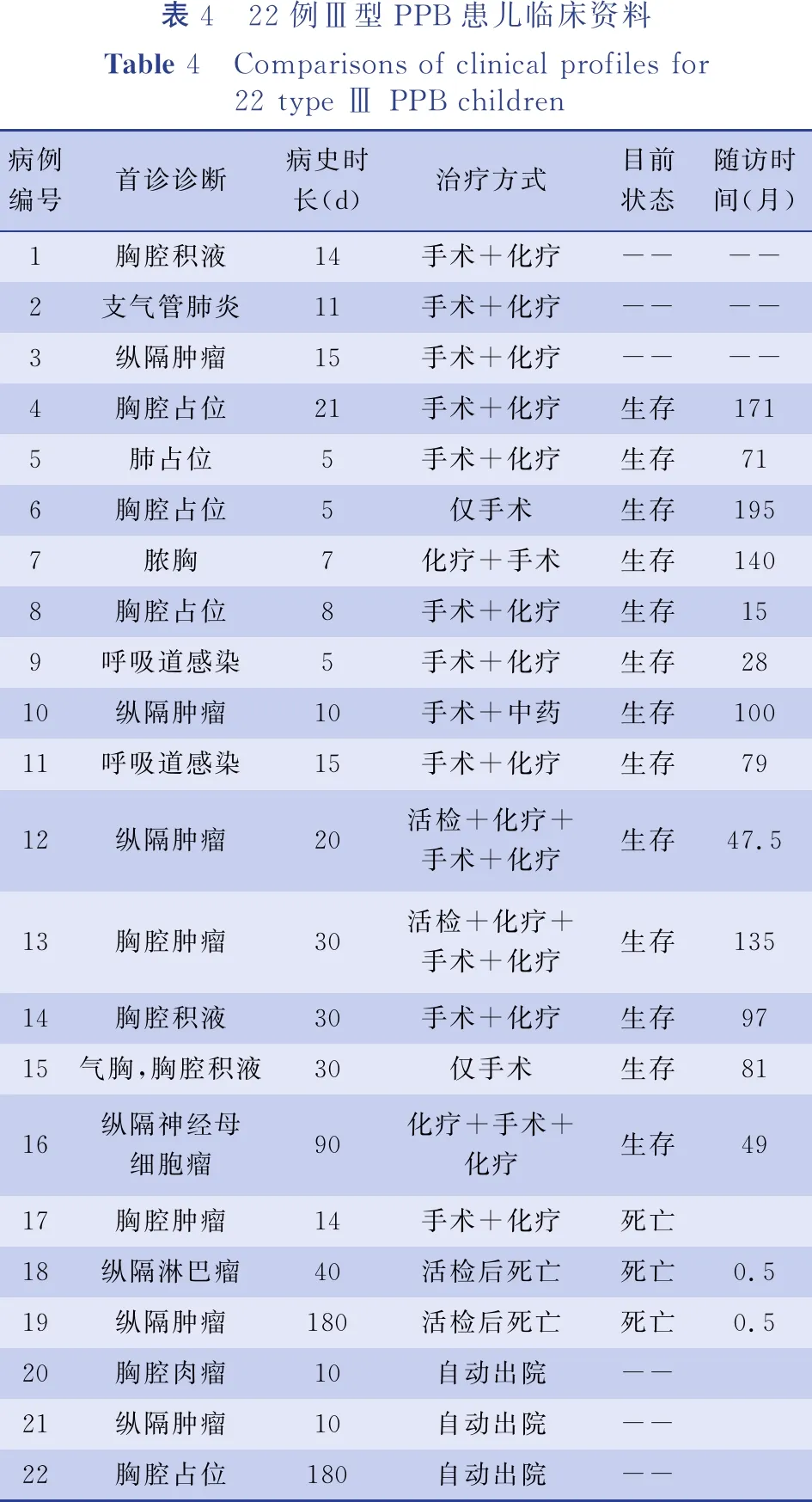
表4 22例Ⅲ型PPB患儿临床资料Table 4 Comparisons of clinical profiles for 22 type Ⅲ PPB children病例编号首诊诊断病史时长(d)治疗方式目前状态随访时间(月)1胸腔积液14手术+化疗----2支气管肺炎11手术+化疗----3纵隔肿瘤15手术+化疗----4胸腔占位21手术+化疗生存1715肺占位5手术+化疗生存716胸腔占位5仅手术生存1957脓胸7化疗+手术生存1408胸腔占位8手术+化疗生存159呼吸道感染5手术+化疗生存2810纵隔肿瘤10手术+中药生存10011呼吸道感染15手术+化疗生存7912纵隔肿瘤20活检+化疗+手术+化疗生存47.513胸腔肿瘤30活检+化疗+手术+化疗生存13514胸腔积液30手术+化疗生存9715气胸,胸腔积液30仅手术生存8116纵隔神经母细胞瘤90化疗+手术+化疗生存4917胸腔肿瘤14手术+化疗死亡18纵隔淋巴瘤40活检后死亡死亡0.519纵隔肿瘤180活检后死亡死亡0.520胸腔肉瘤10自动出院--21纵隔肿瘤10自动出院--22胸腔占位180自动出院--
于本院接受手术者23例,其中开胸手术20例,胸腔镜手术2例,胸腔镜中转开胸手术1例(胸腔镜切除肿物后发现其内为烂肉样物质,故开胸切除肺叶);开胸手术23例中,因外院手术后存在残留病灶行二次手术2例。肿瘤最大直径范围为2~18 cm,中位最大直径10 cm;手术时间25~210 min,中位手术时间95 min;术中出血量2~500 mL,中位术中出血量45 mL(1例因出血量达500 mL术中行胸膜剥脱术)。
化疗方案包括:异环磷酰胺(ifosfamide,IFO)+长春新碱(vincristine,VCR)+放线菌素D(actinomycin D),即IVA方案;异环磷酰胺(IFO)+长春新碱(VCR)+放线菌素D(actinomycin D)+阿霉素(doxorubicin),即IVADo方案;长春新碱(VCR)+放线菌素D(actinomycin D)+环磷酰胺(cyclophosphamide,CTX),即VAC方案;异环磷酰胺(Ifosfamide)+长春新碱(VCR)+阿霉素(doxorubicin),即IDA方案;长春新碱(VCR)+阿霉素(doxorubicin)+环磷酰胺(CTX);长春新碱(VCR)+阿霉素(doxorubicin)+环磷酰胺(CTX)+放线菌素D (actinomycin D);长春新碱(VCR)+阿霉素(doxorubicin)+环磷酰胺(CTX)+放线菌素D(actinomycin D)+顺铂(cisplatin DDP);长春新碱(VCR)+环磷酰胺(CTX)+放线菌素D(actinomycin D);顺铂(cisplatin DDP)+依托泊苷(etoposide,VP-16)。
六、组织病理学特征
PPB是一种原发性恶性胸腔内肿瘤,可发生于肺、胸膜,或同时发生于二者。本组病例中于我院行手术23例,术中见肿瘤来源于肺叶13例,来源于胸膜8例,来源不详2例。Ⅰ-Ⅲ型PPB组织病理学特征见图1至图3。
图1 Ⅰ型PPB病理学检查结果(染色:HE,4X),可见囊状改变,上皮下可见深染细胞聚集
图2Ⅱ型PPB病理学检查结果(染色:HE,4X),可见肿瘤细胞出血、坏死,可见深染细胞增生图3Ⅲ型PPB病理学检查结果(染色:HE 4X),可见肿瘤细胞出血、坏死,可见细胞质稀疏的原始胚芽灶,基质不致密
Fig.1 Type Ⅰ PPB (stain: HE,4X)Fig.2 Type Ⅱ PPB (stain: HE,4X)Fig.3 Type Ⅲ PPB (stain: HE 4X)
七、预后
本组38例中,自动出院3例,失访6例。剩余有随访资料的29例患儿中,目前存活25例,死亡4例。Ⅰ型、Ⅱ型、Ⅲ型PPB患儿的5年生存率和5年无瘤生存率分别为100.0%和100.0%、66.7%和66.7%、66.7%和55.6%,总体5年无瘤生存率为69.2%。生存曲线见图4。
讨 论
一、PPB误诊率高
胸膜肺母细胞瘤是一种罕见的儿童恶性肿瘤,临床表现缺乏特异性,影像学表现难以与先天性肺囊性病区分。从上述数据可以看出,PPB的误诊率、漏诊率均较高,由出现症状至手术/化疗干预、治疗的时间长。从文献报道及我们的治疗经验发现,近几年PPB的发病率逐渐上升,早期诊断、早期干预治疗对改善PPB的预后有很大帮助。
二、不同病理类型PPB病例的特点
1995年Dehner 等[14]将胸膜肺母细胞瘤分为3种病理类型:Ⅰ型(囊性)、Ⅱ型(囊实性)和Ⅲ型(实性)。Ⅰ型:镜下可见圆形或椭圆形的囊状物,内衬立方或柱状纤毛上皮;上皮下可以有连续或不连续的典型圆形或梭形原始细胞层聚集;另外,找到不成熟的软骨结节时应高度怀疑胸膜肺母细胞瘤。Ⅱ型:镜下囊性表现同Ⅰ型,实性同Ⅲ型,肿瘤有原始胚芽,或梭形恶性细胞在囊壁上斑片状或结节状增生,或上皮内存在横纹肌肉瘤样细胞。Ⅲ型:镜下由细胞质稀疏的原始胚芽灶组成,圆形或卵圆形细胞核内有颗粒状染色质,核仁不明显,可见有丝分裂频繁;基质不致密、呈纤维状并混合肉瘤成分;肉瘤成分由梭形细胞增生聚集呈束状,细胞核过度增生、形态异常、染色过深,可见散在多形变异的巨细胞、横纹肌肉瘤样细胞单个或成群、成片的存在,也可见透明软骨。
本组病例中Ⅰ型、Ⅱ型、Ⅲ型PPB的诊断年龄与病例数递增、生存率下降的趋势与国际研究结果大致相同,Ⅲ型PPB病例数量较多可能与其发病隐匿、临床症状不典型、误诊率及漏诊率高、病程时间长(多经反复内科治疗效果欠佳或出现占位压迫症状才发现)、病理类型发生进展有关。
文献报道PPB具有由Ⅰ型向Ⅱ型、Ⅲ型逐渐进展的可能[3-5]。但本组病例没有发现PPB病理类型进展的证据,可能与Ⅰ型病例数较少有关,也可能与病程时间长、诊断时已经进展为Ⅱ型或Ⅲ型有关。
三、PPB的治疗
本组38例中,3例放弃治疗,2例早期死亡,其余33例均行手术治疗。手术联合化疗共29例,目前生存22例,死亡1例,失访6例。仅行手术治疗3例,目前生存2例,死亡1例。手术后采用中药治疗1例,目前存活。完整手术切除对于改善PPB的预后有至关重要的作用,因此条件允许的情况下,建议尽早完整手术切除病灶。
儿童PPB 是一种高侵袭性恶性肿瘤,一旦确诊应早期完整切除。对于肿瘤巨大无法完整切除的患儿,可先行穿刺活检或手术活检,明确病理后经4~8个化疗疗程使肿瘤体积缩小,再进行根治性手术。术中需要保护好肿瘤周围重要组织、血管及神经,注意周围肺、胸膜、膈肌处是否有转移瘤组织。手术的方式目前仍存在一定的争议,手术方式取决于病变范围,包括囊切除、肺段切除、肺叶切除或全肺切除等。目前还未见这些手术方式与疾病预后的关联性研究。因Ⅰ型PPB易与先天性肺囊性病相混淆(如先天性肺气道畸形、隔离肺、肺气肿、肺囊肿等),所以有些PPB术前容易误诊,手术过程中一般不会遵循肿瘤的扩大手术切除原则,但目前没有术前误诊的PPB待病理确诊后需行二次根治性手术的报道。而且文献报道中对于I型病变,切缘阴性可能是足够的,但化疗可降低复发风险并改善Ⅰ型病变儿童的预后。因此,推荐所有PPB儿童采用手术联合化疗的治疗方案[16]。本组4例Ⅰ型PPB患儿中,3例术前诊断为肺囊性病,术中行肺段切除,术后结合病理结果规律化疗,未再行扩大切除手术,目前均存活,截至本研究观察终点3例存活时间分别为3个月、24个月、26个月。反之,术前及术中怀疑PPB的病例,手术时应尽量选择病变肺叶完整切除。
PPB的化疗方案多种多样,我院多根据患儿的临床分期及病理类型使用国际胸膜肺母细胞瘤中心推荐的化疗方案,包括IVADo(异环磷酰胺+阿霉素+长春新碱+放线菌素D)和IVA(异环磷酰胺+长春新碱+放线菌素)两种。本组病例中治疗方式以手术联合化疗为主,各种治疗方式下PPB的5年无瘤生存率为69.2%。
2014年国际胸膜肺母细胞瘤中心一篇大宗PPB病例(350例)报道结果显示,Ⅰ型、Ⅱ型、Ⅲ型PPB的5年生存率和无瘤生存率分别为91%和82%、71%和59%、53%和37%。本组中3种病理类型PPB患儿的5年生存率(100.0%,66.7%,66.7%)和5年无瘤生存率(100.0%,66.7%,55.6%)均高于其他研究报道结果(图4),可能与本组数据较少、部分病例失访有关。另外,我院早期经治的PPB患儿(未包含在本组病例中)生存时间很长,可追踪的病例最长生存时间为240个月。由此可见,PPB经治疗预后较为理想,因此建议PPB诊断后应该积极治疗。
四、PPB的危险因素
文献报道PPB的危险因素包括:气胸、双边或涉及多个肺段的囊性病变以及DICER1基因突变,并且PPB可以与肺囊性病变伴发存在[2]。本组病例中14例术前合并气胸和(或)胸腔积液,6例需术前行胸腔闭式引流缓解症状,1例影像学检查提示双肺多发囊性病灶,2例既往有肺囊性病手术史(1例同侧,1例对侧),2例母亲患有甲状腺疾病,这和文献中与PPB相关的危险因素一致。对于没有症状的肺部囊性病变是否需要手术切除一直存在争议,但Ⅰ型PPB难以与肺囊性病区分,本组病例中4例Ⅰ型PPB术前诊断均为肺囊性病。因此,对于肺囊性病变建议手术切除。
五、PPB与DICER1基因突变
文献报道[8-13],PPB与DICER1基因突变有关,且常与其他肿瘤相关,是一类家族性综合征的标志。我院曾对12例PPB患儿进行DICER1基因分析,对其父母及一级亲属进行了DICER1基因突变测试,其中有7例DICER1基因发生突变,有2例DICER1基因突变患儿在诊断PPB之前患肺囊肿[15]。DICER1基因突变的外显率低,大多数突变携带者不会发展成肿瘤,因此健康的突变阳性个体需要接受有关肿瘤相关症状的教育,建议定期查胸部X线片及腹部超声,监测PPB及囊性肾瘤发生的可能性。
综上所述,儿童胸膜肺母细胞瘤起病隐匿,临床表现无特异性,容易被误诊、漏诊,Ⅰ型PPB可能会进展为预后更差的Ⅱ型和Ⅲ型PPB。推荐所有PPB儿童采用手术联合化疗的治疗方案。PPB经治疗预后尚可,建议诊断PPB后积极治疗,不要早期放弃。

