质谱成像技术在肿瘤研究中的应用进展
鞠 昀,张 洪,于 凯,姜 杰*
(1.哈尔滨工业大学(威海) 海洋科学与技术学院,山东 威海 264209;2.哈尔滨工业大学 化工和化学学院,黑龙江 哈尔滨 150001;3.哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
质谱成像(Mass spectrometry imaging,MSI)是一种新型的分子成像技术,能够可视化分析样品区域指定质量数的分子,获得样品表面待测物的相对含量及空间分布特征,已成为临床医学研究的重要利器和热点[1]。其原理是在时间维度上对样品表面进行解吸电离,获得样本各像素点中待测物的离子强度,借助成像软件重构待测物在样本中的二维或三维空间分布信息[2]。因此,MSI技术也被形象地称为“分子显微镜”[3]。近年来,MSI取得了巨大进步,已被广泛应用于生命、医学等研究领域。
恶性肿瘤已成为全球重大的公共卫生问题之一,严重威胁人类的健康。随着对肿瘤研究的不断深入,目前在发病机制等方面已取得一定进展和突破[4],寻求能够快速、高通量获得肿瘤诊断、标志物、药物研发等相关分子信息的新技术、新手段仍是当前研究的热点。近年来,分子病理结合质谱成像技术已发展成为肿瘤研究的重要方法。与其它技术相比(如正离子断层成像技术、磁共振波谱成像等),MSI无需标记或分子印染即能直接检测与肿瘤发生发展相关的代谢物、脂类等,能够获得多点、多维、高通量、可视化的分子空间信息,实现对肿瘤类型、标志物、药物代谢等方面的研究[3,5-7]。本文主要介绍MSI的基本原理、特点及其在肿瘤病理诊断、标志物及药物研究等方面的应用,并展望其潜在的发展方向。
1 质谱成像技术
MSI的工作流程一般分为3个步骤:样品制备、数据采集和数据分析。以小鼠的脊柱成像为例,首先采集样本、处理并制作组织切片(图1A);随后对样品组织进行网格划分,采用成像技术分析,得到各像素点的质谱图(图1B);最后对数据进行处理(如基线校正、差异分析),并使用成像软件进行重构,从而获得目标分子在样本中的可视化分布图(图1C)[8]。
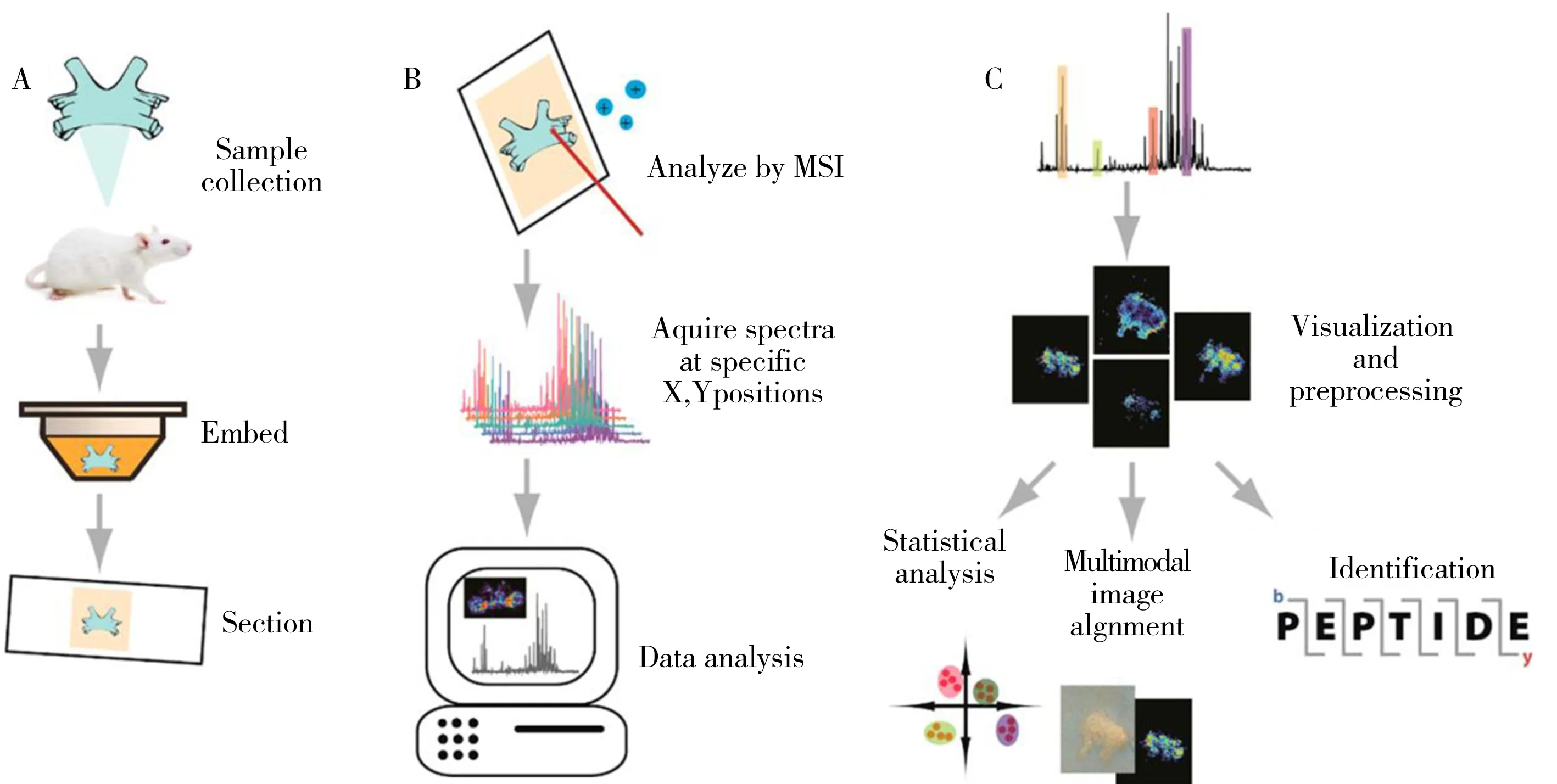
图1 质谱成像过程示意图[8]
1.1 质谱成像技术分类
离子化技术的革新推动着质谱成像技术的发展,表1总结了MSI相关离子源及特点。MSI已由早期的基质辅助激光解吸电离(Matrix assisted laser desorption ionization,MALDI)和二次离子质谱(Secondary ion mass spectrometry,SIMS)发展到无需复杂样品前处理的喷雾类(以解吸电喷雾电离(Desorption electrospray ionization,DESI)为代表)、等离子体类(以介质阻挡放电电离(Dielectric barrier discharge ionization,DBDI)为代表)以及解吸/后电离类等。

表1 常见MSI离子源、特点及其空间分辨率
(续表1)

ClassificationNameCharacteristicsSpatialresolutionReferences微型辉光放电等离子体(Micro-fabricatedglowdischargeplas-ma,MFGDP)无污染、高灵敏度、尺寸小300μm[23]解吸/后电离类激光消融电喷雾电离(Laserablationelectrosprayionization,LAESI)可实现二维/三维空间成像分析30~100μm[24-26]红外激光消融亚稳诱导化学电离(Infraredlaserablationmeta-stable-inducedchemicalionization,IR-LAMICI)红外激光提高了空间分辨率5~400μm[27]激光解吸-真空紫外单光子电离(Laserdesorptionpostioniza-tion,LDPI)电离效率高、稳定性好100μm[28]空气动力辅助离子化质谱成像(Airflowassistedionizationmassspectrometryimaging,AFAI-MSI)适合大体积样本分析、远距离传输300μm[29-30]液相微临界表面取样探针(Liquidmicrojunctionsurface-sam-pling,LMJ-SSP)探针位置与样品位置需精确调节20~210μm[31-32]
1.2 常见质谱成像技术
1.2.1 基质辅助激光解吸电离质谱成像基质辅助激光解吸电离质谱成像(MALDI-MSI)是目前应用最广泛的质谱成像技术[9]。其原理是以激光照射采用基质处理过的组织切片,基质从激光吸收能量,样品分子得到基质提供的电荷或反应离子进而发生电离。MALDI-MSI的解吸离子化过程与基质的种类、激发波长、激光照射强度等有关。MALDI-MSI是一种软电离技术,其灵敏度和盐容忍度较好,空间分辨率可达10 μm左右[10]。主要用于多肽等生物分子的分析,在不同基质辅助下也可用于药物小分子的分析。常用的基质包括2,5-二羟基苯甲酸、α-氰基-4-羟基肉桂酸、3,4-二甲氧基肉桂酸(DMCA)等[33]。
1.2.2 二次离子质谱成像二次离子质谱成像(SIMS-MSI)是利用高能初级离子束(例如Ar+、Au3+、C60+等)轰击样品表面,将初级离子的能量传递给组织表面待测物分子使其离子化,并进入质谱检测[11,34]。与MALDI-MSI相比,SIMS-MSI无需基质,空间分辨率往往小于1 μm[12]。SIMI-MSI适用于检测分子量在2 000 Da以内的物质,如小分子代谢物、脂质等,较大的分子如多肽在分析过程中易被片段化,使得灵敏度显著降低[35]。
1.2.3 解吸电喷雾电离质谱成像2004年,Cooks等在电喷雾电离基础上发展了解吸电喷雾电离(DESI),实现了常压敞开式质谱分析(Ambient ionization,AI),同时也将质谱成像分析从封闭环境拓展到大气压环境[14]。DESI的原理是在电场及鞘气作用下,形成带电微液滴并以一定的角度喷射到样品表面,溶解样品表面的待测物,使之在后续液滴作用下解离、离子化[36]。DESI-MSI的空间分辨率为200 μm左右[37],在特定条件下对溶剂组成和流速等进行优化,空间分辨率可达40 μm左右[14]。随着技术的改进,以DESI-MSI为基础的nano-DESI-MSI克服了样品表面的扩散现象,空间分辨率达到12 μm[15]。2008年,Prosolia公司推出了第一台商业化DESI分子成像仪。2019年中国科学技术大学国家同步辐射实验室潘洋等[18]开发了基于DESI的二次光电离质谱成像技术(DESI-PI-MSI),实现了对多种极性和非极性组分的高灵敏度空间成像,空间分辨率达到50 μm。
1.2.4 介质阻挡放电电离质谱成像介质阻挡放电电离源(DBDI)由张新荣等[19]于2007年提出,其原理为在两放电电极之间放置绝缘介质,施加交流电压于电极,使充满于两电极间的惰性气体或混合气体电离形成稳定的低温等离子体,从而实现对载体上待测物的解吸离子化,DBDI已应用于氨基酸、代谢物、药物小分子等的分析。Cooks和欧阳证等共同开发了低温等离子体枪(LTP)[21],等离子体在喷嘴以射流状喷出,调节电极结构可避免细丝放电,适合气、液、固等样品和较大表面分析。随后,张新荣等[20]将该方法用于质谱成像分析,空间分辨率达到250 μm左右,且可通过改变毛细管内径进一步降低。2017年,姜杰等在DBDI基础上提出了表面脱附介质阻挡放电电离源(SDDBDI),采用纳米尖端作为放电电极,质谱入口接地,在两电极间施加射频高压,从而可在质谱入口和样品表面形成稳定等离子体。直线型的电场克服了样品表面到质谱入口样品传送效率低的问题,对氨基酸及药物等的分析灵敏度提高了一个数量级,空间分辨率降至22 μm[22]。
1.2.5 解吸/后电离组合类解吸/后电离类组合方式近年来被广泛用于质谱成像分析,包括激光消融电喷雾电离(LAESI)[24]、电喷雾辅助激光解吸电离(ELDI)[38]、红外激光消融亚稳诱导化学电离(IR-LAMICI)[27]、等离子体辅助激光解吸电离(PALDI)[39]、激光解吸-真空紫外单光子电离(LDPI)[28]、空气动力辅助离子化(AFAI)[29]、液相微临界表面取样探针(LMJ-SSP)[30]等。LAESI将激光解吸和ESI结合,利用激光对样品消融解吸使待测物分子进入气相,并在ESI作用下被电离形成待测物离子,进入质谱检测[24]。LAESI不仅可以实现样本的二维分析,还可实现三维分析,空间分辨率可分别达到30~100 μm和30 μm[25-26]。IR-LAMICI将激光解吸与化学电离相结合,采用红外激光消融解吸样品表面的待测物使其进入气相,并与亚稳态的气体分子相互作用实现离子化,空间分辨率可达5 μm[27]。刘虎威等[39]将多波长激光解吸与等离子体源结合提出了PALDI质谱成像法,该方法可以在没有任何样品预处理的环境条件下完成,与其他环境MSI相比,空间分辨率有了很大的提高,达到60 μm×60 μm。LDPI采用紫外单光子电离目标物实现离子化[28],减少了基质对成像的干扰,通过解耦、解吸和电离,将电离效率的波动最小化,空间分辨率可达到100 μm。AFAI是再帕尔·阿不力孜等自主研发的新型常压敞开式离子化技术[29],该方法利用空气流实现了离子或带电液滴在大气压中的远距离传输,在质谱入口处富集带电液滴,提高了离子化效率。AFAI技术尤其适合于大体积物品分析和远距离目标物传输,空间分辨率可达300 μm[30]。LMJ-SSP[30]由两共轴的毛细管组成,溶剂通过中间的缺口萃取样品表面待测物并传递到质谱入口,在ESI或APCI作用下电离,该方法空间分辨率为20~210 μm[32]。图2为几种常见MSI离子源示意图。
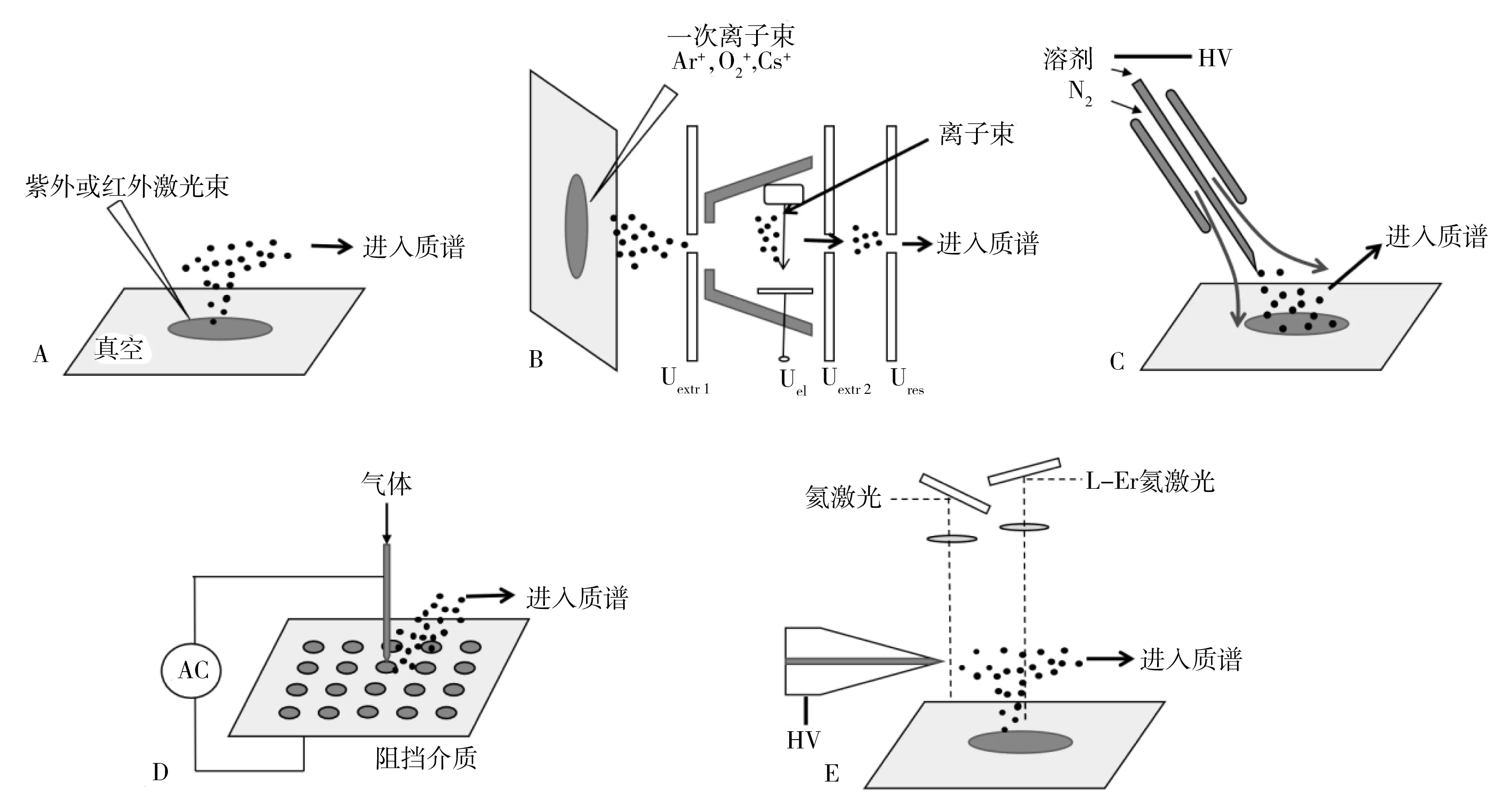
图2 几种常见MSI离子源示意图
2 MSI在肿瘤中的应用
2.1 识别肿瘤组织病理特征
获取肿瘤与正常组织的差异分子特征有助于了解肿瘤发展过程和临床治疗,MSI可用于区分病变部位中的肿瘤分布和肿瘤的病理类型,对肿瘤的临床医学诊断具有重要意义。赵南勋等[40]采用MALDI-MSI对卵巢癌组织进行成像分析,质谱成像结果与病理学结果吻合,揭示了肿瘤和正常组织及边界区域独特的多肽谱。胡勇军等[41]利用LDPI-MSI对上皮癌组织进行成像,发现肿瘤组织中叶酸信号强度明显高于邻近的正常组织,叶酸含量可以指示上皮癌组织边界。陈杰等[42]采用空气动力辅助解吸电喷雾质谱成像(AFADESI-MSI)对肺癌的癌组织和癌旁正常组织进行代谢组学分析,在癌变组织中发现了多种内源性代谢物(如磷脂、多肽、氨基酸等),为肺癌的临床诊断提供了有力方法。再帕尔·阿不力孜等[43]利用AFAI-MSI在正负模式下分别对乳腺浸润性导管癌、导管内原位癌和各种亚型进行了成像分析,结果表明浸润性导管癌的磷脂含量比导管内原位癌高,而导管内原位癌的脂肪酸含量比浸润性导管癌高,采用AFAI-MSI可以对乳腺癌进行快速鉴定分类,以指导手术切除。
2.2 肿瘤标志物筛查
MSI技术可用于检测与肿瘤发生发展相关的脂质、代谢物等,已成为识别肿瘤生物标志物的重要工具。目前,已通过MSI技术在乳腺癌[42]、甲状腺癌[44]、结肠癌[45]等癌症中发现了新的潜在生物标志物,为肿瘤诊断、转移及预后研究提供了有力依据。陈杰等[42]采用AFAI-MSI技术在正负模式下分别对乳腺肿瘤组织样品进行成像分析,筛选出29个可用于乳腺肿瘤分类的脂质分子,16个可用于乳腺肿瘤分级的脂质分子。李智立等[44]采用MALDI-MSI对恶性甲状腺癌及正常的癌旁组织中的脂类代谢物进行成像分析,结果表明磷脂酸在甲状腺癌中的分布相比于正常组织显著增多。麦富德等[45]利用MALDI-MSI对胃肿瘤组织进行成像分析,结果显示胃肿瘤组织中中性粒细胞肽1-3(HNPs 1-3)的表达水平明显高于邻近正常组织,并且主要肽HNPs-1在肿瘤组中从早期到晚期有所增加,证实HNPs 1-3对胃肿瘤病变过程具有重要意义。郭寅龙等[46]采用MALDI-MSI对甲状腺癌组织中的磷脂(PLs)和脂肪酸(FFAs)进行成像分析,发现在甲状腺癌组织中FFAs和PLs的强度明显高于甲状腺癌旁组织;采用相关性分析,发现FFAs的从头合成在甲状腺癌组织中比癌旁组织中更加活跃,进一步揭示了脂质的差异代谢与肿瘤的发生密切相关。综上表明,MSI技术无需标记即可多组分同时检测的优势对肿瘤标志物的筛查具有重要意义。
2.3 肿瘤药物研究
MSI不仅可以反应用药后各肿瘤细胞器官中药物的分布情况,还能提供药物代谢物信息及其含量变化规律,对于肿瘤药物的评估具有重要意义。鞠熀先等[47]以人乳腺癌MCF-7细胞为模型,采用MALDI-MSI研究了抗肿瘤药物阿霉素(DOX)的活性及作用,研究结果发现DOX能够促进半胱天冬酶的形成,而半胱天冬酶的激活能够诱导癌变细胞死亡。再帕尔·阿不力孜等[48]利用AFAI-MSI研究了抗肿瘤候选新药右旋娃儿藤宁碱(S-(+)-Deoxytylophorinidine,CAT)及其主要代谢物在小鼠体内的动态分布情况,实验结果表明CAT的调控、药效、毒性作用与胆碱的分布及变化密切相关。刘欣等[49]利用MALDI-MSI研究了肿瘤药物伊立替康及其代谢物在结直肠肿瘤器官(CTOs)中的空间分布,显示用药后24 h CTOs内的伊立替康由起初的边缘渗透到肿瘤中心区域,同时还发现伊立替康处理后的结直肠肿瘤的增殖明显减缓,证明了伊立替康能明显抑制结肠癌细胞的增殖。刘晓辉等[50]利用MALDI-MSI对患有脑肿瘤的小鼠进行BKM120给药处理( BKM120是一种泛Ⅰ型磷脂酰肌醇3激酶(PI3K)的小分子抑制剂),并获取了药物从脑血管渗透进入到脑实质的质谱成像结果,说明该药物能够透过血脑脊液屏障并靶向脑肿瘤区域,是脑肿瘤治疗的有效药物。Gharpure等[51]采用DESI-MSI对他莫西芬治疗卵巢癌进行研究,发现脂肪酸结合蛋白(FABP4)是参与游离脂肪酸摄取的关键物质,他莫西芬可以抑制FABP4的形成,进而抑制卵巢癌细胞的迁移。综上表明,MSI是肿瘤组织内药物传递、代谢物及作用机理等方面研究的重要工具,因其具有无需标记即可获得多组分信息的优势,为肿瘤药物的研究提供了一种新方法、新手段。
3 展 望
近年来,MSI作为一种新型的分子成像技术,在医学、药学等领域的应用备受关注。与其它技术相比(如正离子断层成像技术、磁共振波谱成像等),MSI无需标记或分子印染即能够获得多点、多维、高通量、可视化的分子空间信息,实现对肿瘤类型、标志物、药物代谢等方面的研究。通过MSI分析,可以将肿瘤样本的分子信息、等级等可视化,有助于肿瘤的诊断、治疗;并可通过可视化筛查潜在分子标志物、相关药物研究等。此外,MSI技术在术中肿瘤切除、边界确认等方面具有潜在的应用价值。
虽然MSI得到了快速的发展和应用,但以下几方面仍有待进一步研究,以便充分挖掘其分析性能和适用范围:(1)随着MSI的快速扩展,迫切需要改进样品制备水平的重现性;(2)高空间分辨率会降低检测灵敏度,可能使得某些物质信号丢失,需要优先考虑高空间分辨率还是高灵敏度;(3)质谱成像检测的通量以及时效性需进一步提升;(4)肿瘤细胞变化复杂,给筛选有效标志物带来困难,对于新发现的标志物和药物需要进行更深层次的探究和临床验证。

