电针对肝叶切除术后大鼠认知功能及海马胶质细胞的影响
刘佩蓉,张瑜,刘春亮,彭生
·动物实验·
电针对肝叶切除术后大鼠认知功能及海马胶质细胞的影响
刘佩蓉,张瑜,刘春亮,彭生
(上海中医药大学附属第七人民医院,上海 200137)
观察电针刺激对手术应激诱导大鼠认知功能的影响,并通过观察海马神经胶质细胞激活对其机制进行初步探讨。老年雄性SD大鼠72只,随机分为3组,每组24只,对照组采用假手术(sham组,S组);模型组(model组,M组)通过肝左叶切除术诱导产生认知功能障碍;电针组(Electroacupuncture组,EA组)接受肝左叶切除术和术后每日1次,每次30 min的电针刺激。Morris水迷宫评估认知功能,酶联免疫吸附法(ELISA)检测海马胶质细胞源性神经营养因子(GDNF),免疫荧光检测海马小胶质细胞标记物CD68和星形胶质细胞GFAP的表达。与M组相比较,EA组大鼠术后1 d、3 d、7 d的逃避潜伏期缩短(<0.05),跨越平台次数增加(<0.05)。与术前比较,M组和EA组大鼠术后海马GDNF水平均显著降低(<0.05)。与M组相比较,复合电针调节后的EA组术后各时间点海马组织GDNF表达水平显著上调(<0.05)。M组术后海马组织CD68、GFAP表达显著上调(<0.05),复合电针调节后的EA组大鼠海马组织CD68和GFAP的上调得到了显著抑制(<0.05)。电针可显著改善术后认知功能障碍大鼠记忆功能,其机制可能与抑制小胶质细胞及星形胶质细胞的激活有关。
术后认知功能障碍;电针;肝叶切除术;小胶质细胞;星形胶质细胞;大鼠
术后认知功能障碍(postoperative cognitive dysfunction, POCD)是老年患者常见的手术后并发症,以记忆、注意力、语言等认知功能的明显下降为临床特征[1]。术后,约14%老年患者在3个月内发生认知能力下降[2]。POCD的病理机制复杂,至今尚未阐明。其中各种原因导致的神经细胞数量减少和过度凋亡在其中起到了重要作用。近年来发现不单是神经细胞,胶质细胞的过度激活在其中也起着重要作用,尤其是小胶质细胞和神经胶质细胞的激活对中枢炎症的调节起着关键作用[3]。既往研究表明,特定穴位电针刺激可以抑制中枢神经系统胶质细胞活化。而电针刺激能否通过抑制小胶质细胞和星形胶质细胞的活化改善POCD,尚少见报道,因此本研究进行了观察。
1 材料与方法
1.1 动物选择和分组
清洁级老龄雄性Sprague Dawley大鼠(18月龄, 500~600 g)72只(斯莱克实验动物中心,上海),采用随机数字表法分为假手术组(Sham组,S组),对照用;模型组(model组,M组),采用肝左叶切除手术诱导POCD;电针组(Electroacupuncture, EA组),肝左叶切除+电针调节大鼠,每组24只。本研究得到上海中医药大学附属第七人民医院伦理委员会批准。
1.2 POCD动物模型的建立
参照Tian Y等[4]POCD模型制作方法。大鼠腹腔注射1%戊巴比妥钠(30 mg/kg)麻醉,仰卧位固定,消毒后,在上腹部中线做一个小切口,行肝左叶切除,彻底止血后,逐层关腹。手术时间控制在大约90 min。待手术结束正常清醒后,采用Morris水迷宫测试,定位巡航时间比正常组>10 s,90 s内空间探索次数比正常大鼠<3次,即认为造模成功[5]。Sham组,麻醉后行上腹部中线皮肤切开缝合,不切除肝左叶。
1.3 干预方法
参照尚华杰等[6]固定和电针处理方法。EA组大鼠选择百会及双侧内关穴、合谷穴,不锈钢针(0.35 mm ×13 mm)垂直角度刺入约2.5 mm。然后,百会穴与韩氏穴位神经刺激仪(LH202H,北京)连接(与百会穴形成环路的另一电极,连接于百会穴后5 mm的非穴点),频率2/10 Hz,强度4 mA,疏密波持续刺激。电针干预从术前30 min持续至手术结束。术后1~7 d,每天固定时间行电针刺激1次,每次30 min。对照组和模型组大鼠采取同样的操作,抓取、固定相同的时间,但不予电针干预。
1.4 检测指标
1.4.1 学习记忆功能
参照经典Morris水迷宫测试方法[7],定位巡航实验测试学习能力,空间探索实验测试记忆能力。术前所有大鼠均在Morris水迷宫中接受连续5 d,每天4次的训练。定位巡航实验,将透明平台放置在水池4个象限中的一个(靠近中心的1/2个半径内),平台顶部低于水面1 cm。将大鼠置于离平台最远的象限,让它们找到并爬上平台,并将其记录为逃避潜伏期。如果最终没有找到平台,逃避潜伏期记为60 s。空间探索实验,取出平台,将老鼠放在前一个测试的相反象限的水中。观察每只老鼠的游泳路径,记录90 s内老鼠越过原平台位置的次数(跨平台次数)。
1.4.2 海马胶质细胞损伤水平
在术后1 d、3 d、7 d进行测试,每次测试后每组8只大鼠断头取脑,分离海马组织,冰浴下超声波粉碎,制成匀浆,10000×离心10 min,取上清。ELISA法检测GDNF蛋白表达水平(450 nm观察,酶标仪ricso rk201,深圳ricso科技有限公司,Ltd,深圳)。
1.4.3 小胶质细胞和星形胶质细胞激活水平
采用CD68蛋白表达代表小胶质细胞激活水平,GFAP代表星形胶质细胞激活水平,免疫荧光法检测。小鼠抗大鼠单克隆CD68抗体(AbD Serotec公司,英国),兔抗大鼠多克隆GFAP抗体(Abcam公司,英国)。所有免疫荧光图像釆用Leica Application Suit Version3.7(LAS V3.7)釆集,分别在海马CA1、CA3、DG区采集各指标免疫荧光图像,每只大鼠随机抽取5张切片,每张切片随机抽取5个视野,釆用Image-Pro Plus图像分析系统,以平均光密度值反映目的蛋白的表达水平,结果用均数±标准差表示。参照孙晓彩等[8]介绍的方法,对海马CA1、CA3、DG区取材。大鼠断头取脑后置于冰盒上,快速取海马,置于解剖显微镜下,去除周边多余组织及血管,切除两末端,将剩余海马等份切为三段,垂直放置,找到海马锥体线后,先切CA3区,在大弯端,将剩余部分沿锥体线一分为二,上端透明部分为CA1,下端深色为DG区。
1.5 统计学方法
采用SPSS19.0软件进行统计分析。符合正态分布的计量资料采用均数±标准差表示,计数资料采用次和百分比表示。采用单因素重复测量方差分析()比较3组之间的差异及各组的两两之间的差异。以<0.05为差异有统计学意义。
2 结果
2.1 电针显著改善POCD大鼠学习记忆能力
Morris水迷宫实验结果显示,与假手术组(S组)相比较,肝叶切除术(M组)后大鼠1 d、3 d、7 d的逃避潜伏期均显著延长(<0.05)(见图1),跨平台次数显著减少(<0.05)(见图2),提示手术导致了大鼠术后记忆功能显著下降。当在特定穴位给予电针刺激后(EA组)大鼠1 d、3 d、7 d的逃避潜伏期虽然仍较假手术组延长,但较手术的模型组(M组)已经显著缩短,跨越平台次数显著增加(<0.05)(见图1、表1、图2、表2)。提示,特定穴位电刺激可以显著抑制记忆能力的显著下降。
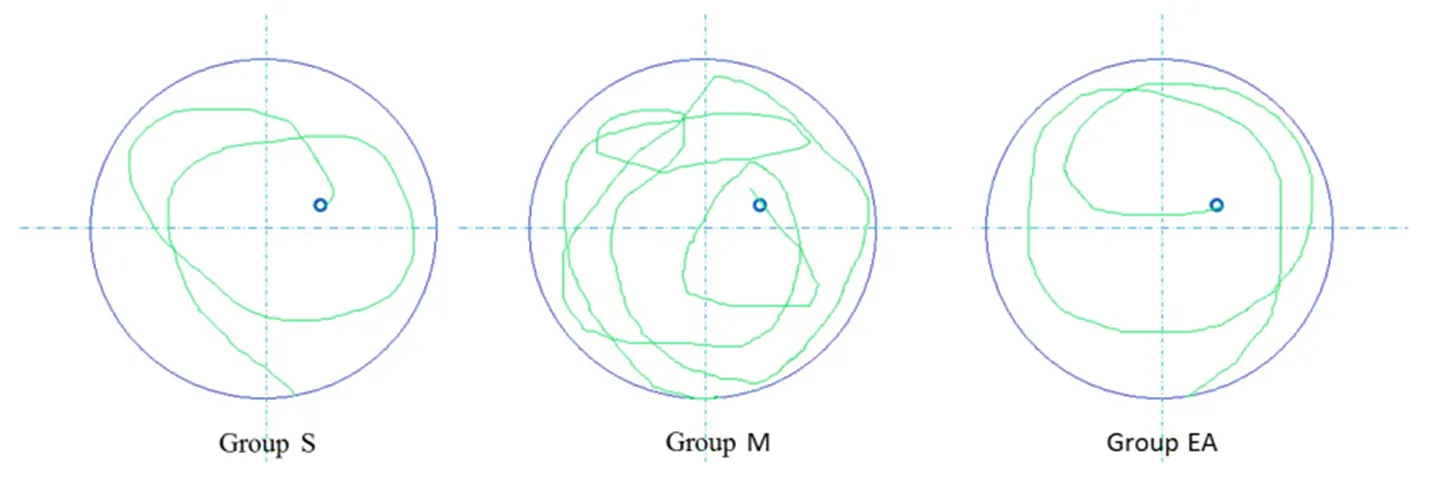
图1 术后7 d逃避潜伏期(s)

图2 术后7 d单位时间内跨越平台次数
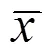
表1 各组不同时间点逃避潜伏期比较 (±s,s)
注:与S组同时点比较1)<0.05;与M组同时点比较2)<0.05
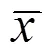
表2 各组不同时间点跨越平台次数比较 (±s,次)
注:与S组同时点比较1)<0.05;与M组同时点比较2)<0.05
2.2 电针显著减轻POCD大鼠海马胶质神经细胞的损伤
胶质源神经营养因子(GDNF)是一种多肽类的神经营养因子,对损伤的神经细胞有营养和保护作用。结果显示,接受手术后(M组)大鼠GDNF含量显著下降(<0.05),而复合电针刺激的大鼠(EA组)GDNF表达较M组显著回升(<0.05)(见表3)。提示电针刺激能减轻手术诱导海马胶质细胞的损伤。
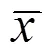
表3 不同时间点海马GDNF表达水平比较 (±s,ng/mL)
注:与S组同时点比较1)<0.05;与M组同时点比较2)<0.05
2.3 电针对海马各区小胶质细胞CD68和星形细胞GFAP表达的影响
与S组比较,M组术后1 d、3 d、7 d小胶质细胞CD68的表达显著上调;与M组比较,复合针刺的EA组显著抑制了术后CD68的上调(<0.05)。与S组比较,术后1 d、3 d、7 d左肝叶切除的M组星形胶质细胞GFAP表达显著上调,复合针刺干预的EA组则显著抑制了GFAP的上调(<0.05)。详见表4、表5。
术后1 d、3 d时小胶质细胞以胞体相对较小,突起喙突,伪足伸出,阿米巴样改变的活化状态为主(红色);星形胶质细胞主要发生了胞体变大,侧枝变多的改变(绿色)。在7 d时小胶质细胞多回复至胞体相对较大、形状不规则、有细长分支状突起的静息状态;星形胶质细胞胞体变小,侧枝减少。详见图3。
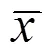
表4 各组术后小胶质细胞CD68表达的比较 (±s)
注:与S组同时点比较1)<0.05;与M组同时点比较2)<0.05
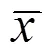
表5 各组术后星型胶质细胞GFAP表达的比较 (±s)
注:与S组同时点比较1)<0.05;与M组同时点比较2)<0.05

图3 EA组术后1 d、3 d、7 d海马组织CD68和GFAP表达的免疫荧光图
3 讨论
术后认知功能障碍是手术后常见的并发症,表现为术后的学习记忆能力下降及失眠、焦虑、人格障碍等,严重的可出现抑郁及自杀倾向。尤其是老年患者,术后发生率显著增加。虽然近年来进行了大量的研究,但由于其机制不清,临床尚无明确有效的防治措施[9-10]。
本研究中选择了18月龄大鼠模拟老年机体进行研究,根据文献[6]选择了肝左叶切除术建立POCD模型。行为学研究采用了经典的Morris水迷宫实验[11],手术前连续5 d对其进行了训练,保证每只大鼠都能在90 s内找到水下平台。结果发现,手术后大鼠记忆能力出现了显著下降,实验中表现为找到水下平台时间显著增加,同时在定位巡航实验中单位时间内游过原水下平台的次数显著减少。而给予电针刺激的手术后大鼠,其记忆能力虽然仍较假手术组差,但是比没有给予电针刺激的大鼠已经显著得到改善,提示电针特定穴位刺激可以改善手术刺激导致的记忆障碍。
针灸治疗痴呆历史源远流长,早在晋代皇甫谧的《针灸甲乙经》中就有相关记载。针刺可通过刺激人体特定腧穴,起到疏通经络、调节神志、益智健脑等作用,在改善脑组织代谢、保护神经元细胞以增强认知功能等方面有确切疗效。电针疗法将大部分刺激进行量化,可通过改变波形、频率和刺激强度以达到更好的治疗效应[12]。近年来涌现出大量将电针用于防治认知功能障碍的临床和基础研究,如钱立锋等[13]发现电针刺激百会穴显著改善患者卒中后认知功能障碍。薛洋等[14]发现电针百会穴联合神庭穴对卒中后认知障碍治疗效果更好。这些结果均提示电针刺激是有潜在应用价值的治疗方法,因此选择了动物实验进行进一步的研究,并对其机制进行了初步探究。前期研究发现改善大鼠POCD与调节海马a7-烟碱型乙酰胆碱受体(a7- nAChR)的表达抑制海马炎症反应[15],减少海马神经元细胞过度凋亡[16]及抑制脑源性神经细胞营养因子(BDNF)有关[17]。
前期研究多集中在对神经细胞,近年来发现其支持细胞——胶质细胞同样起着重要作用[18-19],因此本研究对其进行了观察。神经细胞分泌脑源性神经细胞营养因子(BDNF),同样神经胶质细胞也分泌胶质细胞源性神经营养因子(GDNF),其对神经胶质细胞的存活起着重要作用[20-22]。记忆功能与海马联系紧密,尤其是CA1区神经元比较致密,起着重要作用,因此选择了CA1区进行了观察。结果显示,手术后1~7 d均出现GDNF含量显著下降,而复合了电针的EA组大鼠,CA1区GDNF含量的下降则得到了部分的抑制。提示海马区GDNF的表达参与了电针诱导的POCD改善。GDNF表达的增加是否导致确实减轻了胶质细胞的损伤?因此,又进行了进一步对小胶质细胞和星形胶质细胞的活化状态进行了研究。CD68和GFAP分别是两者活化的标志性蛋白,胶质细胞活化后可以产生大量炎性细胞因子,而过度的炎症反应也是导致POCD因素之一,因此选择了对其进行检测,可以反映两种胶质细胞的存活量。通过免疫荧光观察,所有大鼠术后1 d、3 d时海马小胶质细胞以胞体相对较小,伪足伸出,阿米巴样改变的活化状态为主(红色);星形胶质细胞主要发生了胞体变大,侧枝变多的改变(绿色)。在7 d时小胶质细胞多回复至胞体相对较大、形状不规则、有细长分支状突起的静息状态;星形胶质细胞胞体变小,侧枝减少。接受手术的M组大鼠CD68和GFAP的表达显著增加,提示手术应激激活了海马胶质细胞和小胶质细胞的表达。不只是手术,杨美华[22]发现麻醉应激同样可以导致胶质细胞的激活,导致POCD的发生。而复合电针刺激后的EA组大鼠,其CD68和GFAP的增加得到了显著抑制,提示电针刺激可以抑制小胶质细胞和星形胶质细胞的激活,进而可以通过减轻中枢神经系统炎症反应,改善POCD。
认知功能涉及范围较广,本研究只观察了学习和记忆,下一步有待对更多的指标进行观察。胶质细胞中枢神经系统中包括星形胶质细胞、少突胶质细胞和小胶质细胞,本文只检测了星形胶质细胞与小胶质细胞,还有少突胶质细胞没有研究。认知功能还与大脑的皮质有关,海马主要是与学习记忆关系紧密,对其他脑区的功能的影响也有待于进一步研究。
综上所述,在本实验条件下发现,电针刺激可显著改善手术诱导POCD大鼠的认知功能,其机制与抑制海马胶质细胞的激活有关。但详细机制尚需进一步研究。
[1] Kramer AF, Colcombe S. Fitness effects on the cognitive function of older adults: a meta-analytic study- revisited[J]., 2018,13(2):213- 217.
[2] Norkienė I, Samalavičius R, Misiūrienė I,. Incidence and risk factors for early postoperative cognitive decline after coronary artery bypass grafting[J].(), 2010,46(7):460-464.
[3] Jackson L, Dong G, Althomali W,. Delayed admini- stration of angiotensin Ⅱ type 2 receptor (AT2R) agonist compound 21 prevents the development of post-stroke cognitive impairment in diabetes through the modulation of microglia polarization[J]., 2019. doi:10.1007/s12975-019-00752-5.
[4] Tian Y, Guo S, Zhang Y,. Effects of hydrogen-rich saline on hepatectomy-induced postoperative cognitive dysfunction in old mice[J]., 2017,54(4): 2579-2584.
[5] Greene AK, Puder M. Partial hepatectomy in the mouse: technique and perioperative management[J]., 2003,16(2):99-102.
[6] 尚华杰,冯琪,刘美琪,等.针刺“百会”“足三里”对血管性认知障碍模型大鼠认知功能的影响[J].国际中医中药杂志,2018,40(5):427-431.
[7] 杨美华,王超,王国林.麻醉相关认知功能的动物行为学评估[J].国际麻醉学与复苏杂志,2014,35(3):263- 267.
[8] 孙晓彩,李力,张敏,等.Wistar大鼠海马CA1区,CA3区和齿状回区的解剖分割[J].中国应用生理学杂志, 2012,28(2):189-192.
[9] Evered LA, Silbert BS. Postoperative cognitive dysfunc- tion and noncardiac surgery[J]., 2018,127 (2):496-505.
[10] 胡艳婷,苏跃,赵斌江,等.中医中药与老年患者术后认知功能障碍的研究进展[J].医学综述,2018,24 (8):1612-1616.
[11] D’Hooge R, De Deyn PP. Applications of the Morris water maze in the study of learning and memory[J]., 2001,36(1):60-90.
[12] Mayor D. An exploratory review of the electroacupunc- ture literature: clinical applications and endorphin mechanisms[J]., 2013,31(4):409-415.
[13] 钱立锋,姚青,罗开涛,等.百会长留针配合康复训练对气虚血瘀型缺血性卒中伴认知功能障碍的影响[J].上海针灸杂志,2018,37(5):499-502.
[14] 薛洋,孙伟娟,刘飞来,等.电针神庭,百会联合功能康复训练治疗脑卒中后认知障碍42例[J].中医研究, 2018,31(1):57-60.
[15] Liu PR, Zhou Y, Zhang Y,. Electroacupuncture alleviates surgery-induced cognitive dysfunction by increasinga7-nAChR expression and inhibiting inflame- matory pathway in aged rats[J]., 2017, 659:1-6.
[16] 彭生,杨建平,张晓庆,等.Ro20-1724对氯胺酮诱导乳鼠海马神经元凋亡的影响[J].中华麻醉学杂志,2014, 34(4):458-461.
[17] 顾达民,朱长江,张晓庆,等.Ro20-1724对氯胺酮重复麻醉致幼龄大鼠认知功能障碍的影响[J].中华麻醉学杂志,2015,35(5):543-545.
[18] 官瑞丽.小胶质细胞诱导星形胶质细胞功能改变在铅锰联合暴露致认知功能损伤中的作用及机制[D].西安:第四军医大学,2016.
[19] Niño DF, Zhou Q, Yamaguchi Y,. Cognitive impairments induced by necrotizing enterocolitis can be prevented by inhibiting microglial activation in mouse brain[J]., 2018,10(471):eaan0237.
[20] Gerlach RM, Chaney MA. Postoperative cognitive dysfunction related to Alzheimer disease?[J]., 2018,155(3):968-969.
[21] 李晶文,张丽,张连峰.小胶质细胞在神经发育和神经退行性疾病中的吞噬作用与调节机制[J].中国比较医学杂志,2018,28(4):120-126,104.
[22] 杨美华.海马胶质细胞活化在七氟醚诱发老年大鼠认知功能损害中的作用[D].天津:天津医科大学,2014.
Effect of Electroacupuncture on Cognitive Function and Hippocampal Glial Cells in Partially Hepatectomized Rats
-,,-,.
’,200137,
To investigate the effect of electroacupuncture on surgical stress-induced cognitive dysfunction in rats and preliminarily explore its mechanism of action by observing the activation of hippocampal glial cells.Seventy-two aged male rats were randomized to three groups: control, model and electroacupuncture, 24 rats each. The control (sham) group (S group)received a sham operation. The model group (M group) received left hepatic lobectomy, which induced cognitive dysfunction. The electroacupuncture group (EA group) received left hepatic lobectomy and postoperatively electroacupuncture 30 min once daily. Cognitive function was assessed using the Morris water maze. Hippocampal glial cell line-derived neurotrophic factor (GDNF) was measured by enzyme-linked immunosorbent assay (ELISA). The expressions of hippocampal microglia marker CD68 and astrocyte GFAP were determined by immunofluorescence.Compared with the M group, the escape latency shortened and the number of crossing platform increased in the EA group at one, three and seven day after the surgery (<0.05). Hippocampal GDNF levels increased significantly in the M and EA groups of rats after the surgery compared with before (<0.05). Compared with the M group, the expression of hippocampal GDNF was significantly up-regulated in the EA group after composite electroacupuncture regulation at various time points after the surgery (<0.05). Hippocampal CD68 and GFAP expressions were significantly up-regulated in the M group postoperatively (<0.05). The up-regulation of hippocampal CD68 and GFAP was significantly inhibited in the EA group after composite electroacupuncture regulation (<0.05).Electroacupuncture can markedly improve memory function in rats with postoperative cognitive dysfunction. Its mechanism of action may be related to the inhibition of microglia and astrocyte activation.
Postoperative cognitive dysfunction; Electroacupuncture; Hepatic lobectomy; Microglia; Astrocyte; Rats
R2-03
A
10.13460/j.issn.1005-0957.2020.02.0226
1005-0957(2020)02-0226-06
2019-05-20
上海市浦东新区卫生系统重要薄弱学科项目(PWZbr2017-19);上海市浦东新区卫生系统学科带头人培养计划(PWRd2016-17,PWRd2016-19)
刘佩蓉(1976—),女,副主任医师,硕士,Email:lpeir@126com
彭生(1977—),男,副主任医师,博士,Email:ps7707@163.com

