乳腺导管原位癌的病理分级与分子表达的相关性研究
王自豪 李玉龙 彭德峰 董慧明
1 蚌埠医学院研究生院,安徽省蚌埠市 233000; 2 蚌埠医学院第一附属医院甲乳外科
乳腺导管原位癌的发病率逐年提高,其约占乳腺癌的20%。2003年WHO定义DCIS为一种局限于乳腺导管—小叶内的肿瘤性病变,表现为上皮细胞的非典型性增生,可进展为浸润性导管癌。现有的乳腺癌模型是以形态学免疫表型、分子学特征,区分DCIS的两种主要不同种类的病变:低级别DCIS和高级别DCIS。目前实际工作中主要依据细胞核的核级并兼顾坏死及核分裂象等将DCIS分为低、中、高3个级别[1]。基因组学研究发现低核级DCIS常有16q、17p的丢失,而高核级的 DCIS经常出现11q13和17q12的扩增[2]。 DCIS是一种异质性病变,低核级DCIS和低核级的IDC在基因表达上有着更多的共同性,常为ER表达型,而高核级DCIS和高核级IDC更易出现Ki-67和HER-2的过表达,病理核分级作为乳腺癌预后最确定的因素之一,其代表着对肿瘤生物学特性的形态学评估,已被证明能够获得与乳腺癌临床行为密切相关的重要信息[3]。 ER、PR、HER-2、Ki-67和P53是乳腺癌中最重要的预后标志物,也是反映该疾病生物学行为的有效预测因子。故本文重在研究不同组织学分级DCIS患者的ER、PR、HER-2、Ki-67、P53分子表达,从而发现DCIS的分子学特征和病理形态学表型的关系。
1 对象与方法
1.1 研究对象 本研究回顾了2013—2018年于蚌埠医学院第一附属医院肿瘤外科住院的165例DCIS患者的临床病例。患者均为女性,年龄 27~82岁,平均年龄 (51.15±11.48)岁,中位年龄54岁。获得其临床及病理数据。病理诊断均为乳腺导管原位癌或乳腺导管内癌患者,无局部浸润和转移。病理信息具有病灶的病理核分级,免疫组化信息有ER、PR、HER-2、Ki-67、P53的分子表达情况。
1.2 检查方法与结果判断 所有标本由本院病理科统一处理,其结果由病理科医师确认,根据AJCC第8版对DCIS的定义标准进行诊断[4]。并经SP法免疫组化染色观察。ER、PR为癌细胞核着色,ER或PR阳性定义为:≥1%的肿瘤细胞核染色。HER-2判定标准参考HER-2免疫组织化学评价指南[5],IHC评分为0~1+则判定为HER-2阴性,3+判定为HER-2阳性。 由于尚无研究表明HER-2的表达在DCIS中的明确意义,故排除未行FISH检测的HER-2 2+的患者。以Ki-67增殖指数≥14%作为高表达,P53蛋白阳性的表达以≥10%作为判定标准,排除免疫组化染色观察不确定的标本。
1.3 统计学方法 应用SPSS23.0软件进行资料的录入、整理和数据分析,运用Pearson’s χ2检验进行单因素分析。将单因素分析有意义的指标运用二元Logistic回归分析是否与DCIS组织学分级独立相关。P<0.05作为差异具有统计学意义。
2 结果
2.1 不同病理分级DCIS患者的分子表达差异性比较 低—中级别DCIS患者和高级别DCIS患者相比年龄上的差异无统计学意义(P=0.148),但后者<45岁的患者整体比率较高。从表1可以看出,在分子表达上低—中级别DCIS患者的ER和PR阳性表达率明显高于高级别DCIS患者,差异均有统计学意义(P<0.001)。高级别DCIS患者的HER-2阳性率显著高于低—中级别DCIS患者,差异有统计学意义(P<0.001)。在Ki-67表达的比较上,高级别DCIS患者与低—中级别DCIS患者的高表达率比较(84.3%VS 19.3%),两者的差异较大(P<0.001)。两者P53蛋白的阳性表达上有所不同,但差异无统计学意义。

表1 两组DCIS患者的临床病理信息对比[n(%)]
2.2 分子表达与DCIS病理分级独立相关的危险因素 如表2所示,将单因素分析有统计学意义的指标ER、PR、HER-2、Ki-67四个指标纳入二元Logistic多因素回归分析,发现HER-2阳性是DCIS患者病理分级出现高级别的独立危险因素 (P<0.001),OR值为2.448。
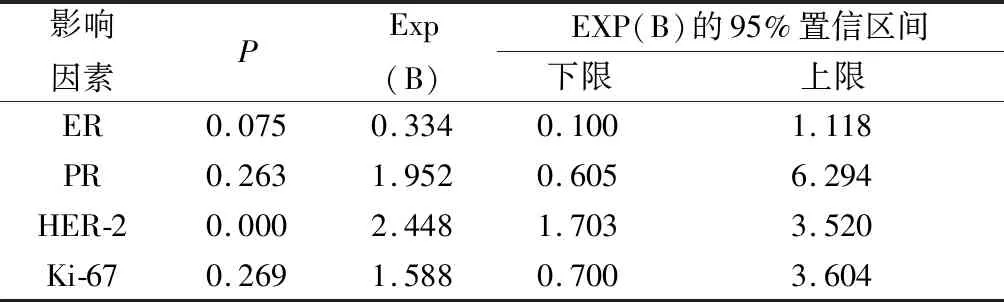
表2 DCIS出现高级别的危险因素
3 讨论
以往的研究多在探讨DCIS的分子表达或与IDC相比较,很少有研究去分析DCIS的病理分级及其生物标志物的关系。随着第8版AJCC指南的问世,肿瘤分级及生物标志物在乳腺癌预后中的重要性不断被发现[6],探究肿瘤分级和分子表达的关系变得愈加重要。
目前通常根据 ER、PR、HER2及 Ki-67等分子表达对DCIS的肿瘤分子生物学特征做评估。乳腺上皮细胞发生肿瘤病变时,ER的表达会降低,此时肿瘤细胞的生长将不受雌激素的影响,致使不良的生物学表型的发生和对内分泌治疗产生抵抗。ER的状态作为DCIS内分泌治疗能否成功的有价值的预测因素已被证实[7],本研究中ER在低—中级别DCIS中的阳性率为87.7%,明显高于高级别DCIS患者,表明 ER 随着肿瘤组织学分级增高而表达下降,可能与乳腺导管原位癌发展的不同阶段的生物学行为相关。ER和PR在生物学上是密切相关的,PR是雌激素作用的重要下游效应因子,高的PR表达常提示肿瘤恶性程度低,而PR阴性的肿瘤具有更差的生物学行为,研究中高级别DCIS患者的PR表达明显降低,差异有统计学意义。HER-2 基因扩增和由此导致的 HER-2 蛋白过表达与肿瘤细胞增殖通路相关,表现为肿瘤细胞增殖迅速、分化程度低,肿瘤细胞间黏附力小,易扩散及转移。在浸润性乳腺癌中与高的组织学分级等不良预后因素相关[8]。因此 HER-2过表达患者复发、转移的概率较大,预后差。但目前关于HER-2在DCIS中的具体意义不明,有少数研究表明分子分型为HER-2过表达是DCIS患者术后复发的独立危险因素[9-10]。本研究发现在病理分级高级别的DCIS患者中HER-2 过表达率为67.6%,显著高于分级为低—中级的DCIS患者的10.5%(P均<0.01) ,且多因素Logistic回归分析显示HER-2过表达是DCIS呈现高级别的独立危险因素,强烈提示HER-2过表达是DCIS的不良分子表型。表明HER-2阳性可以有效预测DCIS有着更差的病理分型。Ki-67是一种目前最常用的反映肿瘤细胞增殖活性的核蛋白,其高表达与肿瘤的浸润、转移相关。在一项荟萃分析中Ki-67可以作为乳腺DCIS复发的预测因子[11]。本研究结果表明,与低—中级别DCIS相比,Ki-67在病理分级为高级别的DCIS中明显高表达,差异有统计学意义。P53被发现与人类肿瘤发生相关的重要基因,当P53基因突变时,由野生型P53转变为突变型P53导致癌基因的激活,其表达的蛋白可以促进细胞恶性转化,在乳腺癌组织中其阳性表达率通常上升,本研究中高级别DCIS的P53阳性率较高,但差别无统计学意义,说明P53的表达和DCIS的病理分级的关系不明显。
综上所述,有理由认为乳腺DCIS的病理分级和分子表型间有着明确的关系。高级别DCIS在HER-2、Ki-67等反应乳腺癌预后较差的指标上显著高于低—中级别的DCIS患者,且HER-2作为反映乳腺DCIS病理分级的独立危险因素,考虑可以作为鉴别DCIS病理分级的强预测指标。

