转录因子调控脂肪组织生热过程研究进展
李欣蔚,刘红霞,何朝勇
(中国药科大学药学院,江苏 南京 210009)
目前,肥胖及其代谢综合征已成为21 世纪威胁人类健康的主要代谢疾病。随着人们生活水平的提高和生活方式的改变,肥胖及其并发症的发生率逐年增加[1]。肥胖系由于人体长期储存的能量大于消耗的能量,造成白色脂肪组织(white adipose tissue,WAT) 和 棕 色 脂 肪 组 织(brown adipose tissue,BAT)的不平衡。BAT 与WAT 在形态和功能上完全不同。WAT 是储存过剩能量的主要组织[2],BAT 是一种耗能组织,与骨骼肌不同,寒冷时可通过非颤抖性产热来维持体温[3]。非颤抖性产热时需要消耗大量的脂肪酸和葡萄糖,然后通过线粒体氧化磷酸化解偶联将脂肪转化为热能[4]。人类在出生后WAT 开始出现,并随着年龄的增长而增多,而BAT 在胎儿期出现,在婴儿期达到高峰,并随着年龄增长而减少[5]。所以早期研究认为,成年人的BAT 水平较低且无功能。随着核医学的发展,科学家对健康成人进行18F-脱氧葡萄糖正电子发射计算机断层显像(PET)后发现,人体中每50 g BAT完全活化后,通过消耗每日摄入物质的20%来产生热量[6]。因此与运动减肥不同,BAT 通过改善人体的糖代谢和脂质代谢,进而降低体质量和改善肥胖状态。
同时,在某些条件下,例如慢性冷环境适应或β3 肾上腺素能受体(β3-AR)激动剂,会引起WAT转化为具有BAT 特征的脂肪组织,促进机体多余的能量释放。“棕色化”的WAT 被称为米色脂肪组织,其具有部分BAT 的特征,例如,解偶联蛋白1(uncoupling protein 1,UCP1)高表达,同时表达较多数量的线粒体等。WAT 棕色化后,与经典的BAT 相同,通过非颤抖性产热促进机体能量消耗,改善机体糖脂代谢。因此,这种将能量储存转变为能量消耗的方式,成为治疗肥胖的新策略[7]。
目前研究表明,小鼠的棕色脂肪和米色脂肪在很多方面不同。首先,来源不同。谱系追踪显示,经典的小鼠棕色脂肪细胞来源于表达MYF5、PAX7基因的平滑肌细胞[8],而小鼠的米色脂肪细胞来源于表达SMA、MYH11、PDGFRa或PDGFRb基因的小鼠祖细胞[9-11]。也有研究证明部分米色脂肪细胞如前皮下、后腹膜、后皮下脂肪组织细胞,来源于表达PAX3和/或MYF5基因的小鼠祖细胞[12-13]。第二,维持生热活性的能力不同。在撤去冷刺激一段时间后,米色脂肪发生线粒体自噬,恢复成白色脂肪,脂滴呈单室样。棕色脂肪线粒体仍保持较高活性,脂滴仍呈多室样。第三,产热机制不同。棕色脂肪细胞的产热机制依赖于UCP1,而米色脂肪细胞有独特的产热机制。表1 对这3 种脂肪细胞的形态、来源、基因表达和生热机制进行了比较。
1 不同脂肪组织的生热机制
1.1 经典的棕色脂肪生热机制
经典的BAT 主要通过UCP1 解偶联氧化磷酸化,使得线粒体ATP 合成受阻,产生热量[14]。低温刺激交感神经释放的去甲肾上腺素(noradrenaline,NE)可促进BAT 中UCP1 的合成。NE 通过脂肪组织细胞膜上的β3-AR 激活环腺苷酸(adenylate cyclase,cAMP),cAMP 刺激cAMP 依赖的激酶A(cyclic-AMP dependent protein kinase A,PKA)磷酸化下游蛋白,例如cAMP 反应元件结合蛋白(cAMP responsive element binding protein,CREB)和PPAR-γ[15]。同时,cAMP 通过p38/增殖蛋白激酶(mitogen-activated protein kinase,MAPK)途径,激活转录因子2(activating transcription factor 2,ATF2),从而使得下游转录因子PGC-1α 表达升高[16]。此外,PRDM16 为特异性调节棕色脂肪生成和维持其生热活性的重要因子,促进BAT 生成,同时在BAT 和WAT 形成过程中起到“开关”的作用[17],其机制与PRDM16 结合C 末端结合蛋白(C-terminal-binding protein,CtBP)形成复合物、促进PPAR-γ 和PGC-1α 的表达有关,而这2 种转录因子可共同作用于UCP1的启动子,促进其表达[15]。另一方面,PRDM16 可结合CCAAT 增强子结合蛋白β(CCAAT/enhancer binding protein-β,C/EBP-β),抑制WAT 特异性基因表达[15](见图1)。
BAT 还可以通过释放内源性调节因子,通过自分泌或旁分泌的作用,增加UCP1 的表达,从而激活棕色脂肪细胞的产热途径。研究表明,BAT 与其他组织可以释放以下几种调节因子来调节脂肪组织的生热过程:1)棕色脂肪细胞释放的三碘甲状腺氨酸(triiodothyronine,T3)通过肾上腺素的信号通路增加了脂肪酸氧化和线粒体呼吸、线粒体自噬和线粒体生物发生;另外在BAT 中,2 型碘甲腺原氨酸脱碘酶(type II iodothyronine deiodinase,DIO2)可以将甲状腺激素原转化为T3,因此DIO2缺失的小鼠将无法应对寒冷刺激[18]。2)在运动过程中,鸢尾素(irisin)是通过肌肉中PGC-1α 的下游靶标Ⅲ型纤连蛋白域5(type III domain containing protein 5,FNDC5)蛋白剪切和修饰形成的,并在棕色脂肪细胞中可以通过p38/MAPK 信号通路促进UCP1等产热基因表达[19]。3)骨形成蛋白(bone morphogenetic protein,BMP)对BAT 的形成有重要作用。其中,BMP4 促性多能干细胞向脂肪细胞谱系转化,同时通过p38/MAPK 通路提高线粒体活性和诱导产热基因UCP1的表达,诱导BAT形成[20]。另外,BMP7 诱导PRDM16 和PGC-1α 表达,促进UCP1的表达[21]。饮食以及寒冷刺激也可通过p38/MAPK通路以及CREB 磷酸化作用使得BAT 中BMP8b 表达增加。研究表明,BMP8b 可通过中枢和外周作用增强BAT 的活性[22]。4)成纤维细胞生长因子21(fibroblast growth factors,FGF21)作为一种肝脏分泌的激素,其作用与调控糖代谢和改善胰岛素抵抗相关。研究表明,BAT 中也可以合成FGF21,通过自分泌作用,使得BAT 中PGC-1α 表达增加,从而增加产热基因UCP1等表达增加[23]。5)胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)是肠道分泌的一种肠促胰岛素,可显著减少摄食,进而改善肥胖和糖尿病等相关代谢疾病[24],同时提高BAT 的产热能力,通过增加能量消耗来减轻体质量,并降低血浆TG 和葡萄糖水平[25]。因此GLP-1 通过刺激中枢的GLP-1 受体,刺激交感神经,从而提高BAT 的活性[26]。

图 1 棕色脂肪细胞的产热机制Figure 1 The thermogenic mechanism of brown adipocytes
1.2 米色脂肪的生热机制
Granneman 等[27]证明,β3-AR 激动剂也可以增加UCP1-/-小鼠腹股沟WAT 的呼吸作用,说明白色脂肪棕色化后生热机制与棕色脂肪不同,是不依赖于UCP1 调节的。Denton 等[28]提出,米色脂肪是通过ATP 依赖的肌浆网钙泵(Sarco/endoplasmic reticulum Ca2+-ATPase 2b,SERCA2b)/雷 诺 定 受体2(Ryanodine receptor 2,RyR2) 依 赖 性Ca2+循环途径,促进三羧酸循环(tricarboxylic acid,TAC)来维持产热。由于棕色脂肪合成ATP 的能力较弱,在UCP1 缺失的情况下,不能完全补偿机体所需的热量[29],因此目前UCP1 介导的生热机制仍然在维持体温和治疗肥胖等代谢疾病中发挥着重要作用。
有研究表明,β3 肾上腺素信号通路以及PPAR-γ、PGC-1α、PRDM16 等都参与了白色脂肪棕色化过程。β3 受体激动剂作用于小鼠后,使得小鼠WAT 中产热基因表达升高,例如DIO2、DNA断裂因子相似蛋白A(cell-death-inducing DNAfragmentation-factor-like effector-A,CIDEA) 基 因和UCP1[30];另外,β3-AR 激动剂处理过的白色脂肪细胞中三酰甘油分解加速,从而促进了WAT棕色化的过程。使用PPAR-γ 激动剂罗格列酮处理小 鼠 后,WAT 中PGC-1α、PRDM16和UCP1等生热基因表达升高;进一步研究发现,PRDM16在PPAR-γ 激动剂诱导WAT 棕色化时起到重要作用,烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)可以通过去乙酰化酶1 促进PPAR-γ 第293 和268 号 赖 氨 酸 位 点 乙 酰 化,使PRDM16 与PPAR-γ 结合形成转录复合物,并促进UCP1等下游基因表达,最终使得WAT 转变为米色脂肪[31]。另外,研究发现,PRDM16 与锌指蛋白516 形成复合物后,结合于UCP1的启动子区域,在转录水平上调节UCP1的表达,促进WAT 转变为米色脂肪[32]。PGC-1α 作为调节WAT 棕色化的另一重要因子,通过上调核呼吸因子1 基因(nuclear respiratory factor 1,NRF1)促进线粒体转录因子基因(mitochondrial transcriptional factor A and B,mtTFa和mtTFb)表达,促进白色脂肪细胞中线粒体生成,同时PGC-1α 与UCP1的启动子区域结合,上调UCP1 的表达,进而促进机体产热[33]。同时,棕色脂肪细胞通过p38/MAPK 通路形成并释放FGF21,促进WAT 中PGC-1α和UCP1等产热基因表达增加和WAT 棕色化过程[34]。
2 调节不同脂肪组织生热过程的转录因子
一般认为,转录因子直接识别并结合顺式作用元件来调节靶基因转录[35]。本文通过对转录因子直接调节UCP1基因进行阐述,揭示不同转录因子调控棕色和米色脂肪组织的生热过程,包括转录 因 子Krüppel 样 因 子4(Krüppel-like factor 4,KLF4)和KLF15,核因子ⅠA(nuclear factor I A,NFIA)和Iroquois 同源蛋白家族(Iroquois homeobox protein,IRX)。 同 时PPAR-γ 和PRDM16 在棕色脂肪生热过程和白色脂肪棕色化过程中发挥了重要作用,其中,早期B 细胞因子2(early B cell factor 2,EBF2)的作用与PPAR-γ相关,同源盒(homeobox,HOX)和H2.0 样同源盒基因(H2.0-like homeobox gene,HLX)可以与PRDM16 结合(见表2)。
2.1 直接作用于解偶联蛋白1 的转录因子
2.1.1 Krüppel 样因子15 诱导解偶联蛋白1 表达 KLF是锌指结构域转录调节因子家族的一个子类。它们与启动子结合并作为辅激活子,调节基因表达[36]。KLF成员KLF15 作为一种转录因子,通过结合UCP1的启动子,在棕色脂肪细胞中诱导UCP1 的表达。据报道,大蒜素(allicin)不仅可以诱导PRDM16、UCP1等产热标志物表达升高和线粒体的生物发生,还可以诱导KLF15 在小鼠胚胎成纤维细胞白色脂肪细胞(3T3-L1)中高表达[37]。KLF 家族也可通过激活ERK1/2 通路诱导脂肪生成[37]。在经ERK 抑制剂PD98059 预处理的3T3-L1 细胞中,大蒜素可以同时使UCP1 和KLF15 的表达降低。因此ERK1/2通路与大蒜素介导的白色脂肪细胞棕色化有关,并且可以调节KLF15 的激活。此外,大蒜素可以促进KLF15 与UCP1启动子的结合,并且大蒜素可以增加小鼠的耗氧量,增加皮下血管的密度并减轻小鼠体质量。综上,ERK1/2 可诱导KLF15 表达,促进UCP1 表达,导致分化的3T3-L1 脂肪细胞和腹股沟WAT 棕色化[38]。但是,我们仍需要动物和临床研究数据来揭示大蒜素参与米色脂肪生热的具体过程。
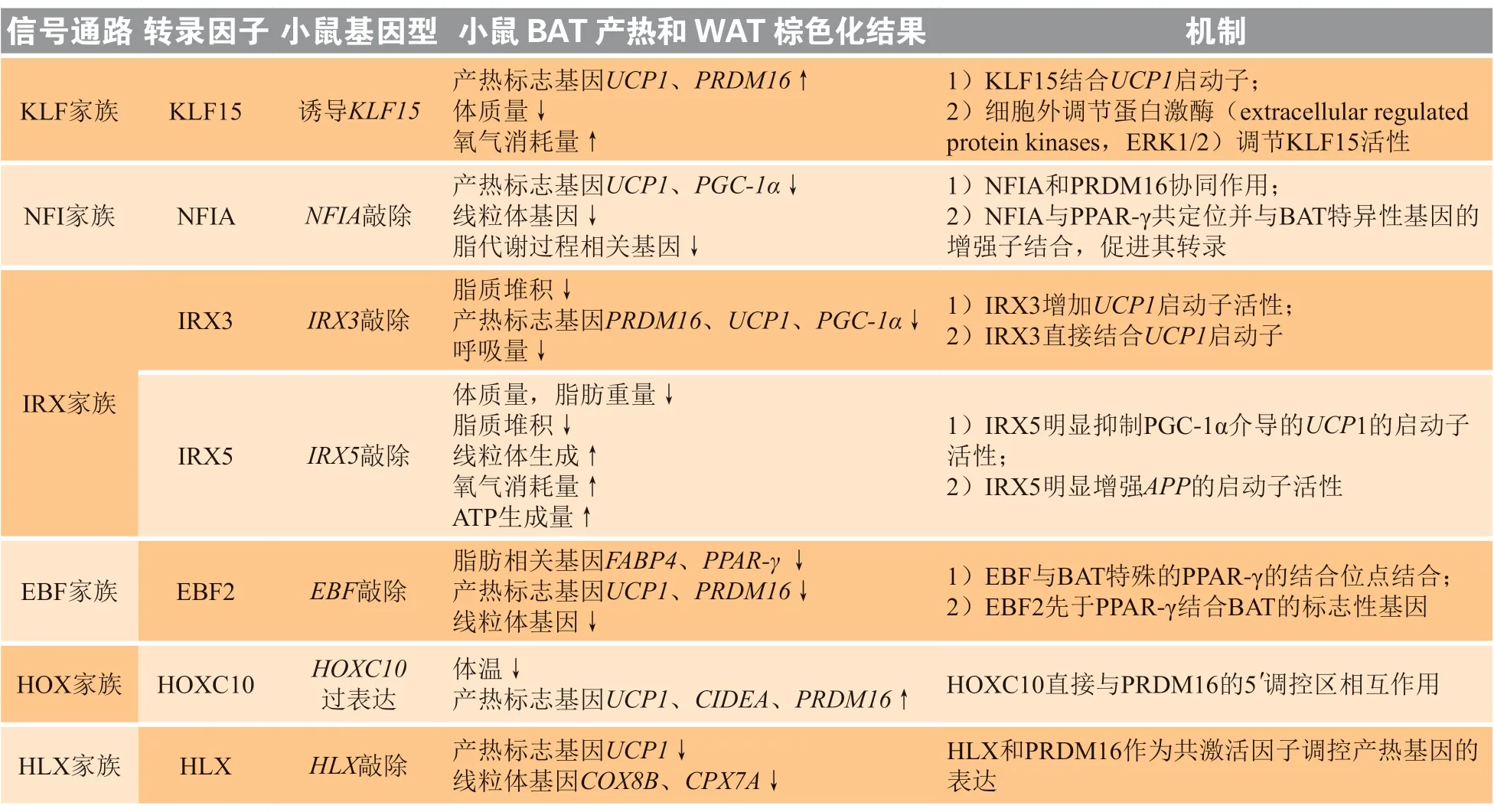
表 2 不同转录因子在生热过程中的调节作用Table 2 The regulating effects of different transcription factors in thermogenesis
2.1.2 核因子ⅠA 结合解偶联蛋白1 增强子 NFIA是NFI 转录因子家族的成员之一,它通过直接与靶基因的启动子区结合来激活或抑制靶基因的转录,或通过招募其他转录因子调控靶基因的表达[39]。研究显示,NFI 在BAT 中表达,并且在寒冷或β3-AR受体激动剂刺激下,NFIA 在BAT 中表达量明显升高。同时,在棕色脂肪细胞中过表达NFIA,使得UCP1等基因表达升高,而敲除PRDM16,NFIA 仍可刺激BAT 特异性基因(如UCP1和PGC-1a)的表达。同时在米色脂肪中敲除NFIA 使得白色脂肪棕色化相关基因(如PRDM16)表达降低。研究显示,NFIA 和主要调节脂肪生成的转录因子PPAR-γ 共同结合到棕色脂肪相关基因(如UCP1)的增强子上,且NFIA 的结合先于PPAR-γ,以此提高基因的转录活性[40]。然而,同家族的转录因子NFIC 对脂肪细胞分化有负调控作用,因此NFIA 有可能也能参与棕色和米色脂肪细胞的分化过程[41]。
2.1.3 Iroquois 同源蛋白家族与解偶联蛋白1 据报道,FTO基因是与肥胖相关的等位基因,其变异增加了肥胖的发生率。该基因发生变异后影响了IRX3 和IRX5 在早期脂肪细胞分化中的表达,并进一步调控白色脂肪细胞棕色化,影响脂肪组织生热活性[42]。
2.1.3.1 Iroquois 同源蛋白3 增加解偶联蛋白1活性 IRX3 在中枢神经系统[43]和胰[44]中高表达,是IRX 家族的转录因子。同时研究显示IRX3 作为FTO基因变异体的效应因子,调控WAT 棕色化的过程[45]。同时研究显示IRX3 作为FTO基因变异体的效应因子,调控白色脂肪棕色化的过程[45]。在寒冷或β3-AR 激动剂刺激下,小鼠棕色脂肪中IRX3与UCP1 表达均有增加。IRX3-/-成熟米色脂肪细胞不仅表现为产热标志物(如PRDM16、UCP1、CIDEA 等)减少,还表现出呼吸能力下降,这与IRX3 可增加脂肪细胞UCP1的转录活性有关[45]。同时有证据显示IRX3 发生突变后降低了UCP1启动子的活性,并增加了肥胖的发生率[45]。
2.1.3.2 Iroquois 同源蛋白5 抑制解偶联蛋白1 胰岛素通过降低淀粉样前体蛋白(amyloid precursor protein,APP)的表达减少炎症反应,且在肥胖的发生过程中APP 的升高与胰岛素抵抗有关[46]。IRX5 作为关键的转录因子调控各自的靶基因,抑制脂肪生热过程和白色脂肪棕色化,从而导致肥胖发生率增加[47-48]。与野生型小鼠相比,IRX5-/-小鼠表现为体质量降低,脂质沉积减少,且棕色脂肪中生热相关基因如UCP1表达增加,耗氧量增加,同时APP 表达减少[47]。另外体外实验证明,在棕色脂肪细胞中过表达IRX5 不仅可以抑制UCP1的表达和增加APP启动子活性,还会降低线粒体呼吸能力[47]。以上结果揭示,抑制脂肪组织中IRX5-APP 通路可能成为治疗肥胖的新策略。
2.2 与过氧化物酶体增殖物激活受体-γ 作用相关的转 录因子
转录因子EBF 家族,其4 个家族成员EBF1、EBF2、EBF3 和EBF4 具有相似的结构特征,其中EBF2 在BAT 的生热过程中发挥了积极的作用。EBF2 的过表达明显增加了产热基因(包括UCP1和PRDM16、PGC-1a)以及线粒体相关基因(包括CYC-C、COX5B、COX8Bb和COX7A1)的表达。同时,EBF2对于棕色脂肪细胞的正常呼吸功能至关重要,因为在NE 的刺激下,EBF2+/-脂肪细胞和正常的脂肪细胞一样,耗氧量增加,而EBF2-/-脂肪细胞耗氧量却没有出现明显增加[49]。另外,EBF2 通过结合在BAT 的PPAR-γ 特殊转录位点上,参与调节PPAR-γ 介导的脂肪细胞的形成过程[49]。尽管EBF2 会使脂肪细胞标志性基因(包括ADIPOQ和FABP4)的水平小幅度升高,但是没有检测到EBF2 聚集到WAT 特殊的PPAR-γ 结合位点上[49]。总之,EBF2 通过直接作用于PPAR-γ 结合位点,促进棕色脂肪的形成,从而抑制白色脂肪形成。
2.3 与结合PR 结构域蛋白16 相关的转录因子
2.3.1 PR 结构域蛋白16 与同源盒C10 结合HOX是一组高度保守的转录因子,也是胚胎发育和细胞分化的主要调控基因[50]。HOXC基因是HOX 家族成员之一,参与脂肪相关的调节,在各种代谢疾病过程中发挥调节作用[51]。HOXC10 在腹股沟WAT中的表达水平高于BAT 和内脏WAT。与BAT 相比,HOXC10 对腹股沟WAT 棕色化影响更大。过表达HOXC10 可抑制PRDM16 诱导的基因表达,但不影响脂肪生成相关基因的表达。棕色和米色脂肪细胞中HOXC10 的缺失导致脂肪生成基因(如FABP4)和产热标志基因(如PRDM16、PGC-1a、CIDEA)增加。同样,HOXC10 在小鼠体内的过表达后抑制了产热基因(如PRDM16、PGC-c1a、UCP1 和CIDEA)的表达。研究显示,HOXC10 直接与PRDM16 的5'调节区结合,抑制PRDM16 的激活,而外源性PRDM16 可以使得该抑制作用减弱[52]。如上所述,HOXC10 对BAT 影响较小,它可能参与了WAT 的产热过程而不是维持BAT 的活性,另外,HOXC10 参与的WAT 产热过程可能并不受UCP1 的调控。
2.3.2 PR 结构域蛋白16 与H2.0 样同源盒结合 HLX是一种细胞间质表达的同源框转录因子[53-54]。HLX在BAT 中的表达高于腹股沟WAT,同时Hlx 可以诱导WAT 中米色脂肪细胞的脂肪生成。寒冷环境刺激下,HLX/-小鼠腹股沟WAT 棕色化被抑制,而对BAT 的影响较小。此外,在腹股沟WAT 中过表达HLX,并与PRDM16 结合,诱导产热基因和线粒体生物发生相关基因的表达,可以减少肝脏中三酰甘油沉积,维持白色脂肪细胞的棕色化形态[55],从而调控脂肪的生热过程。在HLX 过表达的棕色和米色脂肪细胞中,PRDM16 剂量依赖性地增加了UCP1启动子区域的转录活性。同样,在敲除HLX 的棕色和米色脂肪细胞中,PRDM16 诱导的产热基因表达和线粒体生物发生均被抑制[55]。综上所述,HLX 参与脂肪组织生热过程,特别是对腹股沟WAT 棕色化起到重要作用。
3 结语与展望
经典的BAT 通过UCP1 解偶联使得多余的能量以热能的形式被消耗。所以目前,大多数的研究都集中于转录因子在棕色脂肪细胞中如何调控UCP1 和上游基因的表达,通过这些研究,我们可以进一步了解BAT 的生热过程。此外,相比于经典BAT,WAT 棕色化也引起了科学界广泛的关注,米色脂肪与BAT 有不同的产热机制,一些转录因子可以特异性作用于WAT 棕色化,激活米色脂肪,促进机体多余的能量以热能的形式释放,减少脂质沉积,因此,米色脂肪具有不可忽视的医疗应用前景。如转录因子KLF15、NFIA、IRX3 可通过调节产热相关基因促进白色脂肪棕色化,并且KLF15的激动剂大蒜素可以通过激活米色脂肪细胞来增加能量的消耗。对相关的一系列转录因子展开深入研究,对于寻找肥胖、糖尿病等代谢疾病治疗靶点具有重要意义。

