芸薹根肿菌分泌蛋白PbSP1的克隆及表达特征分析
余方伟,王神云,张 伟,王 红,于 利,李建斌
(江苏省农业科学院 蔬菜研究所/江苏省高效园艺作物遗传改良重点实验室, 江苏 南京 210014)
【研究意义】根肿病(clubroot disease)是由芸薹根肿菌(PlasmodiophorabrassicaeWoronin)引起的世界性土传病害,该病原菌的寄主范围十分广泛,可危害甘蓝、花椰菜、大白菜、小白菜、油菜、荠菜等多种十字花科栽培和野生植物[1]。根肿病常年危害面积约320~400万hm2,大流行年份发生与危害面积可达900万hm2,平均产量损失达20 %~30 %,病重田块直接产量损失达60 %以上[2]。除了直接导致作物减产外,病根中释放的休眠孢子生命力极强可在土壤中存活达20年[3],由于目前尚无有效的方法来清除土壤中的休眠孢子,因此在染菌的田块反复种植十字花科作物将有极大的减产风险。【前人研究进展】细胞学研究发现芸薹根肿菌的侵染过程主要分为根毛侵染和皮层侵染两个阶段[3-4]:在初侵染阶段,初级游动孢子从萌发的休眠孢子中释放出来后,受到某种寄主化学物质的诱导,吸附到寄主植物根毛表面,然后利用特殊的侵染结构排孢管(Stachel and Rohr)穿透宿主细胞壁,并将变形虫样的原生质注入宿主细胞,在宿主细胞内经过多次细胞分裂形成初生原生质团[5]。经过多次十字形细胞核分裂以后,初生原生质团逐渐发育成游动孢子囊。在皮层侵染阶段,游动孢子囊释放出的次生游动孢子侵染根皮层细胞,并发育成次生原生质团。次生原生质团引起寄主细胞的异常增大和分裂,导致植物根部肿大和植株地上部分的萎蔫、矮化、黄化、早衰[6-7]。芸薹根肿菌在寄主植物内发育形成成熟的休眠孢子,随腐烂的病残体进入土壤中,适时再次成为侵染源。相比侵染过程研究,芸薹根肿菌致病分子机理研究较为滞后。【本研究切入点】由于芸薹根肿菌以活体营养的方式寄生在寄主细胞内,目前缺乏有效的遗传转化方法,因此传统的反向遗传方法研究基因功能也难以在芸薹根肿菌上应用。越来越多的研究表明病原物的分泌蛋白在其致病过程中起到重要作用,而芸薹根肿菌分泌蛋白的鉴定仅有少量报道[8-11]。【拟解决的关键问题】为了进一步挖掘鉴定芸薹根肿菌的潜在分泌蛋白,本研究以湖北长阳火烧坪4号生理小种为实验材料,采用生物信息学结合异源表达的方法对PbSP1进行了克隆和分析,拓展芸薹根肿菌分泌蛋白研究,加深对芸薹根肿菌分泌蛋白的科学认知。
1 材料与方法
1.1 实验材料
1.1.1 菌种来源 根肿病样采自湖北长阳火烧坪,生理小种为4号,于-20 ℃保存备用。
1.1.2 植物材料 野生型拟南芥(Arabidopsisthaliana, Col-0)和本氏烟(Nicotianabenthamiana)。
1.2 实验方法
1.2.1 芸薹根肿菌的接种 拟南芥接种方法参考Ludwig-Müller等[9]的报道。病根打成匀浆后,用孔径25 μm的过滤筛过滤,2500 g,10 min离心2次。将休眠孢子浓度调至约106个孢子/mL,用注射器向14 d苗龄的拟南芥根部周围注射2 mL上述孢子悬液。将接种后的拟南芥至于23 ℃ ± 1 ℃,16 h光照,8 h黑暗的条件下继续培养。
1.2.2 芸薹根肿菌的核酸提取 基因组DNA提取:取拟南芥病根用无菌水洗涤,用吸水纸吸干后置于液氮中充分研磨,用NuClean Plant Genomic DNA kit试剂盒(康为世纪生物科技有限公司)按照说明书进核酸提取。
RNA提取:取拟南芥病根用无菌水洗涤,用吸水纸吸干后置于液氮中充分研磨,用RNAprep pure植物总RNA提取试剂盒(天根生化科技有限公司)按照说明书进行RNA提取。使用PrimeScript cDNA合成试剂盒(宝生物工程有限公司)按照说明书进行反转录合成cDNA,所得产物用作后续载体构建的模板。
1.2.3 生物信息学分析 PbSP1(PBRA_001430)的Genbank登录号为CEP00376.1,该序列源自Schwelm等[12]报道的芸薹根肿菌菌株e3的参考基因组。通过SMART软件(http://smart.embl-heidelberg.de/)进行蛋白质结构域分析。使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)进行信号肽的预测。使用TMHMM v2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构域的预测。
1.2.4 测序分析 用正向引物5’-TGAGCGTGTTCCACACAGCA-3’和反向引物:5’-TCTGCTTGCCACTACCTACA-3’,以1.2.2获得的基因组DNA为模板,使用KOD FX Neo(东洋纺)进行扩增。反应体系(50 μl)如下:25 μl 2×buffer, 5 μl dNTPs (2 mM), 1 μl 模板, 各加2 μl上下游引物(10 μM), 0.5 μl KOD FX Neo, 14.5 μl ddH2O。反应条件为95 ℃预变性3 min, 94 ℃ 变性30 s,53 ℃退火30 s,72 ℃ 延伸40 s,循环30次后72 ℃反应7 min。PCR产物经过1 % 琼脂糖胶确认特异性后送测序。
1.2.5 载体构建 构建验证信号肽的载体方法如下。设计特异引物F1: 5’-ATGAATTCATGCAGA GCTGGCTTGCGCTGT-3’和R1:5’-ATCTCGAGGCCGGAGCACGACCATGCCAGC-3’,以1.2.2获得的cDNA为模板,使用KOD FX Neo(东洋纺)进行扩增。反应体系(25 μl)如下:12.5 μl 2×buffer, 2.5 μl dNTPs (2 mM), 1 μl cDNA, 各加1 μl上下游引物(10 μM), 0.3 μl KOD FX Neo, 6.7 μl ddH2O。反应条件为 95 ℃预变性3 min, 94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸10 s,循环30次后72 ℃反应5 min。将切胶回收的片段克隆到pSUC2的EcoR I-XhoI位点上,并转化大肠杆菌DH5α,将阳性克隆送测序,测序正确的克隆进行扩繁,提质粒备用。
构建烟草瞬时表达的载体方法如下:设计引物F2: 5’-ATGGTACC ATGGCTTGTAATTGCACGCTGGATGT-3’和R2: 5’-ATGTCGACGTTCGTACAAGCG CCCAGGTGT -3’反应体系如上所述。反应条件为95 ℃预变性3 min, 94 ℃变性30 s,53 ℃ 退火30 s,72 ℃ 延伸40 s,循环30次后72 ℃反应10 min。将切胶回收的片段克隆到pCAMBIA-35s-GFP的KpnI-SalI位点上,并转化大肠杆菌DH5α,将阳性克隆送测序,测序正确的克隆摇菌提质粒通过冻融法转化农杆菌GV3101。
1.2.6 酵母蔗糖酶实验 酵母蔗糖酶实验方法参照Yu等[11]的报道。将重组质粒pSUC2转入酵母蔗糖酶缺失菌株YTK12中,转化后的产物涂布于SD-W培养基上,置于30 ℃培养箱中黑暗培养3~5 d。PBRA_005941预测信号肽与蔗糖酶融合的重组转化子作为阴性对照(NK),Avr1b的信号肽与蔗糖酶融合的重组转化子作为阳性对照。将长出的酵母菌落转接到CMD-W。将PCR验证为阳性的酵母菌落转接到YPRAA培养基上30 ℃培养3~5 d,观察酵母在YPRAA培养基上的生长状态。挑取对应的酵母菌落,加入1 mL蔗糖溶液(25 mM蔗糖溶解在0.2 M NaAc,pH 5.0),然后在37 ℃下孵育30 min。最后加入1 mL 2,3,5-三苯基氯化四氮唑(TTC,用4 % NaOH溶液溶解TTC,配置成0.2 % TTC溶液)。在5 min内观察颜色变化。
1.2.7 烟草瞬时表达 将菌落PCR验证为阳性的农杆菌克隆加入到含有50 μg/mL卡那霉素的LB培养液中,至于28 ℃摇床中振荡培养48 h,5000 r/min离心5 min收集菌体。用10 mM MgCl2重悬5000 r/min离心5 min收集菌体,重复该步骤一次。用侵染缓冲液(10 mM MgCl2,10 mM MES,150 μM乙酰丁香酮,pH 5.6)重悬菌,稀释到OD600为0.5,28 ℃黑暗放置2~3 h后用去针头的1 mL注射器从烟草叶片的背面进行注射,在注射后3~5 d观察GFP荧光。转化空载体pCAMBIA-35s-GFP的叶片用作对照。
2 结果与分析
2.1 PbSP1序列分析
为了便于测序,在设计测序引物时往目的基因的上下游各延伸了100 bp,因此目的条带会比基因本身大200 bp (图1-a)。剔除掉两端多余序列后,通过序列比对发现从4号小种中扩增出来的PbSP1的核酸序列与芸薹根肿菌欧洲菌株e3参考基因组中相应的序列(PBRA_001430)大小相同,都为558 bp,且该基因无内含子(图1-b)。

seq_1为e3菌株序列,seq_2,seq_3, seq_4为扩增序列,DNA marker从上到下依次为2000、 1000、 750、 500、 250、 100 bp
2.2 PbSP1的信号肽功能分析
用SignalP 4.1和SMART分别对PbSP1的氨基酸序列进行分析(图2-a)。PbSP1包含185个氨基酸残基,在其氨基端(1~19 aa)存在1个信号肽,分别在20~57 aa, 58~97 aa,100~140 aa, 146~183 aa处均存在一个Kazal结构域。此外,通过TMHMM v2.0分析未发现PbSP1存在膜定位序列。因PbSP1存在一个氨基端信号肽,推测该蛋白可以被分泌到胞外。通过酵母蔗糖酶分泌实验发现(图 2-b),转入PbSP1信号肽序列的YTK12能够在YPRAA上正常生长,也能将TTC还原成红色不溶物甲臜。上述结果表明PbSP1第1~19位的氨基酸序列(1~19)具有信号肽功能。
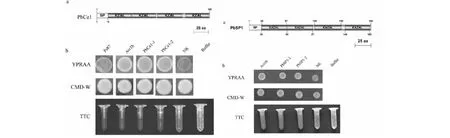
图2 PbSP1信号肽功能验证Fig.2 Validation of signal peptide of PbSP1 by yeast invertase assay
2.3 PbSP1的表达特征
根据Schwelm等[12]公布的表达量原始数据计算出FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)后,本研究进一步对PbSP1的表达模式进行了分析。如图3所示,PbSP1在休眠孢子萌发期的表达量最为活跃,在原生质团时期和休眠孢子成熟期表达相对较低,在不同的植物寄主中,PbSP1在油菜中的表达量较高,白菜次之,在甘蓝中表达量较低。
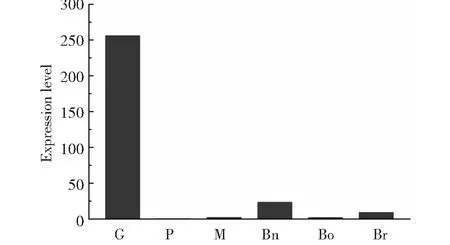
G.休眠孢子萌发期,P.原生质团,M.休眠孢子成熟期,Bn.油菜, Bo.甘蓝,Br.白菜
2.4 PbSP1的亚细胞定位分析
合适的细胞定位是蛋白发挥正常功能的必要条件。本研究通过烟草瞬时表达进一步明确PbSP1的亚细胞定位。如图4所示,在烟草的细胞质内有明显的绿色荧光信号,表明PbSP1分布在细胞质内。

图4 PbSP1的亚细胞定位Fig.4 Subcellular localization of PbSP1
3 讨 论
研究表明,分泌蛋白在病原物与寄主互作过程中发挥重要作用[13],因此挖掘鉴定芸薹根肿菌的分泌蛋白具有重要科学意义。芸薹根肿菌的遗传不可操作性极大地阻碍了其分泌蛋白的鉴定。随着高通量测序技术的飞速发展,许多植物病原体的基因组相继公布。2015年芸薹根肿菌e3菌株的基因组公布[12],给相关基因的克隆和鉴定带来了便利。本研究通过生物信息学和异源表达技术对芸薹根肿菌的分泌蛋白PbSP1进行了分析。测序结果表明PbSP1序列与e3菌株相同,且无内含子。本研究发现PbSP1在氨基端存在信号肽,且其他区域不存在跨膜结构域,这些特征与已经报道的其他病原的分泌蛋白相符合,此外PbSP1还存在4个Kazal结构域。在致病疫霉(Phytophthorainfestans)中,含有Kazal结构域的分泌蛋白具有丝氨酸蛋白酶抑制剂的活性,可以抑制寄主的防卫反应[14]。PbSP1在休眠孢子萌发期表达量最高,表明其可能在此阶段发挥重要功能。
多数活体营养型病原物缺乏稳定的反向遗传操作方法,异源表达技术成为研究其基因功能的重要手段。通过酵母和大肠杆菌表达分别揭示了芸薹根肿菌Pro1的蛋白酶活性[8],PbBSMT的甲基转移酶活性[9],通过烟草瞬时表达揭示PbBSMT的亚细胞定位[10]。本研究也利用了异源表达技术研究了PbSP1的信号肽功能和亚细胞定位。在后续的研究中需要借助异源表达技术来进一步阐明PbSP1及其他分泌蛋白在芸薹根肿菌致病中的作用。
4 结 论
芸薹根肿菌PbSP1包含185个氨基酸残基,在氨基端存在信号肽序列,同时序列中含有Kazal结构域且不含膜定位序列,酵母蔗糖酶实验表明PbSP1的信号肽具有功能,PbSP1符合分泌蛋白的基本特征。PbSP1在芸薹根肿菌休眠孢子萌发时期表达最为活跃,在此过程中发挥重要功能。

