接枝功能化磁性纳米粒子去除饮用水中Cu2+研究
李婷婷,王 薇,范迎迎,薛东涵,戴明珏,张 琦,刘 博,韩博林,关桦楠
(哈尔滨商业大学 食品工程学院, 哈尔滨 150076)
铜作为一种人类必需的微量元素,摄入少量的铜对生物体有益.反之,对铜的过量摄入会严重损害肾脏、生殖系统、神经系统、消化系统和血液系统,造成脑病等疾病,从而对人类细胞和神经都有毒性影响[1-3],受此影响的人红细胞遭到破坏,导致溶血、贫血等疾病,也会表现出记忆力下降,情绪不易控制,食欲不振等症状.现今检测铜离子的方法有化学法[4]、原子吸收法[5]、色谱法[6-8]等,这些方法有着造价高昂、不易操作等缺点.而Fe3O4粒子具有纳米粒子普遍的特性,即表面效应、体积效应等,且其具有造价低,易回收,可重复使用等优点[9],还具有其独特的磁性能[10-13],然而Fe3O4粒子有着易于团聚,不易保存容易氧化等不便;通过接枝表面修饰可以很好地解决Fe3O4颗粒的功能改性.这一方法已经在材料制备[14-15]、食品检测[16-17]、药物[18]、环境监测[19]等领域有了应用.本实验利用3-(异丁烯酰氧)丙基三甲氧基硅烷对Fe3O4微粒进行接枝表面修饰,合成新型功能化的磁性纳米粒子并对其进行表征,采用单因素优化实验和正交试验设计优化实验评估磁性粒子去除饮用水中铜离子的最优体系,考察不同因素对体系的影响,并为水中铜离子及其他重金属离子的去除方法的改良提供基础.
1 实验材料与方法
1.1 实验材料及仪器
乙二醇购自天津华东试剂厂;无水CuSO4、PEG-4000、NaAc·3H2O、FeCl3购自天津科密欧化学试剂有限公司;3-(异丁烯酰氧)丙基三甲氧基硅烷(KH570)购自上海康朗生物科技有限公司;透射电子显微镜购(JEM2800)自于日本电子株式会社;振动磁强计(8600)购自于上海懿宏科学仪器有限公司;紫外可见光分光光度计购自于北京普析通用仪器有限责任公司;水热反应釜购自于上海耀冠仪器有限公司.
1.2 实验方法
1.2.1 Fe3O4磁性纳米颗粒的制备
在40 mL乙二醇中将1.35 g的FeCl3·6H2O溶解,依次加入NaAc·3H2O 3.60 g与PEG-4000 1.00 g,对整个反应体系进行30 min的搅拌后,将其移至水热反应釜中,在200 ℃条件下持续8 h,待反应结束后冷却到室温.然后分别用30 %的乙醇和蒸馏水仔细洗涤反应所得黑色产物,重复3次.
1.2.2 Fe3O4磁性纳米颗粒的表面修饰
取合成的Fe3O4磁性纳米颗粒10 g于超声条件下分散在50 mL含有20%乙醇的水溶液中,于室温下加入5 mL的KH570原液,边加边匀速搅拌,随后在摇床中室温下搅拌7~10 h,将反应完成后得到的浅棕色细微颗粒悬浊液进行烘干,洗涤烘干循环3次,最后将上清液离心并真空干燥,得到功能化的Fe3O4粉末.用双蒸水将所得磁性粉末配置为功能化纳米Fe3O4悬浊液,其质量浓度为100 mg/mL.
1.2.3 功能化磁性纳米粒子的表征
将制备的Fe3O4混悬液采用一定量的去离子水稀释后,超声振荡使其均匀分散在溶液中,然后使用激光粒度分布仪对功能化磁性纳米粒子粒径的大小和分布情况进行检测分析.利用工作电压为80 kV的JEM2800透射电子显微镜对磁性纳米材料的形貌特征进行观察.
1.2.4 Cu2+溶液标准曲线的建立
配置0.04 mol/L的硫酸铜作为母液,并用配置的母液分别配置100 mL的0.04、0.02 、0.01、0.005 mol/L和0.002 5 mol/L的Cu2+标准溶液.静置5 min后,向比色皿中加入3 mL不同浓度的Cu2+标准溶液,当分光光度计调节至波长794 nm时,测定出不同浓度下Cu2+标准溶液的吸光度,以蒸馏水作空白对照,并绘制出标准工作曲线.
1.2.5 单因素优化接枝功能化Fe3O4对Cu2+去除体系的影响
将不同量(0.1、0.25、0.5、1.0、和2.0 mL)的接枝Fe3O4磁性粉末配成混悬液(50 mg/mL)加入到6 mL的硫酸铜溶液(0.02 mol/L)中,用蒸馏水定容使体系总量为8 mL.置于不同温度的水浴中(25、30、35、40和45 ℃),反应不同的时间间隔(5、10、15、20和25 min)后,取出并室温沉降2 min,利用磁铁缓慢的将接枝Fe3O4磁性纳米颗粒吸附在离心管的一侧.待体系溶液绝对澄清之后,再吸取上清液,过滤后,加入到比色皿中,以蒸馏水为空白对照,考察体系中含铜离子的量的变化.
1.2.6 正交设计优化Cu2+去除体系
分别研究了接枝功能化Fe3O4添加量(A因素)、反应温度(B因素)和反应时间(C因素)对Cu2+去除体系的影响,根据单因素优化结果和正交设计表选择L9(34)正交实验(每个因素选取3个水平),用以确定因素影响的主要和次要顺序以及首选方案.根据正交设计,取6 mL CuSO4溶液(0.02 mol/L),加入一定量的功能化Fe3O4,用蒸馏水定容使体系总量为8 mL.然后于某一反应温度条件下水浴相应时间后(水浴中平均每分钟缓慢摇动1次)取出去除体系,在室温下静置2 min后,用磁铁将功能化Fe3O4纳米颗粒吸附在离心管底部,吸出3 mL上清液,经微孔滤膜过滤后,加入到比色皿中,以品牌纯净水为空白对照,测量波长794 nm处的吸光度,测量每个样品的吸光度值,重复3次,以确定平均值.
2 实验结果与分析
2.1 功能化Fe3O4的制备与表征
实验中通过水热法制备Fe3O4纳米颗粒,并通过透射电子显微镜观察其表观形态.由图1可看出,制备的Fe3O4纳米颗粒以颗粒形式存在,粒径分布在100 ~300 nm之间 ,并且由于磁性原因略有聚集.

图1 Fe3O4纳米颗粒透射电子显微镜图片
通过Fe3O4和功能化Fe3O4纳米微粒的磁滞测量,研究结果表明,Fe3O4颗粒的磁饱和强度值为89 emu·g-1,接枝功能化Fe3O4纳米颗粒的M值为52 emu·g-1,通过对比发现,接枝功能化Fe3O4纳米颗粒的M值明显降低,同时也证明了接枝作用发生于纳米颗粒的表面,且接枝的KH570影响了磁性颗粒的超顺磁性,符合接枝的屏蔽效应.
2.2 Cu2+去除体系标准曲线的绘制
实验中通过可见分光光度计测量吸光度,其中不同浓度的硫酸铜溶液作为变量,以蒸馏水为对照,绘制标准曲线,见图2.
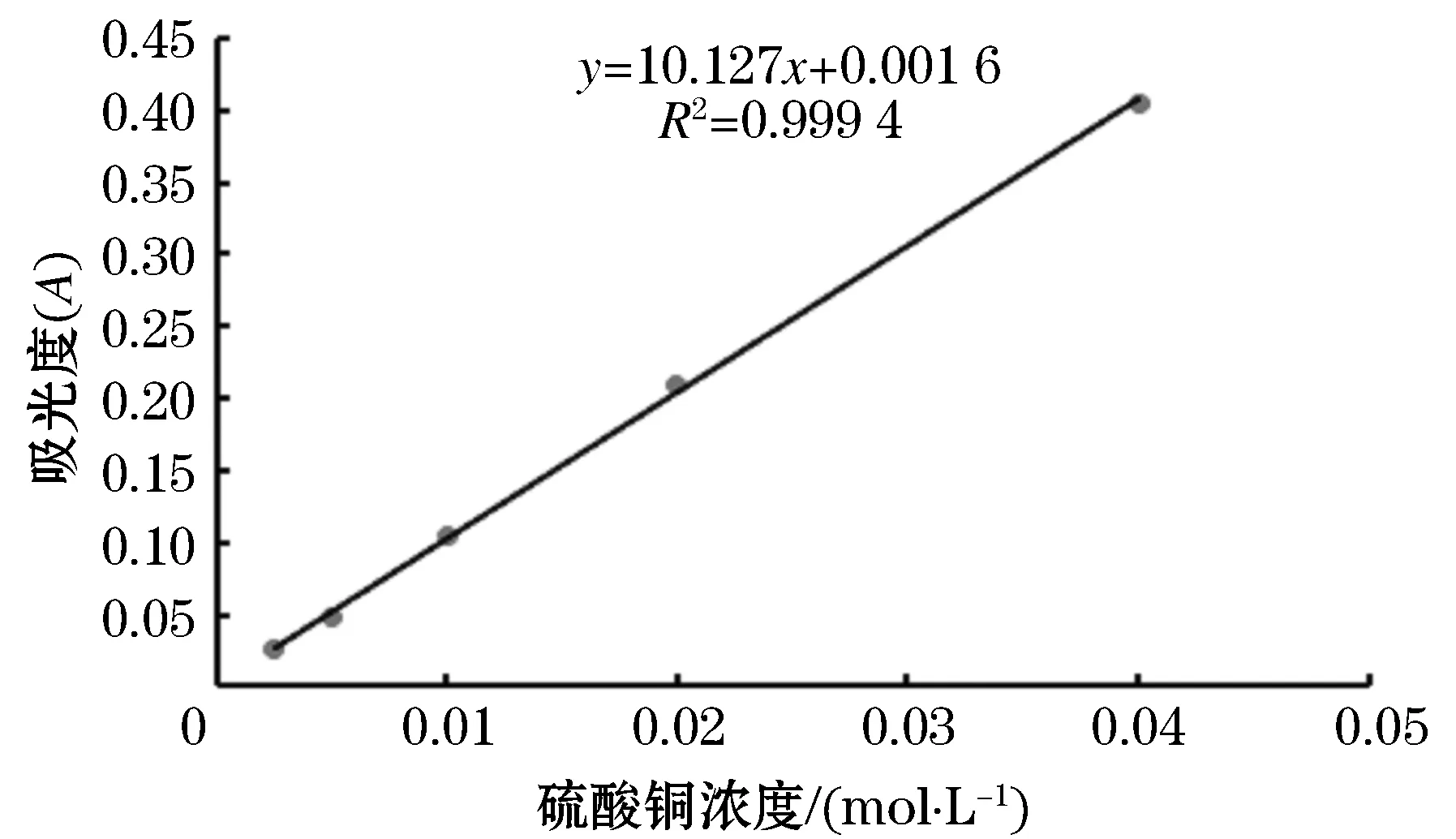
图2 硫酸铜标准曲线的构建
结果如图2所示,实验的最小定量限是0.002 5 mol/L,随CuSO4浓度的不断变大,吸光度也呈直线上升趋势,且相关系数R2达到0.999 4,但在0.002 5~0.005 mol/L范围内上升缓慢.在0.005~0.04 mol/L范围内,0.02 mol/L的CuSO4溶液的吸光度大幅增加,甚至超过曲线上升趋势.因此,确定硫酸铜的工作浓度为0.02 mol/L.
2.3 单因素优化实验结果分析
2.3.1 功能化Fe3O4添加对Cu2+去除体系的影响
配制质量浓度为100 mg/mL的功能化Fe3O4纳米粒子的悬浮液.采用单因素变量法筛选Cu2+去除体系3种不同因素的3个最适水平.首先考察功能化Fe3O4悬浮液的加入量对Cu2+去除体系的影响.
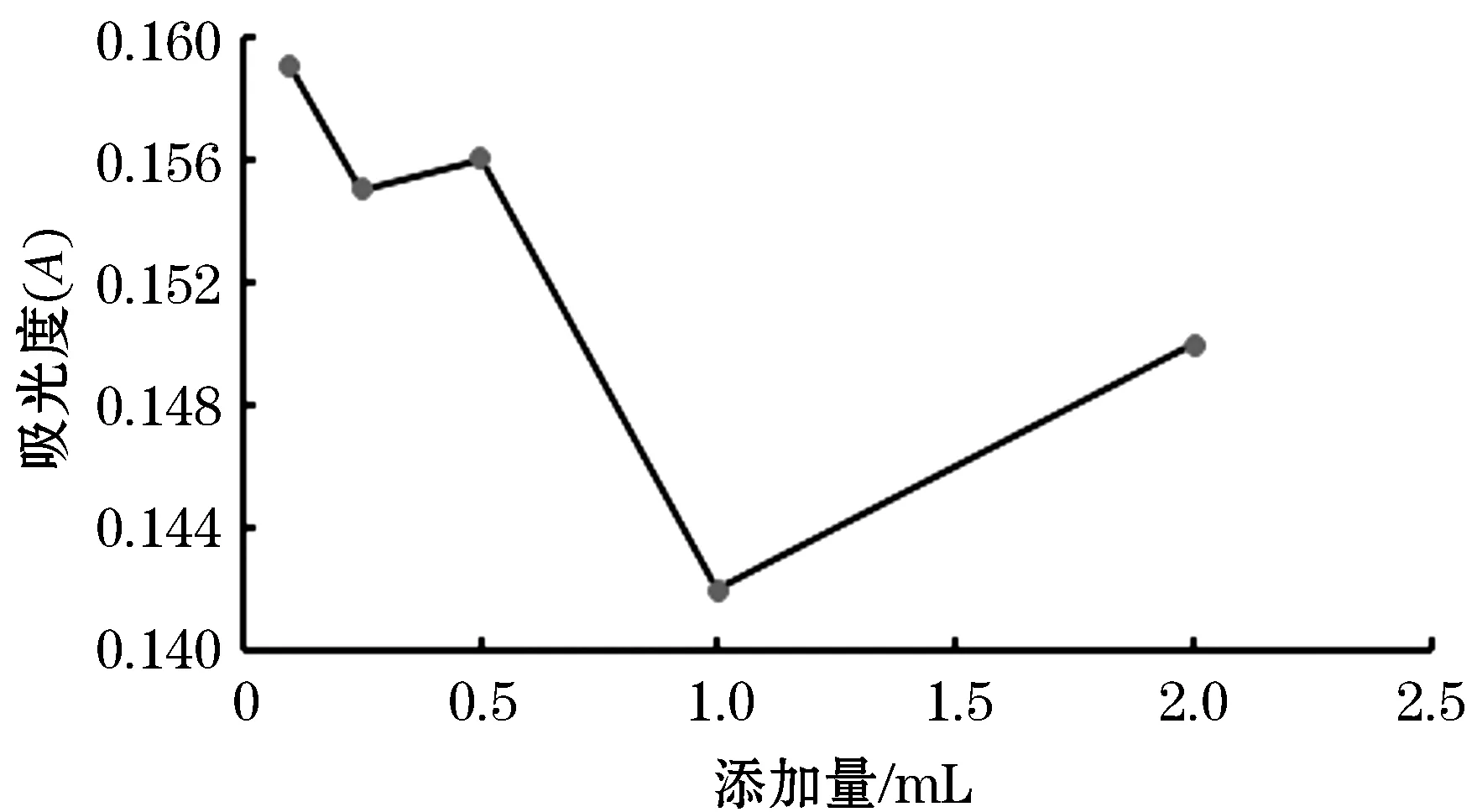
图3 功能化Fe3O4加入量对Cu2+去除体系的影响结果
由图3可看出,功能化Fe3O4混悬液的加入量对Cu2+去除体系有一定的影响.功能化Fe3O4混悬液的加入量在0.1~0.25 mL之间,随加入量的变大,吸光度处于缓慢下降阶段;加入量处于0.25~0.5 mL之间,随加入量不断变大,吸光度值处于缓慢上升阶段;加入量在0.5~1.0 mL之间时,随加入量的变大,吸光度值处于快速下降阶段;加入量在1.0~2 mL之间,随加入量的变大,吸光度快速上升.因此,在正交设计优化试验中功能化Fe3O4混悬液的加入量选取0.5、1和2 mL.
2.3.2 反应温度对Cu2+去除体系的影响
由图4可看出,当反应温度在25~30 ℃范围时,随着反应温度的不断上升,吸光度逐渐降低;在30~35 ℃之间时,吸光度快速下降,并在35 ℃时到达最低点;在35~40 ℃时,吸光度快速上升;在40~45 ℃时,吸光度上升速率有所减小,但依然处于上升阶段.说明温度过高会使活性减弱.因此正交设计优化的温度选取30、35 ℃和40 ℃.
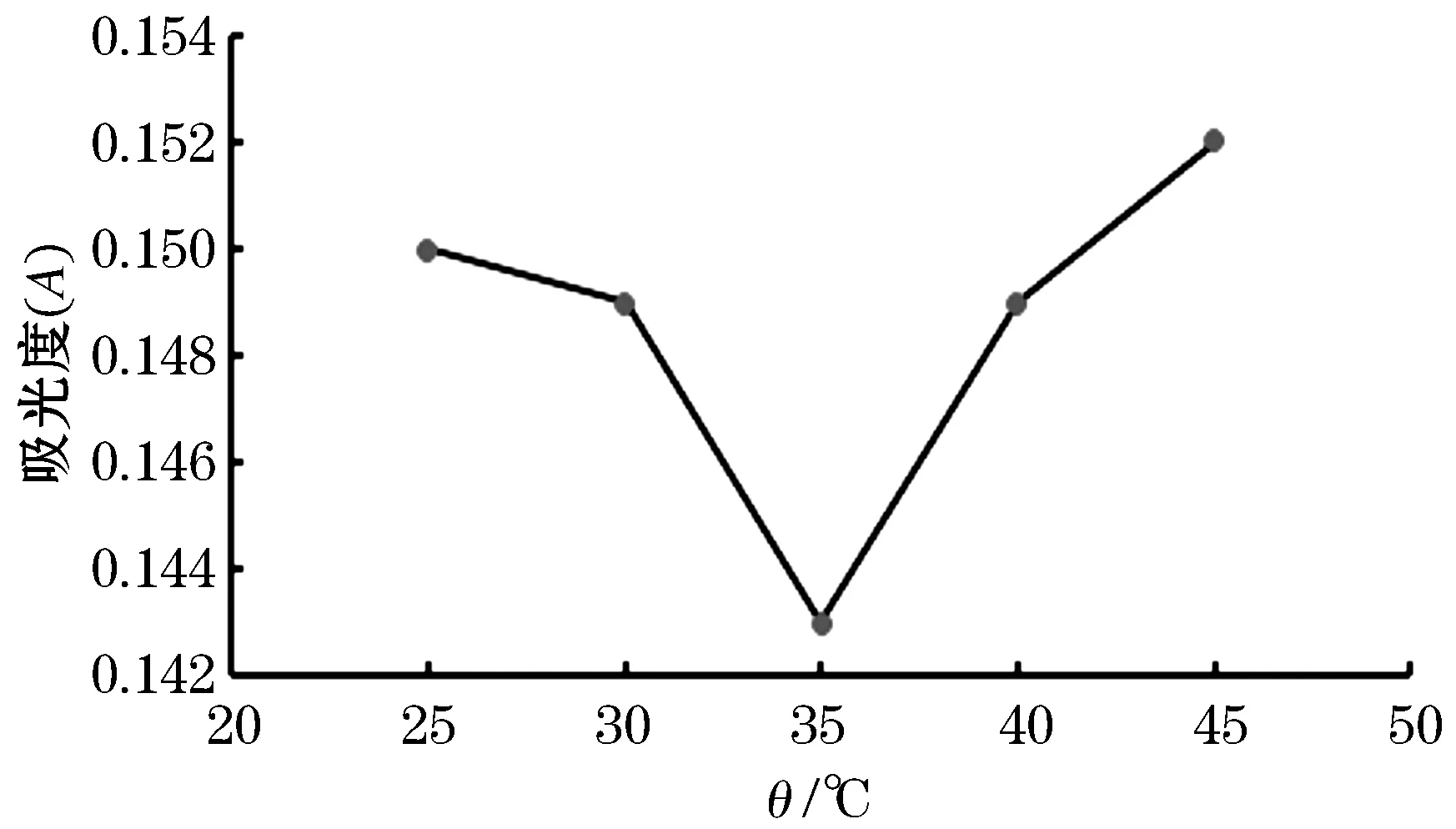
图4 反应温度对Cu2+去除体系的影响结果
2.3.3 反应时间对Cu2+去除体系的影响
确定波长794 nm处的吸光度作为单因素优化的指标.如图5所示,反应时间对Cu2+去除体系没有显著影响.随反应时间不断增加,吸光度没有明显变化.

图5 反应时间对Cu2+去除体系的影响结果
2.4 正交试验结果分析
正交实验基于上述单因素优化试验的结果,并选择更好数据的3个水平,因素和水平分布见表1.观察3种因素对Cu2+去除体系的影响.以吸光度作为考察指标,根据正交试验结果确定最佳工艺条件.
如表1,对正交设计优化的结果进行分析可知,实验中3个因素对铜离子去除体系的影响主次顺序为:A>B>C,即功能化Fe3O4悬浮液加入量>反应温度>反应时间.确定的最优方案组合为:A1B1C1,即功能化Fe3O4混悬液加入量0.5 mL(经换算为25 mg/mL),温度30 ℃,时间10 min.结合标准曲线方程.采用优化后的体系考察功能化磁性粒子去除铜离子的性能,平均去除量约为45 μmol/g.综合上述分析,可以表明,影响Cu2+去除体系的主要因素是功能化Fe3O4的加入量,反应时间和反应温度也有一定的影响.
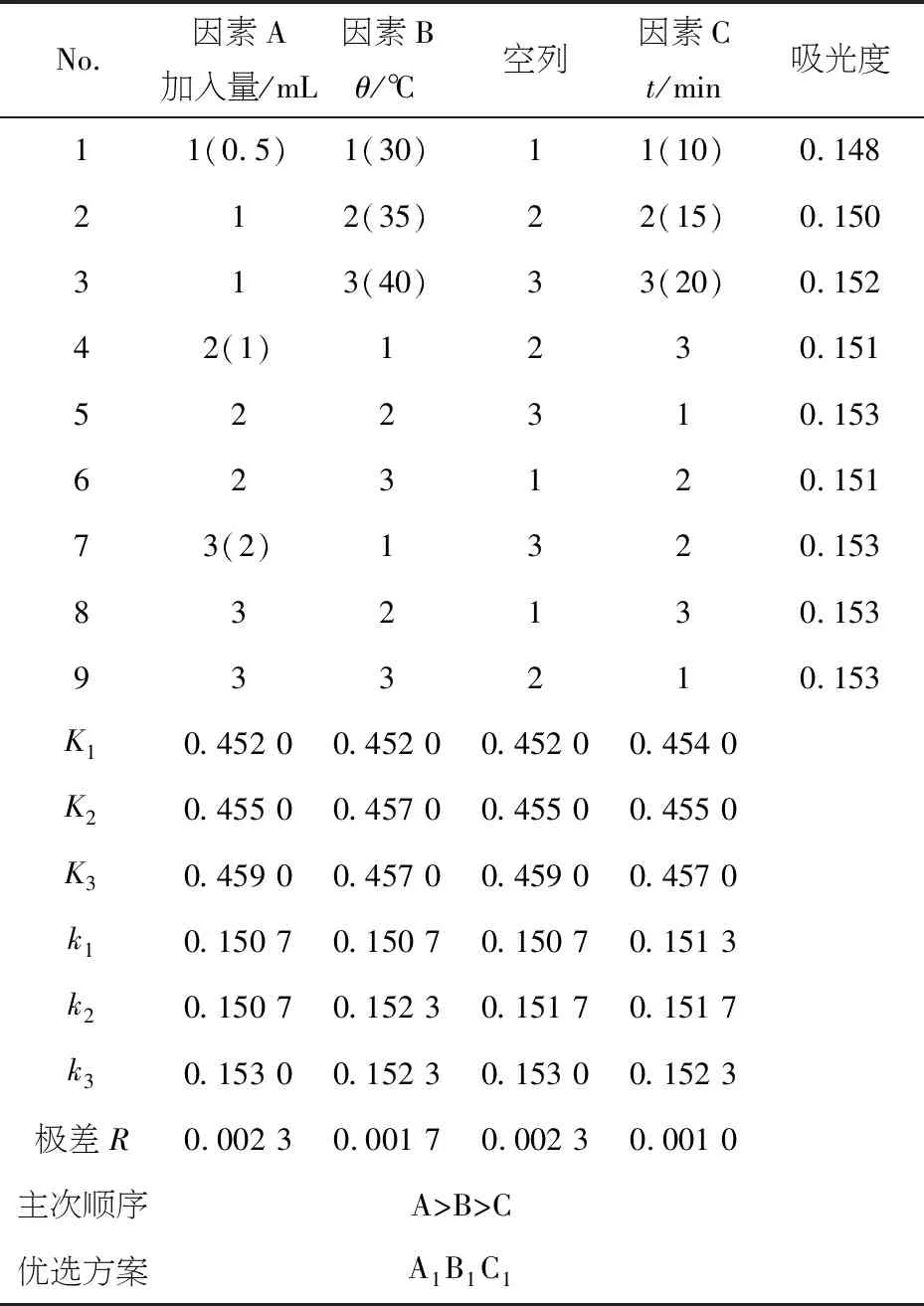
表1 正交实验结果分析
3 结 语
本实验制备Fe3O4磁性纳米颗粒,对其进行表面功能化并表征,得到功能化Fe3O4纳米颗粒的M值为52 emu·g-1.利用制备的功能化Fe3O4粒子检测饮用水中的铜离子,通过单因素实验与正交实验得出各因素对铜离子去除体系的影响,并最终确定最适处理工艺,即功能化Fe3O4的加入量为0.5 mL(经换算为25 mg/mL),反应温度为30 ℃,反应时间为10 min,且对铜离子去除体系的影响主次顺序为功能化Fe3O4悬浮液加入量>反应温度>反应时间.采用优化后的体系考察功能化磁性粒子去除铜离子的性能,确定为45 μmol/g.该方法可以针对环境及饮用水中铜离子及其他种类二价态重金属离子的去除和分析方法的改良,提供基本资料.

