不同亚型多囊卵巢综合征患者血清S100钙结合蛋白A12和高迁移率族蛋白B1水平及其临床意义▲
张 婕 徐望明 桂 娟
(武汉大学人民医院生殖医学中心,湖北省武汉市 430060,电子邮箱:18086514659@163.com)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女常见的一种内分泌疾病,发病率为5%~16%,其发病机制十分复杂,目前尚未明确[1-2]。PCOS患者除了有月经稀发或闭经、雄激素升高的临床特征外,约40%以上的患者合并肥胖[3],部分患者还合并胰岛素抵抗和代谢综合征,严重者可能合并高血压、血脂异常、2型糖尿病等[2-4]。有研究表明,肥胖的PCOS患者早期容易发生可逆性动脉粥样硬化,但是目前尚缺乏PCOS增加心血管疾病发生率和死亡率的大样本终点研究[2,5]。S100钙结合蛋白A12(S100 calcium binding protein A12,S100A12)是S100蛋白家族成员之一,能通过与晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)结合激活炎症信号通路从而介导炎症的发生,并在心血管疾病中起着重要作用[6-7]。高迁移率族蛋白B1(high-mobility group box 1 protein,HMGB1)是一种普遍存在的参与转录调控、DNA复制修复和核小体组装的核蛋白,其在炎症的病理过程中起重要作用,而后者是动脉粥样硬化发生和发展的重要病理生理机制之一[8-9]。此外,有研究表明PCOS患者血清HMGB1水平与血管内皮功能障碍密切相关[10]。本研究旨在分析不同表型的PCOS患者血清HMGB1与S100A12的表达情况及其临床意义。
1 资料与方法
1.1 临床资料 纳入2017年12月至2018年10月在我院生殖医学中心接受助孕治疗的94例PCOS患者,年龄(30.21±3.43)岁,体质量指数(body mass index,BMI)为(24.05±3.20)kg/m2。纳入标准:均符合鹿特丹PCOS诊断标准[11];年龄≤35岁;入组前3个月未接受激素类药物治疗。排除标准:无库欣综合征、卵巢肿瘤、肾上腺皮质增生以及其他可引起内分泌改变的疾病。根据BMI将PCOS患者分为正常BMI-PCOS组(18.5 kg/m2≤BMI≤24 kg/m2)44例和高BMI-PCOS组(BMI>24 kg/m2)50例,两组年龄分别为(30.02±3.27)岁和(31.23±2.87)岁;按睾酮水平将PCOS患者分为正常睾酮水平-PCOS组(14 ng/dL≤睾酮≤76 ng/dL)48例和高睾酮水平-PCOS组(睾酮>76 ng/dL)46例,两组年龄分别为(29.94±2.93)岁和(31.41±3.21)岁。同时选择40例在门诊体检的健康育龄期妇女作为正常对照组,年龄(28.17±1.11)岁,BMI为(22.59±1.27)kg/m2。正常BMI-PCOS组、高BMI-PCOS组、正常对照组之间的年龄比较,以及正常睾酮水平-PCOS组、高睾酮水平-PCOS组、正常对照组之间的年龄比较,差异均无统计学意义(均P>0.05)。所有患者均签署知情同意书。
1.2 PCOS诊断标准 参照鹿特丹PCOS标准[11]进行诊断:月经稀发或闭经;临床表现或实验室检查为高雄激素血症;卵巢超声检查为多囊样表现,排除其他引起内分泌改变的疾病。符合以上3条中的2条即可诊断为PCOS[11]。
1.3 观察指标的检测方法 收集患者入院后治疗前的睾酮、白细胞计数、血沉检测结果。此外,所有患者及体检者均在月经周期第2~3天清晨空腹状态下抽取肘部静脉血3~5 mL,3 000 r/min低温(4℃)离心处理10 min后收集血清,分别采用人S100A12酶联免疫分析试剂盒(Bio-Swamp公司,批号:HM10235)和人HMGB1酶联免疫分析试剂盒(Bio-Swamp公司,批号:HM11136)检测血清S100A12和HMGB1表达水平。
1.4 统计学分析 采用GraphPad Prism7.0软件进行统计学分析。正态分布计量资料以(x±s)表示,多组间的比较采用单因素方差分析,两两比较采用Tukey检验;各血清学指标的相关性分析采用Pearson检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 不同亚型PCOS患者与正常对照组白细胞计数、血沉、血清S100A12、HMGB1水平的比较 高BMI-PCOS 组血沉、白细胞计数、血清 S100A12和HMGB1水平均高于其他两组(P<0.05),但正常BMI-PCOS组与正常对照组之间差异无统计学意义(P>0.05)。高睾酮水平-PCOS组的血清S100A12水平高于其他两组(均P<0.05),但正常睾酮水平-PCOS组与正常对照组之间差异无统计学意义(均P>0.05);高睾酮水平-PCOS组白细胞计数和血清HMGB1水平均高于正常对照组(均P<0.05),但高睾酮水平-PCOS组与正常睾酮水平-PCOS组之间、正常睾酮水平-PCOS组与正常对照组之间差异均无统计学意义 (均P>0.05)。见表1、2。

表1 高BMI-PCOS组、正常BMI-PCOS组、正常对照组白细胞计数、血沉、血清S100A12、HMGB1水平比较(x±s)
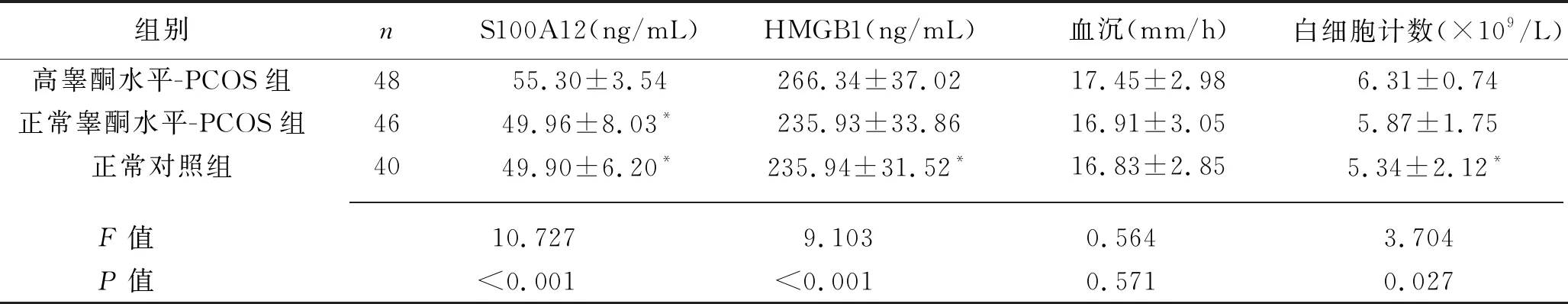
表2 高睾酮水平-PCOS组、正常睾酮水平-PCOS组、正常对照组 白细胞计数、血沉、血清S100A12、HMGB1水平比较(x±s)
2.2 血清S100A12和HMGB1水平与BMI、睾酮的相关性 PCOS患者血清HMGB1、S100A12水平均与BMI呈正相关(均P<0.05),均与睾酮无相关性(均P>0.05)。此外,健康育龄期妇女血清HMGB1、S100A12水平均与BMI或睾酮无相关性(均P>0.05)。见表3、4。
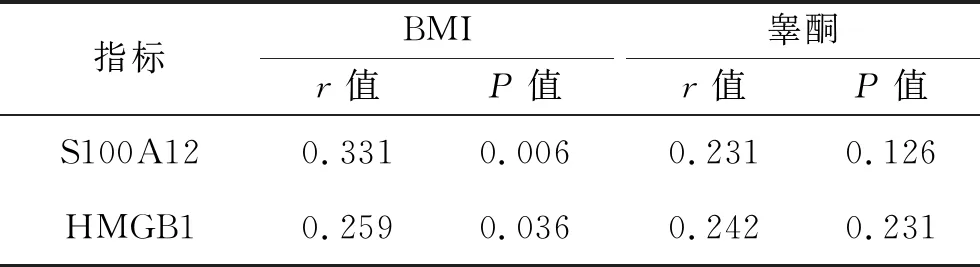
表3 PCOS患者血清S100A12和 HMGB1水平与BMI、睾酮的相关性
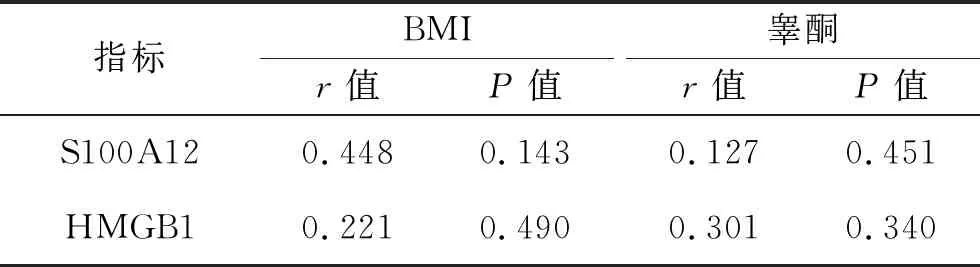
表4 健康育龄期妇女血清S100A12和 HMGB1水平与BMI、睾酮的相关性
3 讨 论
PCOS是育龄期妇女最常见的内分泌疾病,是导致70%女性无排卵的最常见原因[12-13]。PCOS的发病机制尚无定论,但研究表明PCOS患者机体存在慢性低度炎症反应,表现为多种炎症反应标志物(如C反应蛋白、白细胞介素18、单核细胞趋化蛋白1和白细胞计数)水平升高,内皮细胞功能障碍,以及氧化应激反应增强,而这种炎症反应可能与PCOS的胰岛素抵抗及心血管疾病的危险因素具有相关性[14]。 有学者发现,PCOS的发病机制及其代谢改变与晚期糖基化终产物(advanced glycation end products,AGE)具有密切联系,AGE与RAGE结合后激活细胞内相关信号通路,产生氧化应激因子和促炎细胞因子,从而促使PCOS患者病情进一步进展,例如卵巢早衰[15]。PCOS患者常常处于代谢紊乱和慢性低度炎症状态,且代谢紊乱进一步加重全身性慢性炎症[13],而后者是导致卵巢功能障碍的原因之一,与胰岛素抵抗、高雄激素血症、肥胖和动脉粥样硬化等密切有关[16-17]。
S100A12是S100钙结合蛋白家族的成员之一,主要由中性粒细胞表达和分泌,该蛋白家族与钙结合后发生构象改变,使其能够与靶分子相互作用并启动级联反应,并在与血管疾病相关的细胞内表达增加,是一种重要的炎症标志物。S100A12在各种炎症、神经退行性、代谢性和肿瘤性疾病患者血清中的表达水平均明显升高[18]。由钙激活的S100A12与RAGE的相互作用起着重要的致病作用:S100A12可与RAGE结合并激活胞内信号转导通路,促进炎症转录因子的活化,并诱导炎性分子黏附在血管内皮细胞上,从而参与炎症的发病机制[7]。有研究显示,高胆固醇血症患者血清S100A12水平明显升高,心血管事件风险明显增加[7]。Menini等[19]的研究表明,动脉粥样硬化斑块中存在RAGE的表达,且高水平的S100A12可能反映斑块中存在高水平的炎症反应。目前已证实S100A12/RAGE轴的激活可能是炎症与动脉粥样硬化发生的重要因素,而对于肥胖的PCOS患者而言,高脂负荷可增加S100A12的分泌,S100A12又可通过与RAGE结合进一步促进炎症的发生,诱发心血管事件的发生[20]。
HMGB1也称为两性蛋白,是一类广泛分布于高等真核生物的DNA结合蛋白,在炎症、细胞的迁移和分化、肿瘤的发生和发展中均发挥着重要作用。近年来研究显示,HMGB1与动脉粥样硬化、急性冠脉综合征、心肌缺血-再灌注损伤和心力衰竭等相关[21-23]。炎症发生时,HMGB1从胞核转移到胞质并分泌到细胞外,通过与RAGE和Toll样家族受体结合激活核因子κB信号通路,从而促进炎症的发生和细胞因子的产生[24]。HMGB1除了能与RAGE结合激活炎症通路外,在肥胖患者中细胞外的HMGB1可刺激脂肪组织中的免疫细胞的活化,免疫细胞激活后又主动分泌更多的HMGB1,而HMGB1又招募和激活免疫细胞并诱导脂肪细胞死亡,进而刺激炎症的产生[9]。此外,HMGB1可以放大AGE诱导的内皮细胞的氧化应激作用,导致内皮细胞功能损伤,从而参与了心血管疾病的发生和发展,因此PCOS患者血清HMGB1水平升高可能提示其发生远期心血管疾病的风险增加[10]。
在本研究中,肥胖型PCOS患者的血沉及白细胞计数均高于非肥胖PCOS患者及健康女性(P<0.05),非肥胖PCOS患者及健康女性间无差异(P>0.05),这反映肥胖型PCOS患者机体或处于轻度慢性炎症状态。与非肥胖PCOS患者及健康女性相比,肥胖型PCOS患者血清S100A12和HMGB1水平呈高表达(P<0.05);同时,相关性分析提示PCOS患者的血清S100A12和HMGB1水平随着BMI增加而升高(P<0.05),而在健康女性中未发现存在这种相关性(P>0.05),这与肥胖型PCOS患者机体处于轻度慢性炎症状态的现象相符。因此,S100A12和HMGB1可能是肥胖型PCOS患者新的炎症指标。由于S100A12和HMGB1的表达水平还与血管内皮损伤相关,故笔者认为,相较于常规的炎症指标,对于肥胖型PCOS患者,S100A12和HMGB1不仅是反映炎症状态的指标,还可能是远期心血管事件发生风险的预测指标,但需要进一步研究其具体机制。
既往研究表明,睾酮与氧化应激密切相关,在PCOS的慢性低度炎症过程中起协同作用[25]。Wang等[10]发现,PCOS患者血清HMGB1水平高于健康者,并且血清HMGB1水平随着睾酮水平的增加而逐渐升高。 本研究结果显示,高睾酮水平-PCOS组的血清S100A12水平高于其他两组,血清HMGB1水平高于正常对照组(均P<0.05),但是PCOS患者的血清S100A12和HMGB1水平均与睾酮水平无相关性(P>0.05),这可能是本研究样本量较少所致。
综上所述,肥胖型PCOS患者的常规炎症指标及血清S100A12、HMGB1水平均较非肥胖PCOS患者及健康女性升高。PCOS患者血清HMGB1和S100A12水平均与BMI呈正相关,S100A12与HMGB1可能是反映PCOS患者慢性低度炎症的新指标。高雄激素水平的PCOS患者血清S100A12亦升高,但S100A12、HMGB1与PCOS患者的高雄激素水平的相关性有待进一步研究。由于本研究样本量较少,仍需要进行大样本量的研究以验证所得结论,并进一步探索S100A12和HMGB1在肥胖型PCOS患者发生心血管疾病中的具体作用机制。

