基因工程表达内含肽介导的抗菌肽(MME)及其酰胺化
叶若柏 吴珍红 缪晓青


摘要:【目的】探讨在巯乙基磺酸钠(MESNa)与碳酸氢铵(NH4HCO3)存在下,对在大肠杆菌上表达的重组融合蛋白中内含肽(Intein)用硫醇(DTT)进行自剪切,促使抗菌肽(MME)碳末端实现酰胺化。【方法】构建用大肠杆菌表达内含肽介导的MME重组质粒,通过表达获得依次由“组氨酸、Sumo标签、MME、内含肽”构成的融合蛋白,用镍柱及透析进行纯化,在MESNa和NH4HC03存在下,用DTT对内含肽进行白剪切,促使MME碳末端酰胺化,肠激酶切割、纯化,得到碳末端酰胺化的MME。质谱和二级串联质谱配合使用,检測MME及其碳末端酰胺化。【结果】通过PCR,鉴定融合蛋白,其基因片段为837bp,符合预期。质谱鉴定得MME相对分子量为3057.7与其理论值3057.64一致。二级串联质谱检测得MME碳端碎片的分子量为1214.728,与碳末端酰胺化的MME碳端碎片理论分子量1214.739相符,匹配度为45,表明本研究制备的MME碳末端已被酰胺化,该蛋白为可溶。【结论】用大肠杆菌成功地表达了重组融合蛋白,在MESNa与NH4HCO3存在下,促进了内含肽白剪切,MME碳末端被酰胺化,实现了简单的“一步法”制备。质谱与二级串联质谱配合使用,可灵敏、简单地对碳末端酰胺化多肽进行检测,可作为该项检测方法的一种选择,结果表明,本研究成功地制备了碳末端酰胺化的MME。
关键词:抗菌肽;酰胺化;内含肽介导;自剪切
中图分类号:S816.75
文献标志码:A
文章编号:1008-0384(2020)11-1265-06
0引言
【研究意义】抗生素过度使用出现的食品药残和细菌耐药性问题[1],使畜禽饲养中抗菌问题遇到了极大麻烦。抗菌肽(Antimicrobial peptides,AMPS)抗菌谱广,细菌不大可能对其耐药[2]。但要使AMPS产业化,主要还面临着要提高其活性[3]和半衰期,降低其毒性和生产成本。本课题组设计并化学合成了抗菌能力强、半衰期长、毒性低的碳末端酰胺化的抗菌肽(MME),其氨基酸序列为:GRGDSPKFLHSAKKFGKAFPAVLKVLTTG[4]。本研究探讨通过基因工程表达法,生产目标抗菌肽MME以期降低生产成本。【前人研究进展】获得AMPS方法有3种:从生物体中提取、化学法合成和基因工程表达,其中第三种方法成本最低[5]。基因工程表达系统有多种,其中大肠杆菌(E.coli)表达系统优势明显,因此被广泛采用[6]。碳末端酰胺化的AMPS在人体内有重要的生理功能,其碳端末端的α-酰胺基对AMPS的活性起着很重要作用,有些AMPS在酰胺化前后的生物活性相差可达万倍[7];其还可起保护作用,减弱蛋白酶对AMPS的降解,延长AMPS的半衰期[8]。可是大肠杆菌直接表达的多肽产物碳末端均为羟基。为此,研究者提出先用基因工程手段表达碳末端为羟基的多肽,然后再进行第二步的酰胺化修饰,最终获得碳末端酰胺化的目标多肽。如:重组表达α-酰胺化酶在体外进行多肽C端酰胺化,用溴化氰裂解融合表达产物所得的鲑鱼降钙素的体外酰胺化加工。但这些工艺都存在一些不足,前者在酰胺化过程中需提供酰胺化工具酶,制备中纯化步骤多,技术要求较高,成本较大[9];后者在酰胺化过程中要使用溴化氰[10],会对环境造成污染,制约了他们的大规模生产。现在研究者仍投入大量精力,以期开发出更完善的工艺[7]。存在于前体蛋白结构中的内含肽(Intein)序列,能从前体蛋白中白我剪切,还能将剪切下的两侧肽链连成肽键。Li Yifeng[11]对内含肽的生物应用做了较全面的介绍,周冠、俞超等[7,12]用内含肽介导表达天蚕素多肽,仅用硫醇DTT对表达的融合蛋白中含有的内含肽进行自剪切,同时使融合蛋白中含有的抗菌肽碳末端实现酰胺化。Stevens A J[13]在用DTT使内含肽自剪切时,加入了NH4HC03,以利于多肽碳末端的酰胺化。对碳末端酰胺化的抗菌肽的检测,也是困扰研究者的又一大问题[14]。【本研究切人点】前人研究表明,用大肠杆菌表达系统,最终要获得碳末端酰胺化的AMPS还存在不少困难,主要问题是促进表达产物碳末端的酰胺化。通过酰胺化酶对大肠杆菌表达所得前体蛋白进行酰胺化与用化学合成制备法比较,虽可简化纯化工艺[14],但需二步法制备[7],过程仍较复杂;用内含肽介导在大肠杆菌上表达含MME的融合蛋白,通过DTT实现内含肽白剪切,虽可实现一步法制备碳末端酰胺化多肽,但酰胺化过程困难[7,12]。本研究探讨在上述酰胺化体系中,引入巯乙基磺酸钠(MESNa)和碳酸氢铵(NH4HCO3),促进MME碳末端酰胺化的进行;将质谱和二级串联质谱配合使用,鉴定MME,并检测其碳末端酰胺基的存在。【拟解决的关键问题】本研究探讨在MESNa和NH4HCO3存在下,用DTT对内含肽进行白剪切,促进多肽碳末端酰胺化;将质谱与二级串联质谱配合使用,希望能探索一种灵敏、简单地检测AMPS碳末端酰胺化的方法,促进对多肽碳末端酰胺化的研究。
1材料与方法
1.1主要试剂、仪器及材料
1.1.1主要试剂与仪器 质粒抽提、凝胶回收试剂盒(天根生物公司),NdeI、XhoI和肠激酶(EK)[TaKara(大连)公司],蛋白maker[TaKara(大连)公司],大肠杆菌BL21(DE3)(本室保存),PET30a(本室保存),6×His标签抗体(上海生工),IPTG、硫醇(DTT)(Solarbio),Ni-NTA beads 6FF(天地人和公司),其余试剂为国产分析纯,电泳系统、成像系统(Tahon),半干电转仪(Tahon),紫外可见分光光度计(日本HITACHI),高效液相-电喷雾质谱( Aglient)。
1.1.2主要溶液配制 缓冲溶液Buffer简记:Buf,Buf A中DTT浓度为1mmol·L-1,Buf(B、C、D)中咪唑浓度分别为20mmol·L-1、40mmol·L-1和500mmol·L-1,上述缓冲液的NaCI、Na3PO4浓度分别为500mmol·L-1和25mmol·L-1, pH=7.5;Buf(E、F、G、H)中咪唑浓度分别为0、20mmol·L-1、40mmol·L-1、250mmol·L-1,上述缓冲液中的Tris、NaCl、甘油的浓度分别为20mmol·L-1、300mmol·L-1和10%,pH=8.0。
1.2表达载体的建立、合成
Sumo标签常作为融合标签,它是由一系列特定的氨基酸组成,在表达过程中可促进靶蛋白的正确折叠,提高重组蛋白表达量。本研究构建由“组氨酸标签+Sumo标签+MME+内含肽”组成的融合蛋白基因,为使肠激酶(EK)能识别切割位点,在Sumo标签和MME之间设置DDDDK(天冬氨酸-天冬氨酸-天冬氨酸-天冬氨酸-赖氨酸),以便将MME从表达的融合蛋白中切割下来。在融合蛋白基因的两侧设置酶识别位点(Ndel-XhoI),以连接表达载体。将MME基因序列针对大肠杆菌偏爱的密码子进行优化,合成基因至pET30a载体中构成重组质粒(委托杭州生物科技公司)。将其热激转入BL21(DE3)感受态细胞中,得到重组菌后,将其铺展于含抗性的LB板上,在37℃下恒温16h。
从平板上挑取阳性单克隆,抽提质粒,通过上游引物:ATGCATCATCATCATCACCATGGTA GCGATAG和下游引物:ATTACTGGCAACCAGGCCGTTTTTC(委托上述公司合成),进行融合蛋白基因片段PCR扩增。阳性单克隆菌株委托大连生物公司(Takara)测序。
1.3融合蛋白表达、纯化及鉴定
取1.2中的重组菌,将其转入含抗生素的LB液中,37℃、220r·mm-1培养15h后,以1:90(体积比)接种至LB培养液中,测得A600约为0.8时,在IPTG浓度为0.2mmol·L-1、15℃下,震荡诱导18h。离心并将菌体重悬浮于BufA中。取少量悬浮液超声破碎,离心后分别制备沉淀与上清样品。其余加Ni-NTA(10mL),破碎,置4℃纯化2h,转移至空柱管内,排出流出液后,依次用Buf B、Buf C清洗,用BufD洗脱,分别得各试样。
1.4 DTT剪切、EK酶切及其Ni柱纯化
将经BufD洗脱样透析至BufA中,加入终浓度为50mmol·L-1的DTT,再加MESNa至终浓度为100mmol·1-1,25℃反应48h,再加入终浓度为1mol·L-1的NH4HCO3,并调节PH为8.5,4℃反应16h。将反应产物透析至BufE中,加Ni-NTA(5mL),4℃纯化1h。将其转入空柱管内,收集流出液,依次用BufF、BufG清洗,用BufH二次洗脱,将洗脱液透析至BufE中,加适量EK混匀,4℃反应15h,取酶切后样品,往上述酶切液中加入Ni-NTA(5mL)纯化后,转移至空柱管内,收集流出液(产物MME)。
1.5质谱鉴定MME
参考周冠[7]的方法,对经内含肽白剪切和EK切割并经纯化的样品MME进行质谱鉴定。
1.6二級串联质谱鉴定DTT剪切位置
将经DTT处理及亲和纯化的样品用2%乙腈和0.1%的甲酸充分溶解。在Eksigent 425+TripleTOF6600液质联用仪系统上进行分析(委托中国科学院遗传研究所分析)。多肽富集柱型号为200μm×0.5mmChromXP C18-CL 3μm120A,分析柱为75μm×15cm ChromXP C18-CL 3μm 120A,流动相A为95%水+5%乙腈+0.1%甲酸,流动相B为95%乙腈+5%水+0.1%甲酸,富集柱流速为3μL·min-1,分析柱流速为300nL·mmin-1。质谱采集参数:一级谱图采集范围为(m/z)350-1500,采集累计时间为250ms;候选母离子为40个,动态排除时间为22s,二级谱图采集范围为(m/z)100-1500,采集累计时间为75ms;离子源电压为2.4kv,GS1为5,帘气为35,去簇电压为80,CES为5。
2结果与分析
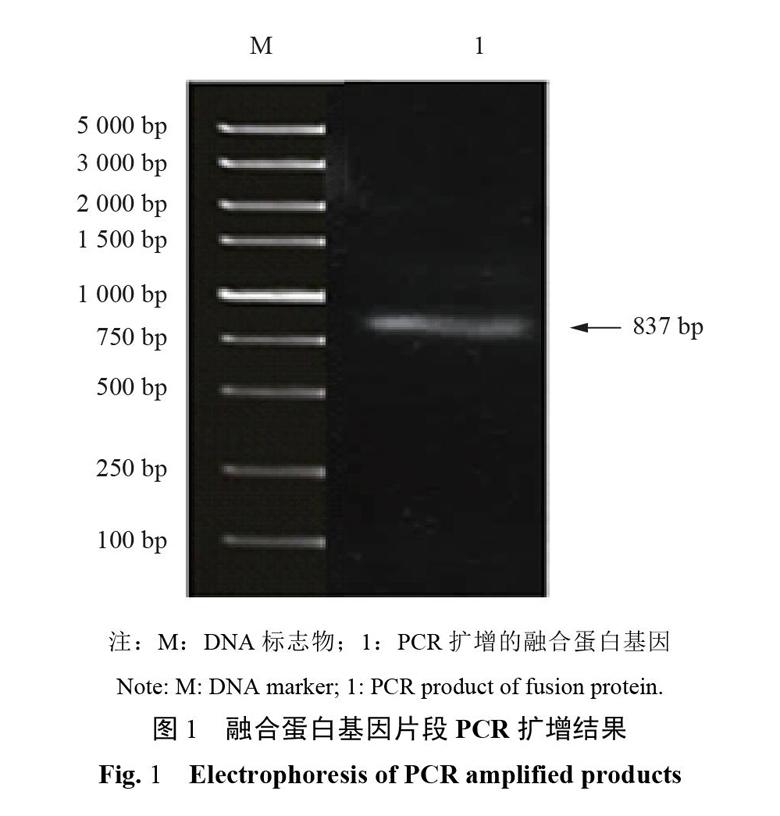
2.1PCR扩增融合蛋白基因片段
由图1可见,PCR扩增的融合蛋白的基因片段为837bp,符合预期。测序结果也符合原设计,表明成功地构建了表达载体。
2.2融合蛋白表达、鉴定
由图2可见,泳道(1-6)的样品中,主要是摩尔质量为32KD左右的表达产物,这与所设计的融合蛋白的理论分子量一致。该蛋白的溶解性好。各泳道条带清晰,表明融合蛋白含量较高,其中上清液样品和流出液样品的条带拖带情况较严重,其杂质含量较高。经过纯化之后的样品条带基本无拖带,蛋白纯度较高。
2.3表达多肽(MME)的酰胺化及纯化
图3可见,表达的融合蛋白在MESNa和NH4HCO3存在下,通过内含肽白剪切和EK切割可得分子量约为3.1KD的表达产物,与酰胺化MME的分子量一致。
2.4质谱鉴定MME分子量
用质谱表征样品MME得图4,图4中MME的高丰度离子峰的质荷比为612.55,则相对分子量为3057.7,与其理论分子量3057.64一致。
2.5二级串联质谱表征MME酰胺化
用二级串联质谱鉴定样品,得表1[表中2824碎片:Amidated-酰胺化;(Protein C-term)-蛋白碳端末端]。由表1可知,2824号碎片[K.AFPAVLKVLTTG.-+Amidated(Protein C-term)]与2841号碎片(K.AFPAVLKVLTTG.-)它们的氨基酸序列相同,仅是前者碳末端为氨基,后者为羟基,氨基分子量为16,羟基分子量为17,故它们的分子量相差1,这表明2824号碎片碳末端被酰胺化,结合质谱测定结果,可知样品中存在碳末端被酰胺化的MME。
用二级串联质谱鉴定样品,还可得图5,2824号碎片在离子流色谱中的保留时间为43.158min,由图5可知,该碎片的离子流色谱峰面积为1846,通过峰面积归一化法,可得2824号碎片的含量为20%左右,表明样品中还含有杂质。还后续将继续探讨优化工艺指标。
通过质谱和二级串联质谱配合使用,对MME的检测,表明试验成功地制备了碳末端酰胺化的MME。
3讨论与结论
如前所述的“一步法”[7,12],仅通过DTT使融合蛋白中的内含肽进行白剪切。本研究在DTT对内含肽进行自剪切的体系中,引入了MESNa和NH4HCO3,这样在体系中就能同时产生2种反应:一种是按上述反应[7,12]进行,另一种以图6所示的历程进行[15]。
“一步法”制备中,通过内含肽的白剪切,实现多肽的酰胺化是过程的关键步骤,这样当2种反应同时进行时,将促进平衡往产物方向移动,有利于多肽碳末端酰胺化的进行[15]。
一种制备过程的建立,必须要有对产物进行简单、准确的检测方法,才有对所研究问题的评价基础,但对抗菌肽碳末端酰胺化结构的检测方法至今还不完善。建立在质谱与特异性抗体检测基础上的“斑点印迹”法[14],仅适用于酰胺化过程中要除去碳末端一个氨基酸的“二步法”制备;“毛细管电泳”法[16]由于重现性差,影响了其应用。多肽的酰胺化存在转化率的问题,其碳末端已被或未被酰胺化多肽的分子量仅相差“1”,这已落人质谱测量的误差范围,因此仅用质谱鉴定分子量的方法来研判所得酰胺化多肽产物是不妥的。本研究用二级串联质谱检测碳末端酰胺化抗菌肽,通过将感兴趣的多肽碳端碎片入选为二级串联质谱的候选母离子,精确测量其分子量,并通过离子峰面积归一化计算,可研判产物酰胺化效果。本法在结构上找到依据,从理论上证明多肽碳末端是否酰胺化。该法灵敏度高,方法简单。
本研究用大肠杆菌为工程菌表达前体蛋白,通过DTT对内含肽白剪切时,引入MESNa和NH4HCO3,可促进酰胺化的进行[15],所得抗菌肽溶解性好;并提供了将质谱与二级串联质谱配合使用,鉴定碳末端酰胺化的抗菌肽,试验所得酰胺化碳端2824号碎片含量为20%左右。该法是对碳末端酰胺化多肽结构进行检测的一种灵敏、简单的方法。试验表明,本研究用简单的一步法成功地制备了碳末端酰胺化的抗菌肽MME。
致谢:感谢杭州生物科技公司张建飞老师对本试验提供的帮助。
参考文献:
[1]LIN J G,XIA L Z,LIANG J X,et al.The roles of glucose metabolicreprogramming in chemo- and radio-resistance [J]. Journal ofExperimental&Clinical Cancer Research,2019,38:218.
[2]Moravej H,Moravej Z, Yazdanparast M,et al. Antimicrobial peptides:features,action,and their resistance mechanisms in bacteria [J].Microbial Drug Resistance,2018,24(6):747-767.
[3]YUAN Y P,ZAI Y,XI X P,et al.a novel membrane-disruptiveantimicrobial peptide from frog skin secretion against cystic fibrosisisolates and evaluation of anti-MRSA effect using Galleria mellonellamodel [J]. Biochimica et Biophysica Acta. General Subejects, 2019,1863(5):849-856.
[4]葉若柏,吴珍红,缪晓青.具有抗肿瘤和抗菌活性的长效改性蜂毒肽(GPG)设计及其生物活性评价[J].中国农学通报,2020,36(16):34-41.
YE R B,WU Z H,MIAO X Q Design and bioactivity evaluation oflong-effective modified melittin (GPG) with antitumor andantibacterial function[J].Chinese Agricultural Science Bulletin,2020,36(16): 34-41.(in Chinese)
[5]祁丽,姜宁,张爱忠,等.抗菌肽多基因表达技术与策略[J].黑龙江畜牧兽医(上半月),2016(8):52-56.
QI L, JIANG N, ZHANG A Z,et al. Multi-gene expression technologyand strategy of antibacterial peptides [J]. Heilongjiang AnimalScience and Veterinary Medicine,2016(8):52-56.(in Chinese)
[6]QUINTERO-HERNANDEZ v,ORTIZ E,RENDON-ANAYA M, etal. Scorpion and spider venom peptides: Gene cloning and peptideexpression [J]. Toxicon: Official Journal of the International Societyon Toxinology,2011,58(8):644-663.
[7]ZHOU G,LI L,DENG W. et al. Intein-mediated recombinantexpression of Cecropins AD, its amidation and application [J]. Journalof Parasitic Biology, 2016,11(8):705-709.
[8]FUHLENDORFF J,GETHER U,AAKERLUND L,et al. Leu31,Pro34]neuropeptide Y: A specific Y1 receptor agonist[J].Proceedings of the National Academy of Sciences of the United Statesof America,1990, 87(1):182-186.
[9]赵波.酰胺化Exendin-4多肽的重组制备方法:CNl693459[P].2005-11-08.
[10]RAY M V L,VAN DUYNE P, BERTELSENT A H. et al. Productionof recombinant salmon calcitonin by in vitro amidation of anEscherichia coli produced precursor peptide [J]. Bio/Technology,1993,11(1):64.
[11]LI Y F.Split-inteins and their bioapplications [J]. BiotechnologyLetters, 2015, 37(11):2121-2137.
[12]俞超,周冠,李蕾,等.一种利用基因工程高效表达酰胺化EC07的方法:CN105274128A[P]. 2016-01-26.
[13]STEVENS A J,BROWN Z Z,SHAH N H,et al.Design of a splitintein with exceptional protein splicing activity [J]. Journal of theAmerican Chemical Society,2016,138(7):2162-2165.
[14]YANG Y H,CHEN H,YU C,et al.In vitro amidating processing ofproducts expressed by gene engineering [J]. Acta Biochimica etBiophysica Sinica,2000(3):312-315.
[15]ALBERTSEN L,SHAW A C,NORRILD J C,et al.Recombinantproduction of peptide C-terminal α-amides using an engineeredintein [J].Bioconjugate Chemistry,2013,24(11):1883-1894.
[16]汪智红,杨宇虹.用毛细管电泳法进行C端酰胺化结构分析和醐胺化酶活性测定[J].生物化学与生物物理学报:英文版,1998.,30(1):21-25.
JIANG Z H,YANG Y H. Analysis of C-terminal amidating structureand determination of amidating enzyme activity by using capillaryelectrophoresis [J]. Acta Biochimica et Biophysica Sinca, 1998,30(1):21-25.(in Chinese)
(责任编辑:吴宇琳)
叶若柏,吴珍红,缪晓青.基因工程表达内含肽介导的抗菌肽(MME)及其酰胺化[J].福建农业学报,2020,35(11):1265-1270.
YE R B,WU Z H,MIAO X Q.Intein-mediated Expression in E. coli and Amidation of Antimicrobial peptide MME [J].Fujian Journal of AgriculturalSciences,2020,35(11):1265-1270.
收稿日期:2020-10-10初稿;2020-11-05修改稿
作者簡介:叶若柏(1979-),男,讲师,硕上,在读博士生,研究方向:药物生物技术(Email: 354650728@qq.com)
*通信作者:缪晓青(1959-),男,硕上,教授,博上生导师,研究方向:天然生物毒素提取、改性及利用研究(E-mail: mxqsf88@126.com)
基金项目:国家自然科学基金项目(51202030)

