竹叶兰种子无菌萌发与组培快繁研究
夏春英 谢小敏 刘江枫 郑诚乐


摘要:【目的】筛选出竹叶兰各生长阶段适宜的培养基配方,建立竹叶兰组培快繁体系。【方法】以竹叶兰种子为材料,采用1/2MS固体培养基,设计正交试验比较不同种类植物生长调节剂和添加物的浓度配比对竹叶兰种子无菌萌发、芽增殖生根等关键环节的影响。【结果】(1)竹叶兰种子萌发的最适培养基为1/2MS+琼脂7g·L-1+蔗糖30.0g·L-1+活性炭1g·L-1+椰子乳100mL·L-1+NAA1.0mg·L-1+6-BA2.0mg·L-1+花宝1号0.5g·L-1,萌发率达83.79%;(2)芽增殖的最适培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA1mg·L-1+6-BA3mg·L-1+NAA0.5mg·L-1+100g·L-1土豆泥,增殖率1.36;(3)芽生根培养的最适培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-1+NAA(0.2-0.5)mg·L-1+100g·L-1香蕉泥;(4)炼苗移栽的最适培养基质为珍珠岩:泥炭土=1:1,成活率高达98%,移栽效果良好。【结论】适宜的椰子乳有利于竹叶兰种子无菌萌发,通过正交试验所建立的竹叶兰组培快繁体系,可为竹叶兰野生种质资源的保护和开发利用提供保障。
关键词:竹叶兰;无菌萌发;炼苗移栽;正交设计;组织培养
中图分类号:S682.31
文献标志码:A
文章编号:1008-0384(2020)11-1215-07
0引言
【研究意义】竹叶兰[Arundina graminifolia(D.Don)Hochr.]隶属兰科(Orchidaceae)竹叶兰属(Arundina),多年生草本植物,在国内主要分布于华南和西南地区,国外主要分布于南亚及东南亚国家,如尼泊尔、印度、缅甸、越南等[1]。竹叶兰是西双版纳地区傣族人民常用的植物药,也是西双版纳傣族自治州民族医药研究所院内制剂的处方药材[2-3];其花朵美丽清雅,花色清新,且花期长,可以盆栽,也可以用于庭院绿化或园林绿化中,具有很高的观赏价值[4-5]。近年来,因自然资源的掠夺性采挖和竹叶兰自身种子繁殖的困难性,野外种质资源大大减少[5-6],已被列为国家II级保护植物[7],因此开展竹叶兰人工组织快繁研究具有重要意义。【前人研究进展】目前,国际上已有关于竹叶兰原生境分布、野生资源调查、传粉机制等方面的一些研究报道[8],国内的相关研究报道多集中在竹叶兰药用成分分析[9-10]方面。關于竹叶兰快繁技术,相关学者开展过竹叶兰引种栽培和无菌播种的研究[11-13]。已有研究表明,椰子乳有利于种子萌发,且添加不同植物生长调节剂也可以促进种子萌发[12-14]。在瓶苗炼苗移栽阶段,黄素荣等[6,15]研究认为水苔是竹叶兰试管苗的最优栽培基质。金建鹏等[16]分析了不同外植体、植物生长调节剂、培养基类型及天然添加物对原球茎诱导、原球茎增殖的影响,筛选出竹叶兰原球茎快速诱导与增殖的培养基配方。以种子为外植体材料开展的植物组织培养是竹叶兰快繁技术研究的内容之一。对兰科植物而言,种子的数量庞大,在快速繁殖研究过程中具有以量取胜的优势。因此,通过组织培养技术,可以获得大量的竹叶兰组培苗,如果将其回归野外,就能扩大野生种质资源,再通过合理开发利用,即可达到保育目的,又能不降低经济价值[17-18]。【本研究切入点】近年来关于竹叶兰的组培快繁技术,尚少见以正交设计方式开展不同生长调节剂及添加物的优化组培研究。【拟解决的关键问题】本试验通过正交试验方法探索不同生长调节剂和添加物等对竹叶兰种子无菌萌发、芽增殖生根等关键环节的影响,以期建立优良的竹叶兰快繁体系,为竹叶兰野生种质资源的保护和开发利用提供保障。
1材料与方法
1.1试验材料
于2018年6月对福州市于山风景区兰花圃内栽培的竹叶兰进行人工授粉,取授粉成功后90d未开裂的果实(异花授粉果)无菌播种。芽的增殖与生根培养材料来白无菌播种80d的无根种胚苗。
1.2试验方法
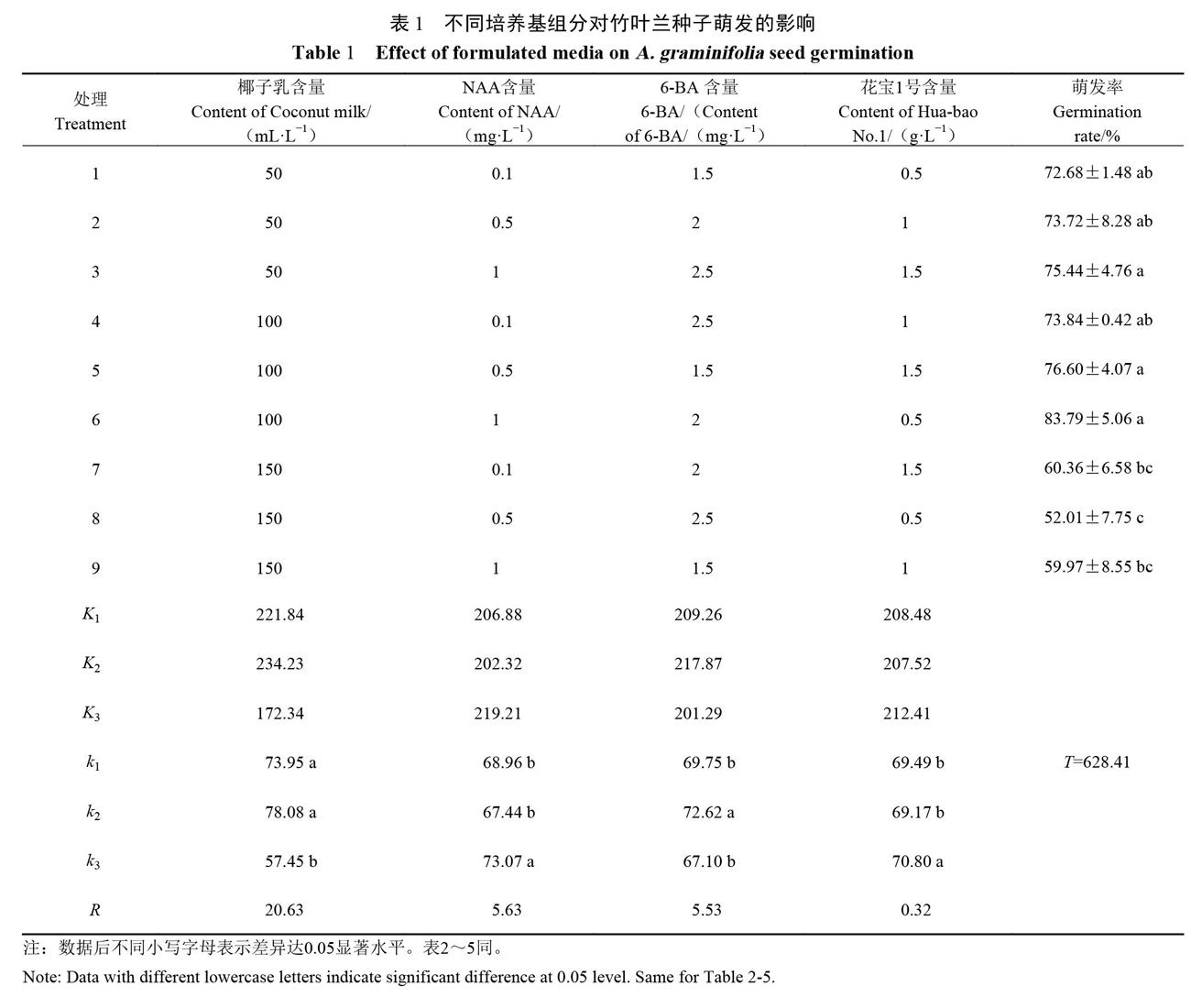
1.2.1种子萌发培养基筛选 培养基:基本培养基成分为1/2MS+琼脂7g·L-1+蔗糖30.0g·L-1+活性炭1g·L-1,pH5.8,121℃下高温高压灭菌20min;以授粉后3个月的种子进行无菌萌发,采用L9(34)正交试验研究不同质量浓度的椰子乳、NAA、6-BA、花宝1号对种子萌发的影响,每种处理15瓶,重复3次。
培养条件:培养温度23±2℃,光照强度30~40μmol·m-2·s-1,光照时间12h·d-1。
种子处理:选取授粉后3个月的竹叶兰新鲜蒴果。洗衣粉中浸洗20min,再用清水冲洗2h,移至超净工作台,加入75%乙醇浸洗1min,无菌水冲洗5次(每次5min),2%次氯酸钠溶液消毒20min,无菌水冲洗6次(每次5min)。用手术刀切除消毒清洗后用灭菌滤纸吸干水分的蒴果两端,剖开蒴果,取出种子,将其均匀撒播在已高温高压灭菌好的培养基表面。
无菌播种后定期观察种子萌发情况,培养60d后,显微镜下统计各组种子萌发率,每瓶随机计数3个视野,以种胚膨大和种皮破裂作为种子萌发的标准。
种子萌发率(%)=(萌发种子数/种子总数)×100
(1)
1.2.2芽的增殖与生根 以无菌播种45d后尚未生根的种胚苗为材料,采用L9(34)正交试验分析IBA、6-BA、NAA、添加物(香蕉泥和土豆泥)对竹叶兰种胚无菌苗芽增殖与生根的影响,培养条件同
1.2.1。每瓶接种5株,3次重复,每次重复10瓶。培养60 d后统计增殖数、生根数,测量株高和根长,筛选出适合竹叶兰种胚无菌苗芽增殖和生根的最佳培养基。
增殖系数(%)=(增殖后芽数/接种外植体数)×100
(2)
生根率(%)=(生根根数/生根不定芽数)×100
(3)
1.2.3炼苗移栽 将生根瓶苗(3~5片叶)移至室外阴凉处,闭瓶培养5d,拧松平盖透气培养5d,使其适应外界环境。从组培瓶中取出生根苗,用清水洗净培养基,用0.1%的多菌灵浸泡5~10min后捞出,移植到不同基质中,使用喷雾器将基质浇透,用水流使基质与苗紧密接触,之后常规水肥管理。移栽60d后测定成活率和株高、叶数、茎粗等指标。
1.3数据处理
所测数据用Excel 2010和SPSS 17.0软件进行统计分析。
2结果与分析
2.1不同植物生长调节剂和添加物对种子萌发的影响
竹叶兰无菌播种10d后,种子由淡黄色转绿,种胚变绿,但未完全突破种皮(图1-A)。播种45d后,种胚完全突破种皮,形成带芽原球茎(图1-B)。正交试验结果显示,椰子乳对种子萌发的影响达到极显著水平(P<0.04),NAA,6-BA和花宝1号对竹叶兰种子萌发的影响不显著(P>0.05)。对培养基各组分浓度进一步分析比较。从表1中各因素的R值比较可知培养基各组分对竹叶兰种子萌发影响的主次关系为椰子乳>NAA>6-BA>花宝1号。由K值大小比较可得适合竹叶兰种子无菌萌发的培养基组成为处理6:1/2MS+琼脂7g·L-1+蔗糖30.0g·L-1+活性炭1g·L-1+椰子乳100mL·L-1+NAA1.0mg·L-1+6-BA2.0mg·L-1+花宝1号0.5g·L-1。
2.2不同植物生长调节剂和添加物对芽增殖的影响
正交试验各因素方差分析结果显示,各培养基组分对竹叶兰无菌播种80d的种胚苗芽增殖的影响均不显著(P>0.05),根据各组分的R值(表2)大小可知,4种组分对芽增殖系数的影响主次关系为IBA>添加物>6-BA>NAA;K值比较可得竹叶兰芽增殖培养的最优组合为处理9:1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA1mg·L-1+6-BA3mg·L-1+NAA0.5mg·L-1+添加物3(100g·L-1土豆泥),增殖系数1.36。
2.3不同植物生长调节剂和添加物对芽生根的影响
正交试验各因素方差分析结果显示,IBA和NAA对竹叶兰无菌播种80d的种胚苗芽生根的影响达极显著水平(P<0.01),6-BA和添加物对芽生根的影响不显著(P>0.05)。
根据各组分的R值(表3)大小可知,4种组分对芽生根数的影响主次关系为IBA>添加物>6-BA>NAA,对根长的影响主次关系为IBA>6-BA>NAA>添加物;K值比较可得竹叶兰芽生根数最多的培养基组合为:1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-1+NAA0.2mg·L-1+添加物1(100g·L-1香蕉泥),根长最长的培养基组合为:1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-+NAA0.5mg·L-+添加物2(50g·L-1香蕉泥+50g·L-1土豆泥)。
综合上述分析结果,本试验中竹叶兰无菌种胚苗芽生根培养的培养基以1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-1+NAA(0.2~0.5)mg·L-1+添加物1(100g·L-1香蕉泥)为宜。
2.4炼苗移栽
竹叶兰组培苗移栽试验结果表明,经炼苗后的竹叶兰已生根瓶苗,移栽,幼苗叶片颜色变深、硬度增加。在60d后统计移栽成活数据和移栽苗生长情况,由表4可知,7种不同基质中的成活率以处理4(v珍珠石:v泥炭土=1:1)的最高,达98%,处理2、3和6次之,成活率分别为88%、86%和80%,处理1最低,仅34%。
此外,通过测量移栽苗的其他表型数据(表5)可知,不同基质中移栽苗的生根数差异不显著,均有5根以上;处理3在株高、中间叶宽和鲜重指标上与其他处理存在显著差异(P<0.05);从叶片数和茎粗指标来看,处理3、4和5均有较好的移栽效果。
3讨论与结论
已有研究表明,适宜的植物生长调节剂或添加物是促进兰科植物种子萌发及后期生长发育的重要因素[19]。目前,在竹叶兰的研究中,组培快繁技术方面的研究已逐渐增多,其中,竹叶兰以种子为外植体材料开展的组培快繁技术基本环节主要包括誘导种子萌发、芽增殖生根与炼苗移栽等,而种子中遗传物质等的差异有可能导致在各个培养环节对外界条件要求各异[20],只有通过反复试验,不断尝试新的试验方法,才能筛选出最适宜的培养基配方。
本研究中,以竹叶兰种子为外植体材料,在前人研究基础上结合正交试验设计方法,探索不同植物生长调节剂、添加物等对诱导种子无菌萌发、促进芽增殖生根等关键环节的影响。通过正交试验结果的数据统计与分析,获得的种子最适萌发培养基配方为1/2MS+琼脂7g·L-1+蔗糖30.0g·L-1+活性炭1g·L-1+椰子乳100mL·L-1+NAA1.0mg·L-1+6-BA2.0mg·L-1+花宝1号0.5g·L-1,萌发率达83.79%。与陈之林等[12]的研究相比,本试验增加了种子萌发培养基中的外源激素成分,方差分析结果显示,椰子乳是影响竹叶兰种子萌发的主要因子,外源激素NAA和6-BA对种子萌发和原球茎膨大的影响效果较小,为非必需,且当椰子乳为100mL·L-1时,萌发效果最好;与张文珠等[14]的研究相比,本试验中的椰子乳较之香蕉泥和酪蛋白等添加物可明显提高种子萌发率,也验证了金建鹏等[16]的种子萌发研究结果。
本试验中,IBA、NAA、6-BA和添加物四个因素对竹叶兰无菌种胚苗芽的增殖效果均不显著,但IBA和NAA对竹叶兰无菌种胚苗芽的生根具有极显著影响。正交试验筛选出适宜竹叶兰种胚苗芽增殖的培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA1mg·L-1+6-BA3mg·L-1+NAA0.5mg·L-1+100g·L-1土豆泥,增殖率1.36;适宜芽生根的培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-1+NAA(0.2~0.5)mg·L-1+100g·L-1香蕉泥。这与其他学者[14]的一些研究结果有所不同,但外源激素对植物的作用机制本就不可一概而论,造成竹叶兰与其他植物[18-19]间差异的原因还有待进一步探索其他植物生长调节剂或添加物的适宜配比和浓度。
移栽成活率是组培能否走向工厂化生产的重要指标。在以往的研究报道中,移栽环境处于非完全的白然状态,竹叶兰组培苗的移栽成活率为80%~85%[12.14]。本试验中,将生根瓶苗练苗适应外界环境后,以7种移栽基质为对比,仅作正常的水肥管理,其他条件处于白然状态,分析炼苗后的竹叶兰幼苗生长和成活情况,试验结果表明,炼苗移栽的最适培养基质为珍珠岩:泥炭土=1:1,成活率高达98%,移栽效果良好。其中,水苔的移栽成活率明显低于其他6种基质,笔者考虑其可能是由于本试验使用的水苔质量较差造成。
本试验通过正交试验方法探索了不同植物生长调节剂、添加物等对竹叶兰种子无菌萌发、芽增殖生根等关键环节的影响。结果表明:种子萌发最适培养基为1/2MS+琼脂7g·L-1+蔗糖30.0g·L-1+活性炭1g·L-1+椰子乳100mL·L-1+NAA1.0mg·L-1+6-BA2.0mg·L-1+花宝1号0.5g·L-1,萌发率达83.79%;芽增殖最适培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA1mg·L-1+6-BA3mg·L-1+NAA0.5mg-L-1+100g·L-1土豆泥,增殖系数1.36;芽生根培养的最适培养基为1/2MS+琼脂7g·L-1+蔗糖30g·L-1+活性炭1g·L-1+IBA0.2mg·L-1+6-BA2mg·L-1+NAA(0.2~0.5)mg·L-1+100g·L-1香蕉泥;炼苗移栽最适培养基质为珍珠岩:泥炭土=1:1,炼苗移栽60d后成活率高达98%。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999: 333-336.
[2]张闯,陈普,陈清华,等.傣药文尚海研究进展[J].中国民族医药杂志.2008,14(10):48-49.
ZHANG C, CHEN P, CHEN Q H,et al.Research progresses of Dai-medicine Arundina graminifolia [J]. Journal of Medicine &Pharmacy of Chinese Minorities,2008,14(10):48-49.(inChinese)
[3]李文军,朱成兰,唐自明.傣藥竹叶兰的生药学研究[J].云南中医中药杂志,2000,21(6):32-33.
LI W J,ZHU C L,TANG Z M. A study on the pharmacognosy of Dai-medicine Arundina graminifolia [J]. Yunnan Journal of TraditionalChinese Medicine and Materia Medica,2000,21(6):32-33.(inChinese)
[4]韦阳连,袁志永,余金昌.竹叶兰最新研究进展[J].天津农业科学,2016,22(7):147-150.
WEI Y L,YUAN Z Y. YU J C. The latest research progresses ofArundina graminjfolia [J]. Tianjin Agricultural Sciences,2016,22(7):147-150.(in Chinese)
[5]曾凌云.海南野生竹叶兰[J].琼州学院学报,2009,16(5):53-54.
ZENG L Y.Wild Arundina graminifolia Hochr in Hainan [J].Journalof Qiongzhou University,2009,16(5):53-54.(in Chinese)
[6]黄素荣,谌振,杨光穗.竹叶兰试管苗驯化栽培技术初报[J].热带农业科学,2015,35(7):19-21.
HUANG S R,SHEN Z,YANG G S.A preliminary study ondomestication and cultivation of Arundina graminfolia tubeseedlings [J]. Chinese Journal of Tropical Agriculture,2015,35(7): 19-21. (in Chinese)
[7]艾叶,谢泰祥,刘江枫,等.竹叶兰根系共生真菌群落结构及生物学功能初探[J].菌物学报,2019,38(10):1631-1642.
AI Y. XIE T X. LIU J F,et al.Community structure and biologicalfunction of the root symbiotic fungi of Arundina graminifolia [J].Mycosystema,2019,38(10):1631-1642.(in Chinese)
[8]SUGIURA N Pollination and floral ecology of Arundina graminifolia(Orchidaceae) at the northern border of the species' naturaldistribution [J].Journal of Plant Research,2014,127(1):131-139.
[9]刘美风,傣药竹叶兰化学成分研究与抗抑郁新药YL102的药学研究[D].北京:清华大学,2004.
LIU M F A studv on chemical composition of Dai-medicine Arundinagraminifolia and a pharmaceutical study on the YL102 0f newantidepressant drugs[D]. Beijing: Qinghua University,2004.(inChinese).
[10]彭霞,何红平,卯明霞,等.竹叶兰的化学成分研究[J].云南中医学院学报,2008,31(3):32-33.
PENG X. HE H P,MAO M X.et al. Studies on chemical constituentsof Arundina graminifolia (D. Don) Hochr[J]. Journal of YunnanCollege of Traditional Chinese Medicine,2008,31(3):32-33.(inChinese)
[11]唐德英,王云娇,李荣英,等.野生竹叶兰引种栽培初报[J].中药材,2005,28(4):263-264.
TANG D Y,WANG Y J,LI R Y. et al.Preliminary report onintroduction and cultivation of wild Arundina graminifolia [J].Jorunal of Chinese Medicinal Materials,2005,28(4):263-264. (in Chinese)
[12]陈之林,曾宋君,温铁龙,等.竹叶兰的无菌播种和试管成苗[J].植物生理学通讯,2006,42(1):66.
CHEN Z L,ZENG S J,WEN T L,et al. Asepsis sowing and in vitropropagation of Arundina graminlfolia Hochr [J]. Plant PhysiologyCommunications,2006,42(1):66.(in Chinese)
[13]黄明忠,莫饶,冷青云,等.竹叶兰和香港毛兰的核型分析[J].中国农学通报,2010,26(12):339-343.
HUANG M Z,MO R,LENG Q Y. et al.The karyotype analysis ofArundina graminifolia and Eria gagnepainii [J]. Chinese AgriculturalScience Bulletin,2010,26(12):339-343.(in Chinese)
[14]张文珠,林炳英,林德钦.竹叶兰的无菌播种快繁技术研究[J].热带农业科学,2011, 31(12):16-19.
ZHANG W Z,LIN B Y. LIN D Q. Aseptic sowing and rapidpropagation technology for Arundina graminIfolia(D.Don)Hochr. [J]. Chinese Journal of Tropical Agriculture, 2011,31(12):16-19. (in Chinese)
[15]黄素荣,谌振,杨光穗.竹叶兰试管苗育苗及园林种植养护技术[J].园艺与种苗,2017(7):36-38.
HUANG S R,SHEN Z, YANG G S. Summary of growing seedlingstechnology with test-tube seedling and planting & maintainingtechnology for landscaping ofArundina graminifolia [J]. Horticulture&Seed,2017(7): 36-38.(in Chinese)
[16]金建鹏,朱根发,杨凤玺.竹叶兰原球茎的快速诱导与增殖[C].//中国园艺学会观赏园艺专业委员会,国家花卉工程技术研究中心.中国观赏园艺研究进展2018.中国园艺学会,2018: 467-471.
[17]刘虹,罗毅波,刘仲健.以产业化促进物种保护和可持续利用的新模式:以兰花为例[J].生物多样性,2013,21(1):132-135.
LIU H. LUO Y B,LIU Z J. Using guided commercialized cultivationmodels to promote species conservation and sustainable utilization: anexample from the Chinese medicinal orchids [J]. Biodiversity Science.2013,21(1): 132-135.(in Chinese)
[18]卓孝康,蘭思仁,彭东辉,等.大苞鞘石斛胚组织培养及植株再生研究[J].福建林学院学报,2014,34 (4):289-296.
ZHUOXK,LAN S R,PENG D H,et al.In vitro tissue culturea andplant regeneration from mature embryos of Dendrobiumwarkianum [J]. Journal of Fujian College of Forestry,2014,34(4): 289-296. (in Chinese)
[19]曾宋君,程式君,张京丽,等.五种石斛兰的胚培养及其快速繁殖研究[J].园艺学报,1998,25(1):75-80.
ZENG S J,CHENG S J,ZHANG J L,et al.Embryo culture andpropagation of Dendrobium in vitro [J].Acta Horticulturae Sinica.1998,25(1):75-80.(in Chinese)
[20]叶秀仙,黄敏玲,罗远华,等.盆花文心兰丛生芽组培快繁技术研究[J].福建农业学报,2016,31(11):1198-1203.
YEX X. HUANGM L,LUOYH,et al. Bud tissue culture and rapidpropagation of Potted Flower, Oncidium [J]. Fujian Journal ofAgricultural Sciences,2016,31(11):1198-1203.(in Chinese)
(责任编辑:翁志辉)
夏春英,谢小敏,刘江枫,等.竹叶兰种子无菌萌发与组培快繁研究[J].福建农业学报,2020,35(11):1215-1221.
XIA C Y,XIE X M,LIU J F,et al. Optimization of Media for Seed Germination and Propagation of Arundina graminifolia[J].Fujian Journal ofAgricultural Sciences,2020,35(11):1215-1221.
收稿日期:2020-04-18初稿;2020-08-06修改稿
作者簡介:夏春英(1996-),女,硕上,研究方向:花卉与景现园艺(E-mail: 1144179784@qq.com)
*通信作者:郑诚乐(1963-),男,博士,教授,研究方向:花卉与景观园艺、果树栽培生理与生化(E-mail: zcl2003@126.com)
基金项目:福州市园林局科研项目(201404)

