个体化肠内营养支持对老年食管癌同期放化疗患者营养状态和疗效的影响分析
卢美珍 林志安 郦守国 施升升 王晓燕 黄俊明

[摘要] 目的 探讨个体化肠内营养支持对老年食管癌同期放化疗患者营养状态和疗效的影响分析。 方法 采用随机数表法将符合入组条件的我院2016年1月初至2019年12月底收治的老年食管癌患者纳入研究对象,共入组126例:研究组(64例),对照组(62例)。所有病患实施的同步放化疗均在我院进行,对照组实施常规营养教育、饮食营养指导及常规营养治疗,研究组实施强化的个体化营养教育和肠内营养支持管理,对比两组的体重丢失情况、体质指数(BMI)、L3骨骼肌质量指数(L3 SMI)、营养相关血液学指标、放化疗不良反应发生率、治疗完成率及近期疗效。 结果 研究组放化疗后的体重丢失率明显低于对照组(P<0.05),体质指数(BMI)、L3骨骼肌质量指数(L3 SMI)均显著高于对照组(P<0.05)。研究组血红蛋白(Hb)、前白蛋白(PA)、白蛋白(ALB)、淋巴细胞计数(LYM)的降低幅度显著低于对照组(P<0.05)。所有入组患者放射性皮肤损伤均表现为 2 级及以下,两组差异比较小无统计学意义(P>0.05);3 级及以上的放射性咽和食管粘膜损伤在两组患者中均未出现,然而对照组的1级和2级放射性咽和食管粘膜损伤发生率均明显高于研究组(P<0.05);两组1~2级骨髓功能抑制发生率无明显差异(P>0.05),但是对照组≥3级骨髓功能抑制发生率明显高出研究组(P<0.05);对照组放化疗后出现 1例放射性肺炎,但两组间差异无明显统计学意义(P>0.05);研究组放化疗完成率为93.75%,明显高于对照组的74.19%,差异有统计学意义(P<0.05),具体表现为未完成放疗总劑量、未行第2周期同步化疗均明显低于对照组(P<0.05)。研究组近期有效率为90.6%,明显高于对照组的74.2%,差异有统计学意义(P<0.05)。 结论 个体化肠内营养支持对老年食管癌同期放化疗患者的疗效有显著促进作用,能有效改善机体营养状态,提升治疗完成率,降低放化疗并发症的发生率,提高老年食管癌病患的治疗依从性及预后。
[关键词] 食管癌;同期放化疗;个体化;肠内营养;营养状态
[中图分类号] R735.1 [文献标识码] B [文章编号] 1673-9701(2020)35-0066-06
[Abstract] Objective To investigate the effects of individualized enteral nutrition support on nutritional status and efficacy in elderly esophageal carcinoma patients treated with concurrent chemoradiotherapy. Methods A total of 126 elderly esophageal carcinoma patients admitted to our hospital from the beginning of January 2016 to the end of December 2019 were enrolled in the study group(64 cases) and the control group(62 cases) by random number table method. Both groups were treated with concurrent chemoradiotherapy in our hospital. The control group received routine nutrition education,dietary guidance and treatment. The study group received intensive individualized nutrition education and enteral nutrition support management. Compared the two groups' weight loss, body mass index(BMI), L3 skeletal muscle mass index, nutrition-related hematological parameters, the toxicities of chemoradiotherapy, the completion rate of treatment,and short-term outcomes. Results Compared with the control group , the study group had significantly lower body weight loss rate after chemoradiotherapy(P<0.05), and the body mass index(BMI)、L3 skeletal muscle mass index(L3 SMI) were significantly higher (P<0.05). The study group had significantly less decreases in hemoglobin(Hb), prealbumin(PA), albumin(ALB) and lymphocyte count(LYM) compared with the control group(P<0.05). The radiation skin injury in the two groups was grade 2 or below, and the difference between the two groups was not statistically significant(P>0.05). There was no grade 3 or above radiation in both groups , but the incidence of grade 1 and 2 radiation pharyngeal and esophageal mucosal injury in the control group was higher than that in the study group(P<0.05). There was no significant difference in grade 1-2 myelosuppression between the two groups(P>0.05), but the incidence of grade ≥3 myelosuppression in the control group was higher(P<0.05). One case of radiation pneumonitis occurred in the control group , but the difference between the two groups was not statistically significant(P>0.05). The chemoradiotherapy completion rate of the study group was 93.75%, significantly higher than 74.19% of the control group, the difference was statistically significant (P<0.05), the specific performance was not completed the total dose of radiotherapy , not the second cycle of concurrent chemotherapy were significantly lower than the control group(P<0.05). The short-term effective rate of the study group was 90.6%, which was significantly higher than 74.2 % of the control group , and the difference was statistically significant(P<0.05).Conclusion: Individualized enteral nutrition support plays a significant role in promoting the efficacy of concurrent chemoradiotherapy for elderly esophageal carcinoma patients. It can effectively improve the nutritional status of the body , improve the completion rate of treatmen,reduce the incidence of complications , and improve the treatment compliance and prognosis of patients .
[Key words] Esophageal carcinoma; Concurrent chemoradiotherapy; Individualized; Enteral nutrition; Nutritional status
我国是食管恶性肿瘤的高发国家,受解剖位置影响其起病较隐匿,早期明确诊断率相对较低,仅有部分患者在吞咽粗硬食物时出现不适,大部分患者待病情发展至中晚期,出现明显的吞咽困难症状时才确诊。临床研究显示,食管肿瘤病患受到食管肿瘤病灶的影响,存在比较高的营养风险,约60%~85%的患者存在不同程度营养不良,居所有恶性肿瘤的第一位,严重影响治疗疗效和副反应[1]。同步放化疗是中晚期无法或不愿手术治疗食管癌的主要有效治疗手段,特别是对病理类型为鳞癌的患者[2]。随着人口的加速老龄化,老年食管恶性肿瘤患者越来越多,但老年人各重要器官机能下降、体质较差、基础疾病较多,发生营养不良状态风险的概率也会更高,而糟糕的身体营养状态会直接增加临床上放射治疗的摆位误差,影响临床中放射治疗精准度,降低了放射治疗的敏感性和影响治疗后的疗效[3,4]。肠内營养支持在晚期消化道恶性肿瘤的治疗中应用广泛,通过补充机体所需的能量及营养素,有助于快速纠正营养状态,明显降低患者治疗期间体重下降程度,提高接受放化疗食管癌患者的治疗耐受性,进而改善食道癌患者的预后[5]。Langius JA等多项研究结果显示了对于放射治疗患者的日常能量需求随着放疗进程进行不断发生变化[6],低碳水化合物、高蛋白质的饮食在有效延缓恶性肿瘤细胞生长并预防癌症的发作方面也有显著的作用[7],为了保证患者合适的能量、营养物质及比重,在肠内营养过程中需要进行个体化评估和肠内营养支持管理治疗,并进行动态调整[8]。本研究进一步探讨个体化肠内营养支持对老年食管癌同期放化疗患者的营养状态和疗效的影响,现汇报如下。
1 资料与方法
1.1 一般资料
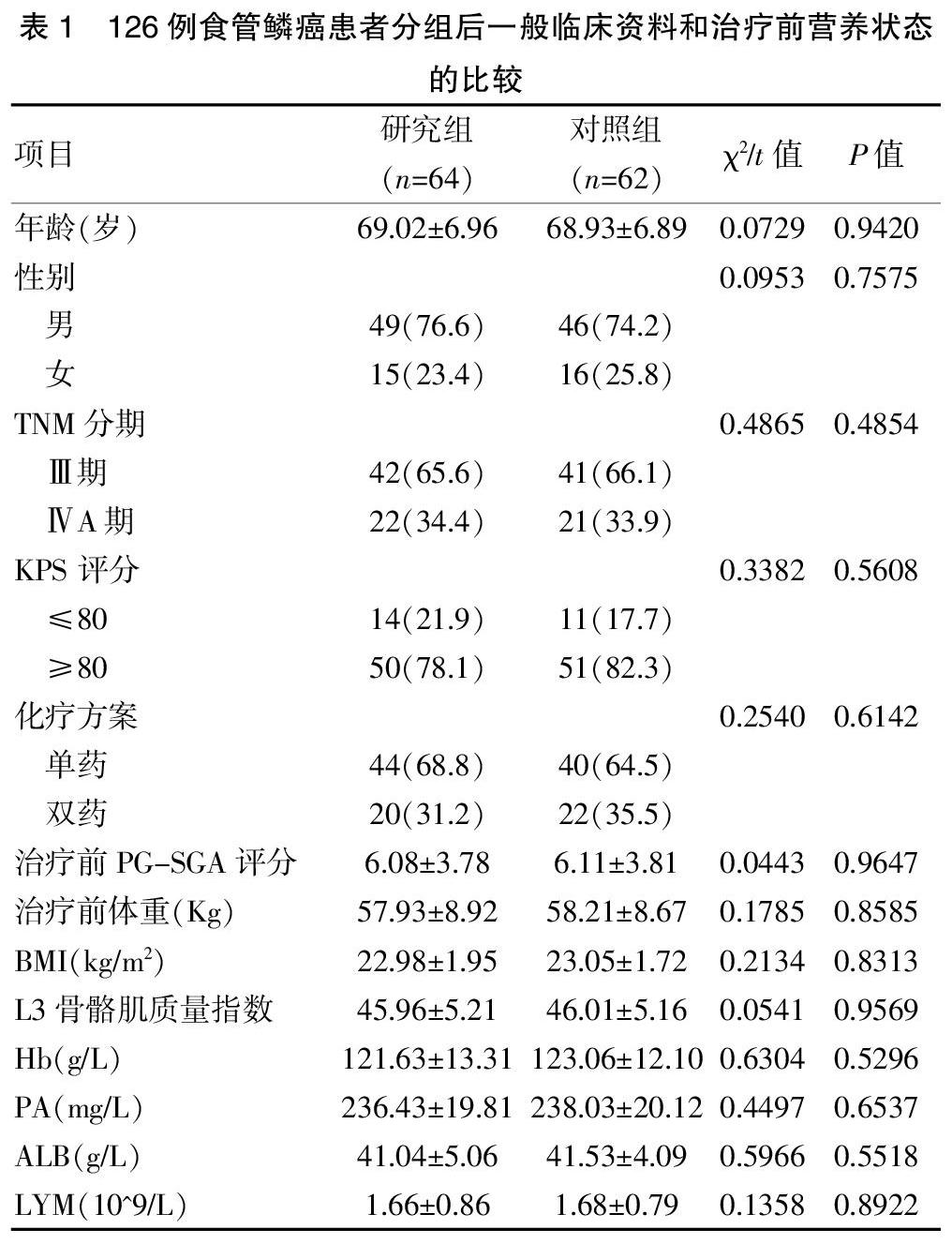
将符合入组条件的本院自2016年1月初至2019年12月底收治的老年食管癌患者纳入研究对象,共入组126例患者。纳入标准:①经组织病理免疫组化证是食管鳞癌;②无手术指征或拒绝接受手术治疗的TNM分期为Ⅲ~ⅣA期初诊初治食管鳞癌;③患者年龄范围为60~78岁;④一般状况卡氏(KPS)评分标准≥70分;⑤患者符合《食管癌放疗患者肠内营养专家共识》[9]中营养不良诊断标准,具备肠内营养适应征;⑥心、肝、肺、肾脏及骨髓基础功能基本正常,均采用同步放化疗方案治疗,无明确放化疗禁忌证。排除标准:①严重的心肝肺肾等脏器疾病;②患者肠内营养辅助不能正常耐受或者是肠道吸收功能异常受损严重;③患者消化道梗阻程度严重,无法经口进食营养仍无法或患者不愿行辅助营养导管置管;④合并其他营养支持相关禁忌证;⑤合并精神疾患、严重的认知功能障碍及语言表达缺陷患者。采用随机数表法将符合入组条件的本院治疗的126例患者纳入研究对象,其中研究组:64例,对照组:62例。对比两组的年龄、性别、TNM分期、KPS 评分、同步放化疗方案及治疗前PG-SGA评分、治疗前体重、体质指数(BMI)、L3骨骼肌质量指数、营养相关血液学指标等无明显差异(均P>0.05),具有临床研究可比性,详见表1。本研究项目已成功通过本院医学伦理委员会审批,所有符合入组条件的患者都知情同意参加本项研究,并正式签署知情同意书。
1.2 方法
1.2.1 同步放化疗 (1)同步化疗:①双药方案:紫杉醇+奈达铂,紫杉醇(安素泰)(澳大利亚:Hospira Australia Pty Ltd 规格:30 mg/5 ml/盒 进口药品注册证号:H20150350剂型:注射剂)135~150 mg/m2静脉滴注,d1;奈达铂(捷佰舒)(南京先声东元制药有限公司 规格:10 mg*5支/盒 国药准字:H20030884 剂型:注射剂)80 mg/m2静脉滴注,d1;每3周为1个疗程。②单药方案:奈达铂单药同步化疗,奈达铂(捷佰舒)(南京先声东元制药有限公司 规格:10 mg*5支/盒 国药准字:H20030884 剂型:注射剂)80 mg/m2静脉滴注,d1,每3周为1个疗程。放疗过程中完成2个周期化疗。(2)放疗:所有入组的患者都用调强放疗(IMRT),患者采用仰卧位,固定用头颈肩膜螺旋CT(Siemens公司,24层大孔径螺旋CT模拟定位机)增强扫描,层厚3 mm扫描,扫描结果数据通过网络传至Eclipse计划系统(Varian公司Eclipse 7.3三维治疗计划系统),根据扫描影像勾画靶区,靶区:GTV为定位CT结合其他影像学所显示的食管肿瘤及阳性淋巴结,CTV包括食管肿瘤上下方向扩3.0 cm,前后左右方向外放 0.5 cm,及相应淋巴结引流区域。GTV、CTV前后左右上下分别外扩0.6cm成为PTV-G、PTV-C,根据解剖界限适当修改。危及器官包括:脊髓、心脏、双肺、食管、气管等。单次量PTV-G:2 Gy/f,PTV-C:1.8Gy/f,1f/d,5f/w,直线加速器6MV-X线调强放射治疗,处方剂量:95%PTV-G 60~66 Gy/30~33f,95%PTV-C 46~50 Gy/23-25f,要求95%计划靶区体积达到超过100%处方剂量照射。脊髓严格要求零体积剂量≥45 Gy/6w;心脏的V30<40%;双肺的V20≤30%、V30≤20%,肺平均剂量Dmean≤13 Gy[7]。
1.2.2 营养治疗 所有研究对象放化疗前、放化疗治疗期间每周使用NRS2002营养风险评分表对其进行营养状态的筛查,评分≥3分筛查评价为具有营养风险;采用PG-SGA量表评估病患营养状况,0-3分:营养良好,4-8分:营养不良(中度),>8分:营养不良(重度);并根据能耗水平、代谢情况、器官功能、人体组成进行综合测定。针对经过评估后存在营养不良风险及诊断为营养不良的病患,实施营养治疗。对照组根据筛查及评估结果实施常规营养教育、饮食营养指导及常规营养治疗。研究组除上述常规治疗外,实施强化的个体化营养教育和肠内营养支持管理,研究组全部患者邀请我院营养科专科医生会诊,结合患者的个体情况,根据营养不良的三级诊断体系,再次综合评估得出营养诊断结果,制定出个体化的肠内营养干预方案,设定每日的蛋白质、能量目标,每日摄入达到蛋白质1.5-2.0 g/kg、能量30-35 kcal/kg,由营养科专科医生实施营养支持监督;对于病患经过自然饮食无法达到的蛋白质量和能量目标的那部分,根据病人吞咽的梗阻程度、饮食营养结构以及进食量的不同,采用肠内营养制剂:成人版安素(ABBOTT LABORATORIES B.V.生产,注册证号H2018 1147,规格400 g/罐,剂型:肠内营养粉剂),确保每日达到蛋白质量和能量目标。
研究组及对照组放疗结束后1周内均再次行 NRS2002量表评分,患者出院后门诊随访评估营养状态,有营养风险或营养不良患者再入院进一步治疗或至营养治疗专科门诊进行治疗。
1.3观察指标
体重丢失率(%)=(放化疗前的体重-放化疗结束时体重)/放化疗前体重×100%;体质指数(BMI)(kg/m2)=体重(kg)/身高2(m2);L3骨骼肌质量指数(L3 SMI):取至少2个连续的第三腰椎间盘(L3)平面的影像学图像,计算L3周围骨骼肌的横断面积之和(即腹内、腹外斜肌+腹横肌+腰大肌+腰方肌+竖脊肌),再得出平均值/身高的平方(cm2/m2),即L3 SMI(cm2/m2)=L3骨骼肌横断面积(cm)/身高2(m2),骨骼肌减少症的诊断标准:男性、女性L3 SMI分别≤52.4 cm2/m2、38.5 cm2/m2;检测Hb、PA、ALB、LYM等实验室指标,使用电化学法检测Hb,免疫透射比浊法检测PA,高效液相色谱法检测ALB;采用RTOG标准评价副反应,统计放射性皮肤损伤、放射性咽和食管粘膜损伤、骨髓抑制、放射性肺炎等并发症发生率以及治疗完成率,未完成放疗总剂量、未行第2周期同步化疗中任一项为治疗未完成。
1.4疗效评价标准
所有患者放化疗结束后1个月,都进行CT扫描以及食道钡餐检查,近期疗效使用实体肿瘤RECIST 1.1的疗效评价标准进行评价。近期治疗的有效率=(CR例数+PR例数+SD例数)/总例数×100%。
1.5统计学方法
采用SPSS 22.0统计学软件对数据进行分析,以率(%)表示计数资料,以均数±标准差(x±s)表示计量资料,组间比较行χ2检验和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗后各项指标比较
研究组放化疗后的体重丢失率明显低于对照组(P<0.05),体质指数(BMI)、L3骨骼肌质量指数(L3 SMI)均显著高于对照组(P<0.05),研究组Hb、PA、ALB、LYM的降低幅度明显低于对照组,且差异具有统计学意义(P<0.05)。见表2。
2.2两组放化疗不良反应发生率及治疗完成率比较
所有患者放射性皮肤损伤均表现为 2 级及以下,两组差异比较小无统计学意义(P>0.05);3 级及以上的放射性咽和食管粘膜损伤在两组患者中均未出现,然而对照组的1级和2级放射性咽和食管粘膜损伤发生率均明显高于研究组(P<0.05);两组1~2级骨髓功能抑制发生率无明显差异(P>0.05),但是对照组≥3级骨髓功能抑制发生率明显高出研究组(P<0.05);对照组放化疗后出现 1例放射性肺炎,但两组间差异无明显统计学意义(P>0.05);研究组放化疗完成率为93.75%,明显高于对照组的74.19%,差异有统计学意义(P<0.05),具体表现为未完成放疗总剂量、未行第2周期同步化疗均明显低于对照组(P<0.05)。见表3。
2.3两组近期疗效比较
研究组近期有效率为90.6%,明顯高于对照组的74.2%,差异有统计学意义(P<0.05)。见表4。
3 讨论
老年食管癌的病情特点较为特殊,既受到食管癌本身病情的影响,机体存在营养摄入和吸收不足、消耗增加的问题,容易发生营养不良,又受到老年人基础代谢异常率高、合并慢性疾病多的影响,导致营养不良的发生率明显升高,对疾病的治疗及预后极为不利[10]。大部分老年食管恶性肿瘤病人在明确诊断时已处于中晚期,已丧失手术治疗的机会,根治性放化疗综合治疗成为主要的治疗手段。但同步放化疗的实施也对机体正常组织功能造成一定的损伤,具有较高的消化道反应和体重下降风险,可引起放射性皮肤受损、放射性咽及食管粘膜炎、放射性肺炎及骨髓功能抑制等毒副反应,不仅明显降低了治疗耐受性,还会加重患者机体营养不良状态,甚至造成患者治疗中断、生活质量降低[11,12]。因此,加强老年食管癌患者的营养支持至关重要。
营养支持治疗在各类重症疾病及肿瘤中应用广泛,以肠内营养和肠外营养为主。肠内营养支持治疗为特殊医疗目的摄入自然饮食以外的营养补充剂,以达到增加能量和营养素摄入量的目的,经济、方便,患者易于接受。肠内营养的途径包括口服和管饲,靳智勇等研究[13]发现食管癌病人术后予肠内营养辅助疗法,能有效地改善其预后,对缩短术后愈合进程、增强机体免疫功能、改善机体营养状态等都有积极的影响。肠内的营养支持符合肠道消化的生理过程,能有效地保护肠黏膜,促进肠蠕动,提高营养物质的吸收和利用,有助于维持机体所需能量与营养,还可抑制炎症因子,减轻肠道应激反应,刺激胃肠激素的合成与释放,维持肠道内外分泌功能,从而改善机体营养状态,同时,肠内营养有利于内脏蛋白质合成与代谢[14-16]。本研究使用NRS2002营养风险筛查评分表评估患者营养风险,PG-SGA评分进行营养不良的评估,结合患者的能量消耗水平、代谢情况、应激程度、炎症反应及生理心理状况等方面对营养不良的类型及原因等进行综合测定,得出准确的患者营养状况结果,再制定个体化营养方案早期干预,达到个体化、针对性的营养治疗目的。ALB可反映肝脏合成与机体代谢,PA也是营养代谢的敏感性指标。因此,检测Hb、PA、ALB等血清指标可有效反映机体营养状态,而营养状态与机体免疫功能存在密切关联,LYM、CD3+、CD4+、CD8+、CD4+/CD8+可反应机体免疫功能状态,能反映营养状态对免疫功能的影响[17,18]。有研究显示CD4+减少,CD8+增加,CD4+/CD8+的比值下降,NK细胞的活性也下降,可能致使感染率升高,能量消耗也因此增加,反之,如果CD4+增加,CD8+降低,则CD4+/CD8+比值也相应升高,可增强免疫功能[19]。但本研究尚未对免疫细胞亚群进一步探讨,可期通过下一步的科学研究加以完善。
本研究结果显示,研究组放化疗后的体重丢失率明显低于对照组(P<0.05),体质指数(BMI)、L3骨骼肌质量指数(L3 SMI)均显著高于对照组(P<0.05)。研究组血红蛋白(Hb)、前白蛋白(PA)、白蛋白(ALB)、淋巴细胞计数(LYM)的降低幅度明显低于对照组(P<0.05)。所有入组患者放射性皮肤损伤均表现为 2 级及以下,两组差异比较小无统计学意义(P>0.05);3 级及以上的放射性咽和食管粘膜损伤在两组患者中均未出现,然而对照组的1级和2级放射性咽和食管粘膜损伤发生率均明显高于研究组(P<0.05);两组1~2级骨髓功能抑制发生率无明显差异(P>0.05),但是对照组≥3级骨髓功能抑制发生率明显高出研究组(P<0.05);对照组放化疗后出现 1例放射性肺炎,但两组间差异无统计学意义(P>0.05);研究组放化疗完成率为93.75%,明显高于对照组的74.19%,差异有统计学意义(P<0.05),具体表现为未完成放疗总剂量、未行第2周期同步化疗均明显低于对照组(P<0.05)。研究组近期有效率为90.6%,明显高于对照组的74.2%,差异有统计学意义(P<0.05)。说明个体化肠内营养支持能有效控制同步放化疗所致营养不良状态,维持机体营养需求平衡,提升营养状态,增强机体抗风险能力,降低同步放化疗的毒副反应,巩固治疗效果,提高生活质量。
综上所述,个体化肠内营养支持对老年食管癌同期放化疗患者营养状态及疗效有积极的影响,能有效改善机体营养状态,提升治疗完成率,降低放化疗并发症发生率,提高老年食管癌患者的治疗依从性及预后,值得在临床推广使用。
[参考文献]
[1] Miller KR,Bozeman MC. Nutrition therapy issues in esophageal cancer. Curr Gastroenterol Rep. 2012. 14(4):356-66.
[2] Sjoquist KM,Burmeister BH,Smithers BM,et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis. Lancet Oncol,2011,12(7):681-92.
[3] Ma L,Luo GY,Ren YF,et al. Concurrent chemoradiotherapy combined with enteral nutrition support: a radical treatment strategy for esophageal squamous cell carcinoma patients with malignant fistulae. Chin J Cancer,2017,36(1):8.
[4] Clavier JB,Antoni D,Atlani D,et al. Baseline nutritional status is prognostic factor after definitive radiochemotherapy for esophageal cancer. Dis Esophagus,2014,27(6):560-7.
[5] Odelli C,Burgess D,Bateman L,et al. Nutrition support improves patient outcomes,treatment tolerance and admission characteristics in oesophageal cancer. Clin Oncol (R Coll Radiol),2005,17(8):639-45.
[6] Langius JA,Kruizenga HM,Uitdehaag BM,et al. Resting energy expenditure in head and neck cancer patients before and during radiotherapy. Clin Nutr,2012,31(4):549-54.
[7] Ho VW,Leung K,Hsu A,et al. A low carbohydrate,high protein diet slows tumor growth and prevents cancer initiation. Cancer Res,2011,71(13):4484-93.
[8] 李濤,吕家华,郎锦义,等. 恶性肿瘤放射治疗患者肠内营养专家共识. 肿瘤代谢与营养电子杂志,2017,4(03):272-279.
[9] 吕家华,李涛,谢丛华,等. 食管癌放疗患者肠内营养专家共识. 肿瘤代谢与营养电子杂志,2015,2(04):29-32.
[10] 黄玉胜,吴亚从,宋一雪,等. 肠内营养支持对食管癌同步放化疗患者营养状况及免疫功能作用研究. 现代医药卫生,2018,34(14):2111-2115.
[11] Yamana I,Takeno S,Yamada T,et al. The Risk Factors for Refractory Fistula after Esophagectomy with Gastric Tube Reconstruction in Patients with Esophageal Cancer. Dig Surg,2017,34(1):18-24.
[12] 薛志芳,武雪亮,王丽,等. 全程精细化营养管理对老年食管癌同步放化疗患者营养状况、免疫功能及生活质量的影响. 中国老年学杂志,2019,39(06):1331-1334.
[13] 靳智勇,任海燕,梁俊国. 肠内营养辅助治疗对食管癌患者术后吻合口瘘的预防及对免疫能力、愈合进程及营养恢复的影响. 中国免疫学杂志,2017,33(07):1076-1081.
[14] 白献红,杜平,马艳会,等. CT引导下经皮胃造口术肠内营养支持对食管癌伴吞咽困难病人放疗期间营养状况的影响. 肠外与肠内营养,2017,24(04):240-243.
[15] Wan J,Che Y,Kang N,et al. Surgical Method,Postoperative Complications,and Gastrointestinal Motility of Thoraco-Laparoscopy 3-Field Esophagectomy in Treatment of Esophageal Cancer. Med Sci Monit,2016,22:2056-65.
[16] 杨栋,胡雯,杜继宇,等. 老年食管癌患者术后不同营养支持方式临床结局的比较. 中华老年多器官疾病杂志,2017,16(12):894-897.
[17] 刘春芳,王万霞,黄兰,等. 老年食管癌患者不同时间段营养状态及相关因素. 中国老年学杂志,2017,37(16):4000-4002.
[18] 吕家华,李涛,朱广迎,等. 肠内营养对食管癌同步放化疗患者营养状况、不良反应和近期疗效影响--前瞻性、多中心、随机对照临床研究(NCT02399306). 中华放射肿瘤学杂志,2018,27(01):44-48.
[19] Okamoto Y,Okano K,Izuishi K,et al. Attenuation of the systemic inflammatory response and infectious complications after gastrectomy with preoperative oral arginine and omega-3 fatty acids supplemented immunonutrition. World J Surg,2009,33(9):1815-21.
(收稿日期:2020-06-11)

