植被重建对黑土滩草地植被及微生物群落特征的影响
赵文,尹亚丽,李世雄, ,刘燕,刘晶晶,王玉琴
1. 青海大学畜牧兽医科学院/青海省畜牧兽医科学院,青海 西宁 810016;2. 青海省高寒草地适应性管理重点实验室,青海大学,青海 西宁 810016
草地是三江源自然保护区内面积最大、分布最广的生态系统,在涵养水源、土壤保持及碳循环等过程中发挥着重要作用(曹巍等,2019)。自 20世纪 90年代牧区草场实行以草场承包到户的“双权一制”管理体系以来,草场载畜量增加、啮齿类动物大量繁殖,导致草地出现不同程度退化,部分草地退化严重,形成黑土滩退化草地(马玉寿等,2002)。草地退化不仅制约当地畜牧业发展,同时引起三江源区域水土流失加剧(张婧,2019)、碳库释放速度加快(李国荣等,2017)等生态问题。不少研究表明,建植人工草地短时间内是缓解牧业压力、治理黑土滩最有效的方法,植被盖度两年内可高达80%以上(戎郁萍等,2002)。但人工草地不同于天然草地,其生态和生产功能难以长时间维持平衡,尤其当人工草地管理和利用不合理时,其会随着建植年限增加出现二次退化现象(张蕊等,2014)。
目前,国内多以空间代替时间序列研究不同建值年限的人工草地,主要从植被群落特征(群落的数量特征、生物量的变化)、土壤特征(土壤理化性质、呼吸速率、酶活性)、CO2通量变化特征等方面预测人工草地演替趋势(孙华方等,2019;王长庭等,2007;高小刚,2019;贺福全等,2019),但对于人工草地土壤微生物的研究较少。
土壤微生物在维持生态系统稳定和可持续性方面有重要的作用,参与大部分土壤反应过程(字洪标等,2017),从微生物的层面揭示草地退化及恢复过程中的问题,能清晰了解草地的动态变化。研究表明不同建植年限人工草地土壤微生物组成和群落结构不同,建植2年的人工草地微生物量比建植 4—6年的高(冯瑞章等,2007);伍文宪等(2019)通过对比川西北2种5年人工草地类型研究发现,天然草地与人工草地之间的土壤微生物差异系数大于两种人工草地之间的土壤微生物差异系数;也有研究指出不同建植年限人工草地土壤微生物功能多样性存在差异,随着建植年限的增加,土壤养分状况、微生物群落趋向于稳定(姚宝辉等,2019)。但这些研究对人工草地何时出现二次退化及植被-土壤微生物在二次退化中如何变化,尚未作出系统评价。而以Biolog微孔板碳源利用为基础的分析是微生物群落代谢功能多样性的一种简单、快速的方法,对不同环境中微生物群落功能多样性信息具有重要意义(刁婵等,2019)。尤其是在研究植被恢复过程中,通过土壤微生物碳源利用的差异选择合适的植被类型进行生态修复和重建及重建过程中退化问题具有指导意义(安韶山等,2011)。鉴于此,本研究结合植被和土壤微生物群落特征,通过对比 2015、2012、2009、2006年建植的人工草地植被群落结构及生物量变化趋势,分析不同建植年限草地土壤微生物碳、氮、磷递变规律,检测土壤微生物群落碳源代谢能力,以期为三江源区黑土滩草地恢复重建及人工草地的持续利用提供理论支撑。
1 试验地区与方法
1.1 试验区概况
研究地位于青藏高原腹地的青海省果洛藏族自治州玛沁县大武镇(34°27′56.9″N,100°13′56.9″E,海拔3740 m左右)。该地区为高原大陆性气候,高寒缺氧,日照时间短,太阳辐射强且昼夜温差大。1967—2017年平均气温在-3.4—3.0 ℃之间,最高气温为 26.6 ℃,最低气温为-34.9 ℃,最大温差为22.4 ℃,最冷月和最热月平均温度分别为-12.6 ℃和9.7 ℃,全年无绝对无霜期(洪卓华等,2018)。降水集中在5—9月,年降水量为513—542 mm,年蒸发量为1160 mm。牧草生长季为156 d,高寒草甸是该地区主要的草地类型,优势种为高山嵩草(Kobresia pygmeae),主要的伴生禾草为垂穗披碱草(Elymus nutans)、芒恰草(Koeleria litvinowii),其他阔叶类杂草有美丽风毛菊(Saussurea superba)、甘肃马先蒿(Pedicularis kansuensis)、高山唐松草(Thalictrum aquilegifolium)、米口袋(Gueldenstaedtia verna)和肉果草(Lancea tibetica)等。由于受到过度放牧及不合理的管理利用等因素影响,高寒草甸退化后形成以黄帚槖吾(Ligularia virgaurea)、冷蒿(Artemisia frigida)等为优势种的“黑土滩”退化草地。
1.2 样地简介及试验方法
在青海省果洛州大武镇人工草地选择4块面积约为50 hm2的草地为实验样地,分别是2015、2012、2009、2006年建植的青海草地早熟禾(Poa pratensis L.)单播人工草地。人工草地均为黑土滩退化草地经过深翻、耙平、施肥(一次性施N肥61.5 kg·hm-2、P 肥 68.9 kg·hm-2)、撒种(播量 15 kg·hm-2)、覆土、镇压等农艺措施建植。人工草地建植前为黑土滩退化草地,其土壤理化性质如下:全氮2.36—4.02 g·kg-1、全磷 0.50—0.67 g·kg-1、全钾 22.11—22.83 g·kg-1、有机质碳 32.31—47.12 g·kg-1、含水量 7.45%—8.29%。返青期(4—6月)完全禁牧,冬季放牧利用(每年12至次年4月)。以未退化的高山嵩草型高寒草甸、冷蒿为优势种的黑土滩退化草地作为对照,各处理设4个试验小区为重复,共24个小区,每个小区面积约100 m2。
1.3 样品采集及测定方法
于2017年8月中旬在每小区随机选取4个面积为50 cm×50 cm的样方,对植被群落特征进行调查,并测定样方内植物地上生物量,同时用直径7 cm的根钻采集样方内0—10、10—20 cm植物根系,每样方取3钻混合为1个根样,河水冲洗泥土,手工去除石块等,根样带回实验室,在烘箱内以80 ℃烘干至恒重,并计算地下生物量。用直径3.5 cm的土钻,每小区随机取5—8点,采集0—10、10—20 cm土样,每个小区根据土层混合为1个土样,手工去除较大的杂质,并过2 mm的筛,封装在自封袋,夹棉塞,冰盒取回4 ℃保存,一周内进行分析测试,室内分析是在2017年9—11月完成。
土壤微生物群落多样性及碳源利用能力采用Biolog-Eco法测定;土壤微生物生物量碳、氮采用氯仿熏蒸-硫酸钾浸提,重铬酸钾滴定法和化学分析仪测定(党雯等,2015);土壤微生物生物量磷采用氯仿熏蒸-碳酸氢钠浸提,分光光度计测定(吴金水等,2003)。
1.4 微生物群落多样性分析方法
(1)AWCD是平均每孔颜色变化率(average well change devolopment),表征土壤微生物活性和多样性大小的一个重要指标,其大小可以反映微生物对单一碳源的利用能力,其计算公式:

式中,C为31孔反映孔在590 nm下的吸光值;R为对照孔吸光值;n为碳源种类数31;C-R的值均大于或等于0,C-R小于0的计算中将其记为0。
(2)Shannon多样性指数(H指数),用来估算群落多样性的高低:

式中,Pi为每个孔吸光度/所有吸光度之和。
(3)Simpson优势度指数(D指数),反映了群落中最常见的物种,评估微生物群落优势度:

式中Pi为每个孔吸光度/所有吸光度之和(尹亚丽等,2018)。
1.5 数据处理
运用Excel 2013进行数据整理,SPSS 20.0进行数据分析,R3.4.3 ggplot 2进行碳源利用结构富集分析及Anosim(Analysis of similarity)非参数检验法检验组间差异。表中的数据为平均值±标准差。
2 结果分析
2.1 不同处理草地植被特征
在不同草地共鉴定、分类植物 46种,黑土滩优势种以冷蒿、黄帚橐吾和臭蒿等杂草为主,人工草地优势种为青海草地早熟禾,未退化高寒草甸优势种以嵩草属的植物为主。其中 2012年人工草地植被覆盖度和物种丰富度显著高于黑土滩退化草地(P<0.05),而与未退化高寒草甸差异不显著,随着建植年限的增加,植被盖度和物种丰度呈现倒“V”型的变化趋势,优势种青海草地早熟禾比出现下降的趋势(表1)。
2.2 不同处理草地地上、地下生物量变化特征
0—10 cm土层中地下生物量高于10—20 cm土层,高幅达0.77—3.30 g·m-3,即地下生物量的85%以上分布在0—10 cm的土层中。人工草地随建植年限增加,地上生物量先降低后持平的趋势(图1),其中2015年地上生物量显著高于未退化高寒草甸、黑土滩退化草地、2012年人工草地(P<0.05),其他处理间差异不显著。地下生物量表现为未退化>黑土滩>人工草地,且不同建植年限的人工草地间差异不显著。
2.3 不同处理草地土壤微生物量特征
对各草地不同土层土壤微生物量碳、氮、磷进行分析,0—10 cm土层的微生物量碳、氮、磷均高于10—20 cm土层(表2)。即在0—20 cm的土层中,54%以上的土壤微生物分布在0—10土层中,且未退化土壤微生物量碳、氮最高,均显著高于其他草地(P<0.05)。

图1 不同处理之间植被地上(Ba)、地下生物量(Bu)变化Fig. 1 Changes of biomass above (Ba) and underground (Bu) vegetation among different treatments
不同建植年限的人工草地土壤微生物量碳,在0—10 cm土层中,2015年和2006年显著低于2012年和2009年人工草地(P<0.05),且与黑土滩差异不显著;在 10—20 cm土层中,2012年显著高于2015、2009、2006年人工草地(P<0.05),与未退化差异不显著。随建植年限的增加,土壤微生物量碳呈现先增加后持平的趋势。土壤微生物量氮不同土层的变化趋势一致,均表现为 2009年微生物量达到最大值,显著高于 2015和 2006年人工草地(P<0.05)。0—10 cm土层中,2009年人工草地微生物量氮与黑土滩差异不显著,且显著低于未退化高寒草甸(P<0.05),而在10—20 cm的土层中表现相反。不同土层的微生物量磷变化趋势不一致。0—10 cm中,2012年土壤微生物量磷最高,显著高于 2015、2009、2006年人工草地和黑土滩退化草地(P<0.05),微生物量磷随建植年限呈现“N”型变化趋势;10—20 cm土层中,2012年土壤微生物量磷最大,显著高于 2015、2009、2006年人工草地、未退化草甸和黑土滩(P<0.05),其他草地差异不显著,微生物量磷随建植年限的增加出现先增加后持平的趋势。
2.4 土壤微生物群落多样性
Biolog-Eco法可以表征土壤微生物群落代谢活性,土壤微生物生长差异主要是碳源的利用不同造成的,在培养过程中利用土壤微生物对基质采取选择性利用,从而表现为反应孔出现颜色差异。培养2—5 d,AWCD增长迅速,5 d后增长速率变缓,培养7 d趋于平缓(图2)。各草地0—10 cm土层中AWCD显著高于10—20 cm土层(P<0.05)。培养第7天,0—10 cm土层中,2006年人工草地AWCD最大,与未退化草甸差异不显著,而 2015年人工草地显著小于 2012、2009、2006年建植的人工草地。在10—20 cm土层,AWCD值在2015年人工草地最低,显著低于黑土滩(P<0.05),其他草地未表现显著差异,人工草地随着建植年限的增加AWCD呈现增长的趋势。
土壤微生物H及D指数是表征土壤微生物多样性的指数。培养0—1 d,H指数和D指数增长迅速,2 d后增长速率变缓,培养6 d时H和D趋于平缓。各草地0—10 cm土层中H和D指数显著高于10—20 cm(P<0.05)。培养第7天,0—10 cm土层中2006年人工草地最高,显著高于2015年人工草地(P<0.05),其他处理间差异不显著。10—20 cm土层中H和D指数均以2015年人工草地最低。人工草地随建植年限的增加,H和D指数均呈现增长的趋势。
2.5 不同处理草地土壤微生物对 6类碳源利用能力分析
Biolog-Eco由六大类碳源化学基团:糖类、氨基酸类、脂类、醇类、胺类和羧酸类组成。培养7 d,各草地0—10 cm土壤微生物对6大类碳源利用能力表现差异(图3),羧酸类在2006年人工草地最高,显著高于 2015、2009年人工草地和黑土滩(P<0.05);糖类、氨基酸、醇类及胺类相对利用率在各草地间差异不显著;人工草地随着建植年限的增加,对六类碳源的利用除醇类呈现无规律变化外,其余均呈“N”型变化趋势。在10—20 cm的土层中,不同草地土壤微生物对糖类、脂类、醇类和胺类利用率差异均不显著;对羧酸类的利用率在2006年人工草地最高,2015年人工草地最低,显著低于其他草地(P<0.05);2015年人工草地对氨基酸的利用率最高,与黑土滩草地相比差异显著(P<0.05);人工草地随建植年限增加除氨基酸类和胺类“N”型变化,其他草地都呈现无规律的变化。
2.6 不同处理草地土壤微生物对31种碳源利用
用R 3.4.3对Biolog-Eco土壤微生物碳源利用功能进行分析,结果所示(图4):在0—10 cm和10—20 cm 土层中,A4、B3、B4、C1、D1、D2、D3、D4等碳源利用微生物在各草地均显著富集;其他碳源 A2、A3、E3、B1、C2、C3、C4、E3、F4、F1碳源利用微生物在各草地间出现分异。非参数Anosim检验不同建植年限草地土壤微生物群落功能,结果显示,在0—10 cm土层中不同草地对31种碳源利用存在小差异(R=0.2701,P=0.002)。单因素方差分析显示差异主要来源同一碳源被各草地土壤微生物群落利用不同,造成差异的碳源有:单糖类(1种:H1),氨基酸(5种:A4、B4、D4、F4、E4),脂类(3种:B1、C1、A3),醇类(1种:D2),胺类(2种:G4、H4)、羧酸类(5种:B3、F2、D3、F3、G3)。在10—20 cm土层中不同草地对 31中碳源利用存在小差异(R=0.197,P=0.007),造成差异的碳源有:单糖类(3种B1、H1、F1),氨基酸(4种:A4、B4、D4、E4),脂类(3种:B1、C1、A3),醇类(1种:C2),胺类(1种:G4),羧酸类(5种:F2、E3、F3、G3、H3)。
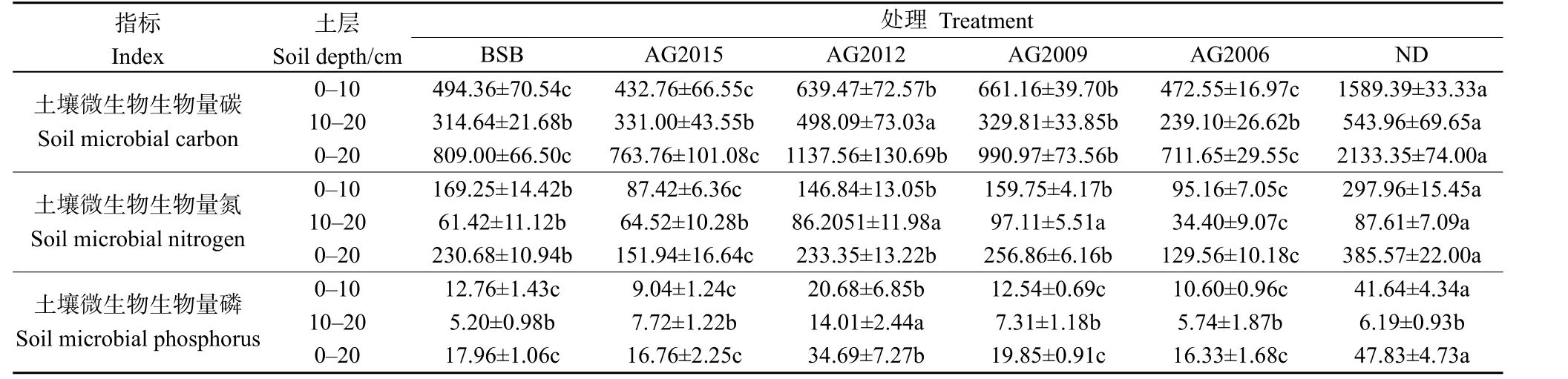
表2 不同处理草地土壤微生物生物量碳、氮、磷垂直分布特征Table 2 Characteristics of vertical distribution of carbon, nitrogen and phosphorus in soil microbial biomass in different treatments

图2 不同处理草地土壤微生物平均颜色变化率(AWCD)、Shannon指数(H)及Simpson指数(D)Fig. 2 Average color change rate (AWCD), Shannon (H) and Simpson index (D) of soil microorganisms under different treatments

图3 不同处理草地土壤微生物对6类碳源利用率Fig. 3 Utilization rate of 6 types of carbon sources by soil microorganisms in different treatments of grassland
2.7 人工草地土壤微生物群落多样性与微生物生物量、植被生物量相关性分析
土壤微生物平均颜色变化率(AWCD)与微生物生物量碳、氮呈显著正相关,与地上生物量呈显著负相关(P<0.05);多样性指数H和优势度指数D与地下生物量,微生物生物量碳、氮、磷均呈正相关关系,而与地上生物量呈负相关(表3)。
3 讨论

图4 六类碳源Pathway富集分析气泡图Fig. 4 Pathway enrichment analysis bubble chart of six types of carbon source

表3 土壤微生物AWCD、H指数、D指数和地上、地下生物量,微生物生物量碳、氮、磷相关性系数Table 3 Correlation coefficients of soil microorganism AWCD, H index and D index with aboveground biomass, underground biomass, microbial biomass carbon, nitrogen and phosphorus
草地植被是衡量生态系统生长状况和生产力的重要指标(刘思洋等,2019)。研究表明,植物受到“功能平衡”的影响,地上生物量和地下生物量呈显著正相关,即无胁迫条件下禾草类地上生物量与地下生物量等速生长(满欣雨等,2018)。本研究结果发现人工草地植被群落物种丰度和盖度在建植5年后达到最大值,随着建植年限增加地上生物量先降低后持平,地下生物出现相反的变化趋势,其中 2012年人工草地物种丰富度及盖度达到最大,地下生物量最高而地上生物量最低。张蕊等(2018)研究三江源未退化天然草地、退化草地及人工草地后发现,禾草类为主的人工草地低温限制了根的生长和分解,导致根量累计较少,并且会随着建植年限的增加出现降低的趋势。本研究中地上和地下生物量出现相反的变化趋势可能是人工草地二次退化的表现。尚占环等(2018)通过分析土壤养分,认为不同建植年限黑土滩人工草地短期内高产是以消耗地力为代价,随建植年限延长、管理水平降低会使建植的草地出现二次退化;董全民等(2007)分析植被群落结构认为建植3—5 a的人工草地会出现稳态现象,在此之后人工草地出现二次退化;贺福全等(2019)研究CO2通量变化特征发现,人工草地在建植第 3年碳汇能力达到最大,5—6 a需要重新翻耕人工草地。另一方面在杂类草扩繁下人工草地群落结构发生改变,使种植的禾草逐渐失去竞争优势,植物群落结构由生产稳定性向生态稳定性转化。其次人工草地根系短时间内周转变快,景馨(2018)认为5年内翻耕、覆盖加施肥组合恢复的农艺措施显著提高了根生产力、死亡量和现存量,增加了根系寿命,而大于5年以上的人工草地,可能在农艺影响及管理水平下降的情况下,种植的禾草根系的周转速率下降导致地下生物量降低。
土壤微生物生物量被称为活的有机质,且对环境变化敏感,是草地生态系统敏感指标,其大小是判定土壤肥力高低及其变化的重要依据,可作为非稳定性有机碳的指示器反应有效养分的状况和生物活性的变化(Rui et al.,2011)。本研究结果表明:0—10 cm 微生物量碳、氮、磷土层显著高于10—20 cm,这可能与地上腐殖质层有关,研究表明除沙地草原10—20 cm大于表层0—10 cm外,其他类型的草地土壤微生物生物量均随土层加深而减少,而且植被和土壤是导致土壤微生物生物量在不同土层出现差异主要原因(张成霞等,2010)。另外,人工草地微生物生物量随建植年限增加呈先增加后降低的趋势,2012年人工草地微生物生物量碳、磷最高,2009年人工草地年微生物生物量氮最高,而 2006年人工草地微生物生物量碳、氮、磷均最低。认为 2012年人工草地处于从生产型到生态型的过度状态,杂草与种植的禾草处于暂时的平衡,此时地下生物量达到最高值,为土壤微生物提供了较多的营养物质,因此微生物生物量碳、磷在2012年人工草地间出现最高值。杨刚等(2008)也认为不同植物根系的相互作用使根系在土壤中镶嵌分布广,根系密度增加,改善了土壤水分和养分的供应状况,从而促进土壤微生物的大量活动,加快了土壤碳、氮等元素的循环过程。但是,随着建植年限的增加土壤微生物生物量下降,2006年人工草地最低,分析其原因;一方面人工草地的退化在改变草地生物量碳密度分配格局,同时也限制草地土壤微生物量及其活动(张蕊等,2018)。另一方面,土壤微生物与地上植被类型、土壤理化性质、地形地貌、水热条件和气候因子紧密联系,在土壤或植被因子持续发生变化时,土壤微生物群落结构变化(蒋永梅等,2017),导致微生物量的持续降低,尤其是退化的人工草地地上植被物种的增加,使微生物可分解利用物质发生改变,加之鼠兔等增多使排泄物增加,土壤微环境发生变化,由此导致土壤微生物区系发生相应变化,趋向于形成新的微生物群落结构的稳定(尹亚丽等,2019)。
平均颜色变化率(AWCD)是表征土壤微生物的代谢活性,微生物群落对单一碳源利用的重要指标,该值越高表明微生物代谢活性越强(张瑞等,2013)。本研究结果表明,同一建植年限的人工草地0—10 cm土层的土壤微生物活性显著高于10—20 cm土层的,群落结构和多样性更加丰富,主要是0—10 cm土层中较10—20 cm土层有较多的根系存在,为微生物的生存提供了营养和空间条件,这与刘燕等(2019)的研究结果一致。Shi et al.(2018)也认为植物根系通过改变生活在植物根系附近的微生物,从而对根凋落物分解过程中涉及的多种土壤环境和微生物机制产生影响。在0—10 cm和10—20 cm土层中,2015年人工草地土壤微生物平均颜色变化率(AWCD)、H指数、D指数均最低,因为 2015年人工草地建植年限最短,受人工草地耕作方式的影响较大,姬艳艳等(2013)研究发现翻耕处理下土壤微生物群落的AWCD、多样性指数、丰富度指数和优势度指数都显著低于其他处理的农地,这种传统耕作方式对土壤扰动大,使土壤团粒结构和微生物区系发生改变。人工草地是在黑土滩型退化草地上翻耕建植,翻耕前黑土滩植被是以毒杂草为主的群落,可提供的有机质较少。有研究发现土壤中微生物的种类数量及其分布规律与植被密切相关(Buenemann et al.,2004)。而本研究不同建植年限人工草地AWCD、H指数、D指数均与地下生物量、微生物生物量碳、氮、磷相关,与地上生物量呈负相关。分析其原因,人工草地地上生物量越大,物种越是单一,因此凋落物就单一,土壤微生物的营养物质单一导致代谢活性和多样性降低,这可能是人工草地退化的表现。
土壤碳源是影响土壤微生物群落动态的重要因素(赵轻舟等,2018),可根据土壤微生物对不同类型碳源的相对利用程度,反映微生物的代谢功能类群(张红等,2014)。本研究中土壤微生物对不同类型的碳源相对利用率有差异,表明不同建植年限人工草地土壤微生物的主要功能代谢类群不同,且在0—10 cm和10—20 cm土层中,土壤微生物对碳源利用率变化趋势不同,这与尹亚丽等(2018)的结果一致。可能是不同建植年限人工草地地上植被群落处于不断的变化,微生物可选择的有机质不同,导致微生物碳源利用偏好发生改变,但由于Biolog平板中所提供的碳源种类有限,所以植被如何影响并改变微生物碳源利用偏好有待进一步的研究。王蕊等(2019)用Biolog方法研究3种不同利用方式的土地,发现草地、耕地及林地对碳源利用偏好不同,草地对糖类、胺类和氨基酸类碳源的相对利用率均最高,对羧酸类和聚合物类碳源的相对利用率最低,这与本实验中对照组未退化高寒草甸结果一致。而黑土滩和人工草地对氨基酸类、脂类、胺类利用最高,除此之外,黑土滩对脂类也表现较高的利用率,进一步碳源富集分析显示,2015年人工草地与黑土滩退化草地对31种碳源利用差异显著,而 2012年和黑土滩利用差异不显著。究其原因,认为一方面与地上植被物种组成有关,2015年草地植被物种丰富度低且禾本科植物占比高,而黑土滩草地以冷蒿、黄帚橐吾和臭蒿等物种为主,有研究显示这些植物含有有毒化感物质(平晓燕等,2018;任元丁等,2014),是否是这些有毒化感物质增加了黑土滩草地土壤微生物对脂类的利用还有待进一步研究。另一方面可能与植物的根系有关,根系分泌物能为土壤提供较为稳定的碳源,2015年建植的人工草地地上植被生长旺盛,但土壤中根系分泌物和脱落物的种类和数量不稳定,从而改变植株周围的土壤微环境,并对土壤微生物产生不同的生态效应,导致不同的碳源利用偏好(谭红妍等,2014),贾甜华(2019)以三江源未退化高寒草甸、披碱草人工草地、次生毒杂草草地为研究对象,发现次生毒杂草草地土壤微生物偏好利用脂类,认为毒杂草根系分泌物对土壤微生物影响更大,是导致碳源利用差异的主要原因。在植被生态修复过程中,植被的根系活力及其分泌物可能是影响植被的根本原因,后续的实验将会深入研究植物根系及分泌物。
4 结论
对黑土滩退化草地进行人工恢复重建后,建植第2年植被地上物量较高,建植第5年地上生物量显著降低,5—11 a趋于平稳;人工建植第5年草地地下生物量最高,5 a后显著降低,即建植5 a后人工草地植被趋于二次退化。土壤微生物生物量碳、氮、磷均随草地建植年限的增加呈倒“V”型变化,即建植第5年人工草地土壤微生物处于旺盛生长期,建植5 a后草地微生物趋于衰退;土壤微生物群落多样性随建植年限的延长而增加,建植第2年人工草地与黑土滩草地土壤微生物对31种碳源利用差异显著,建植第5年人工草地与黑土滩草地碳源利用差异不显著,即建植5 a后人工草地土壤微生物功能结构向黑土滩发展。人工草地向黑土滩草地二次退化过程中,与草地植被相比,土壤微生物能更早地作出指示。

