血清淀粉样蛋白A、C反应蛋白荧光免疫层析联合检测方法的建立①
贺 沁 周春峰 王云龙 明 亮 李玉林 曹继宗
(郑州大学第一附属医院检验科,郑州 450052)
感染性疾病是威胁人类健康的重要病因之一,临床常以C反应蛋白(C-reaction protein,CRP)和血清淀粉样蛋白A(serum amyloid A,SAA)作为早期诊断感染性疾病的检测指标。CRP和SAA是反映早期炎症的敏感指标,当机体发生细菌感染时,二者含量显著升高;而在病毒感染早期,SAA显著升高,CRP不升高或仅小幅升高[1,2]。因此,SAA与CRP联合检测有利于早期鉴别细菌或病毒感染,为临床用药提供参考[3,4]。目前,临床上针对SAA、CRP检测主要是化学发光和免疫比浊法,这些方法主要适用于拥有相对完善检验设备的大中型医院,不适用基层或社区医疗机构床旁快速检测,限制了其临床应用。
本研究旨在利用荧光免疫层析技术建立一种可同时联合定量检测血清中CRP、SAA的检测方法,既满足社区基层医院常规检测的需求,又可提高鉴别细菌、病毒感染的准确度,节省检测时间,指导患者合理用药,为感染性疾病的早期筛查提供了一种便捷、准确的检测方法。
1 材料与方法
1.1材料 Eu3+羧基荧光微球购自上海微测生物科技有限公司;鼠抗兔IgG单克隆抗体、CRP配对单克隆抗体、SAA配对单克隆抗体、硝酸纤维素膜、PVC板、玻璃纤维素膜、吸水纸、CRP、SAA线性质控品,精密性质控品均由河南省生物工程技术研究中心提供。N,N′-二环己基碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)购自南京化学试剂股份有限公司。三维点膜喷金仪、自动斩切机购自上海金标生物;荧光定量分析仪购自杭州峰航科技有限公司;NanoDrop微量紫外分析仪购自Thermo。
1.2方法
1.2.1试纸条的制备 参照文献[5,6],采用EDC-NHS两步法活化荧光微球,取5 μl荧光微球加入500 μl 0.05 mol/L 硼酸缓冲液(pH8.0)漩涡振荡混匀后,加入50 μl EDC溶液(1 mg/ml)和 50 μl NHS溶液(1 mg/ml) 作为活化剂混匀后,振荡活化30 min;15 000 r/min离心20 min,弃上清;加入800 μl 0.05 mol/L硼酸缓冲液(pH8.0)复溶沉淀后,再加入20 μg 抗SAAⅠ抗体,室温下振荡偶联2 h;15 000 r/min 离心20 min,弃上清;加入1 ml微球保护液复溶沉淀后,加入10 μl 1%BSA溶液振荡封闭1 h,置于4℃保存备用。荧光微球标记抗CRP Ⅰ抗体:加入20 μg 抗CRP Ⅰ抗体,其余步骤同荧光微球标记抗SAA Ⅰ抗体。荧光微球标记兔IgG多克隆抗体:加入10 μg 兔IgG多克隆抗体,其余步骤同荧光微球标记SAA Ⅰ 抗体。将3种免疫微球按照体积比1∶1∶1混匀后,按照5 μl/cm喷涂到微球结合垫上制备成微球垫,37℃干燥2 h。采用三维平面点膜喷金仪,按1 μl/cm将2 mg/ml 鼠抗兔IgG单克隆抗体、 1.5 mg/ml 抗SAA Ⅱ单克隆包被抗体、1.5 mg/ml 抗 CRPⅡ单克隆包被抗体包被于NC膜上分别作为T1线、T2和C线,37℃干燥2 h。按试纸条组装方式,组装好后用切条机切成3.9 mm宽的试纸条如图1,装于带有干燥剂的铝箔袋中密封,置于2~8℃保存备用。
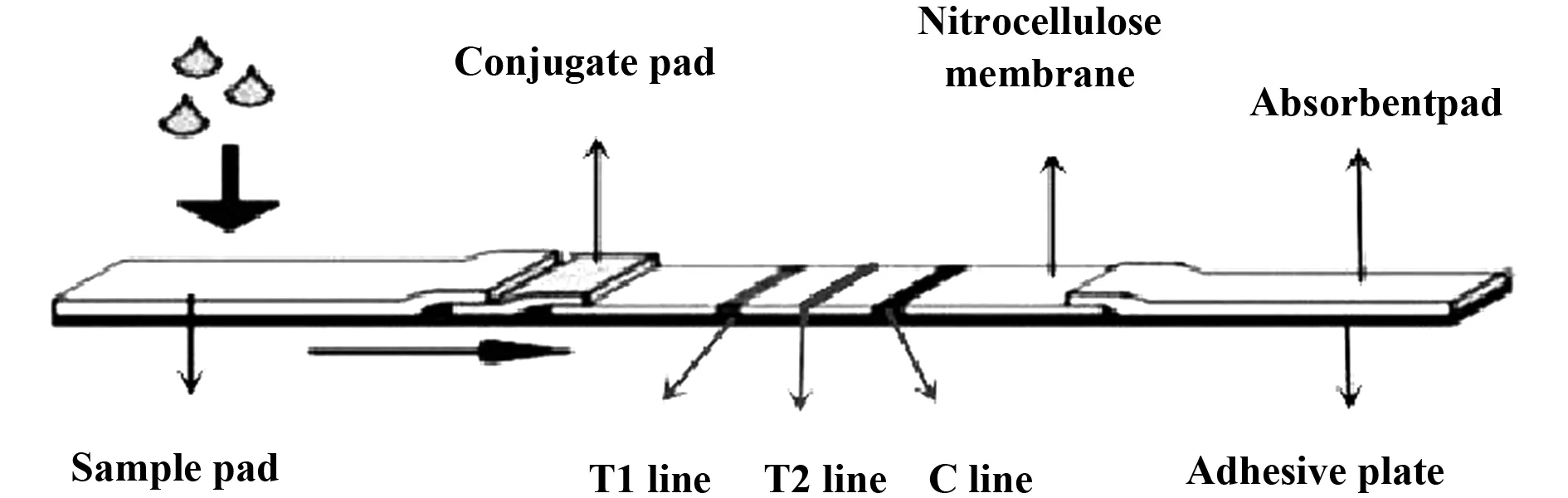
图1 SAA、CRP二联荧光免疫层析试纸条结构示意图Fig.1 Schematic diagram of combined detection of SAA and CRP fluorescence immunochromatographic test strips
1.2.2试纸条的检测 采用样品稀释液(pH7.8 0.02 mol/L Tris-HCl、0.9%NaCl、0.1%BSA、0.5%T-20,0.1%NaN3)将血清稀释100倍后,取70 μl样品加样,5 min后于荧光定量分析仪中检测,分析软件自动计算出待测样本中的SAA、CRP浓度。
1.2.3最佳标记蛋白量与包被蛋白量的确定 采用二因素多水平实验确定最佳SAA、CRP标记包被抗体的量,设计5 μl荧光微球,兔 IgG标记量为10 μg,鼠抗兔IgG单克隆抗体包被量为2.0 mg/ml,SAA、CRP标记抗体梯度为10、20、40 μg,包被抗体浓度梯度为1.0、1.5、2.0 mg/ml。按照1.2.2的方法制备试纸条,用线性参考品检测试纸条的线性范围与R2。
1.2.4分析性能评价
1.2.4.1标准曲线的建立 取SAA、CRP线性标准品浓度依次为0.78、1.56、3.125、6.25、12.5、25、50、100、150、200 μg/ml,分别吸取70 μl CRP,SAA线性标准品滴至加样孔中,5 min后置于荧光定量分析仪检测,重复检测3次,并以T/C均值的对数为纵坐标,以相应浓度的对数值为横坐标绘制标准曲线。
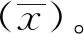
1.2.4.3准确度 向阴性样本中加入已知浓度的CRP和SAA室内质控品(浓度均为150、50、10 μg/ml),采用本方法制备的SAA、CRP联合检测免疫层析试纸条检测,分别计算其回收率(回收率=测定浓度/预测浓度×100%)。
1.2.4.4交叉反应 取浓度分别为50、100 μg/ml仅含SAA抗原的样品各70 μl加入样品孔中,5 min后检测T1、T2、C线荧光强度;同样将仅含有CRP抗原,浓度分别为50、100 μg/ml的溶液滴加到该检测卡的加样孔中,5 min后检测。
1.3方法学比对 采用本方法制备的SAA、CRP联合检测免疫层析试纸条与西门子BN ProSpec®特定蛋白分析系统(散射比浊法)同时检测80份临床血清标本,并对SAA、CRP定量检测结果进行比对分析。
2 结果
2.1最佳标记蛋白量与包被蛋白量的确定 结果如表1所示,采用5 μl荧光微球标记时,抗SAA Ⅰ标记量为20 μg,抗SAA Ⅱ包被浓度为2 mg/ml时,试纸条的线性范围最宽,R2最大,分别为0.78~200 μg/ml,R2=0.985。抗CRPⅠ标记量为20 μg,抗CRP Ⅱ 包被浓度为1.5 mg/ml时,试纸条的线性范围最宽,R2最大,分别为0.78~200 μg/ml,R2=0.996。
2.2分析性能评价
2.2.1标准曲线的建立 SAA线性质控品检测结果如图2,测得SAA在0.78~200 μg/ml范围内线性较好,y=0.644 5x+1.641 5,R2=0.995 8;CRP线性质控品检测结果如图3,测得CRP在0.78~200 μg/ml范围内线性较好,y=0.725 9x+1.259 4,R2=0.996 4。SAA、CRP最低检测限分别为0.35 μg/ml、0.42 μg/ml。
2.2.2精密性 随机抽取3个不同批次的 SAA、CRP联合检测免疫层析试纸条,分别对浓度为 5、10、50 μg/ml的样本进行精密性检测。SAA批内精密性依次为9.59%、7.13%、4.49%,批间精密性依次为9.44%、6.92%、5.76%;CRP批内精密性依次为9.59%、7.13%、4.49%,批间精密性依次为9.44%、6.92%、5.76%。本方法制备的试纸条其批间和批内变异系数均小于15%,符合精密性要求。
表1 最佳标记蛋白量与包被蛋白量结果
Tab.1 Best amount of labeling and coating
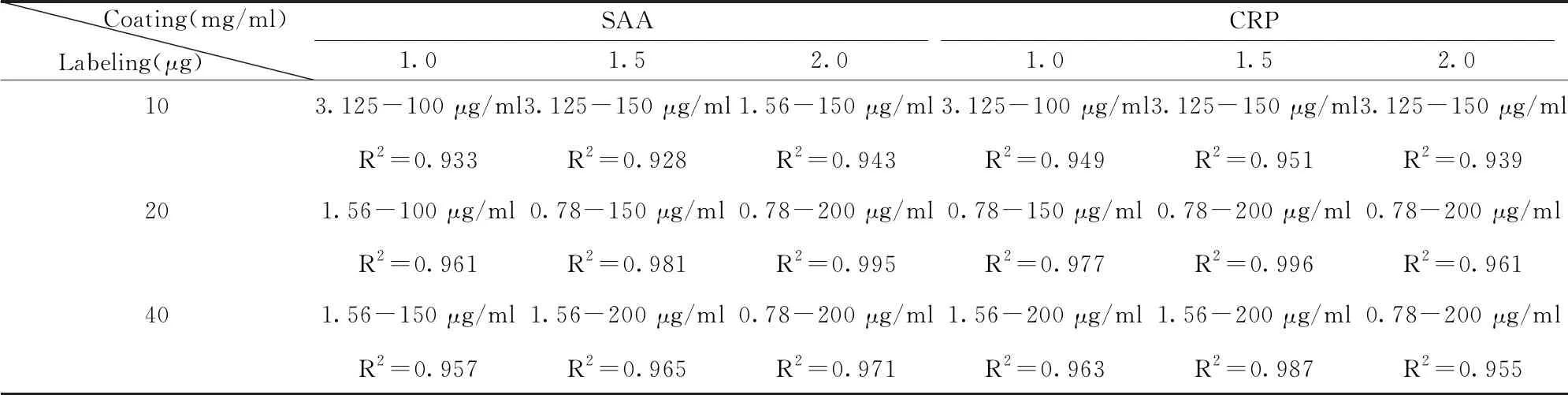
Coating(mg/ml)Labeling(μg) SAA1.01.52.0CRP1.01.52.0103.125-100 μg/ml3.125-150 μg/ml1.56-150 μg/ml3.125-100 μg/ml3.125-150 μg/ml3.125-150 μg/mlR2=0.933R2=0.928R2=0.943R2=0.949R2=0.951R2=0.939201.56-100 μg/ml0.78-150 μg/ml0.78-200 μg/ml0.78-150 μg/ml0.78-200 μg/ml0.78-200 μg/mlR2=0.961R2=0.981R2=0.995R2=0.977R2=0.996R2=0.961401.56-150 μg/ml1.56-200 μg/ml0.78-200 μg/ml1.56-200 μg/ml1.56-200 μg/ml0.78-200 μg/mlR2=0.957R2=0.965R2=0.971R2=0.963R2=0.987R2=0.955
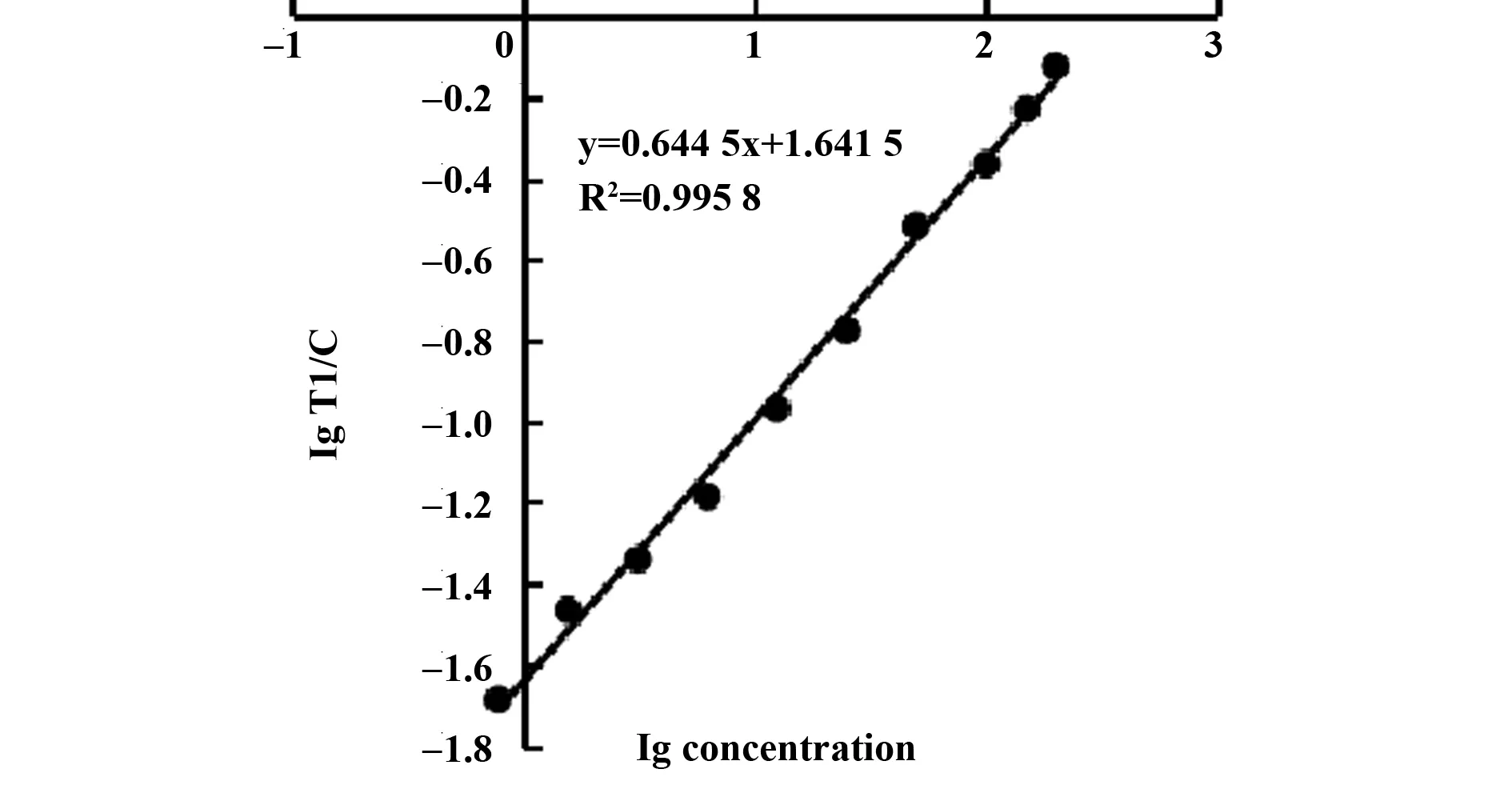
图2 SAA标准曲线Fig.2 Sandard curve of SAA
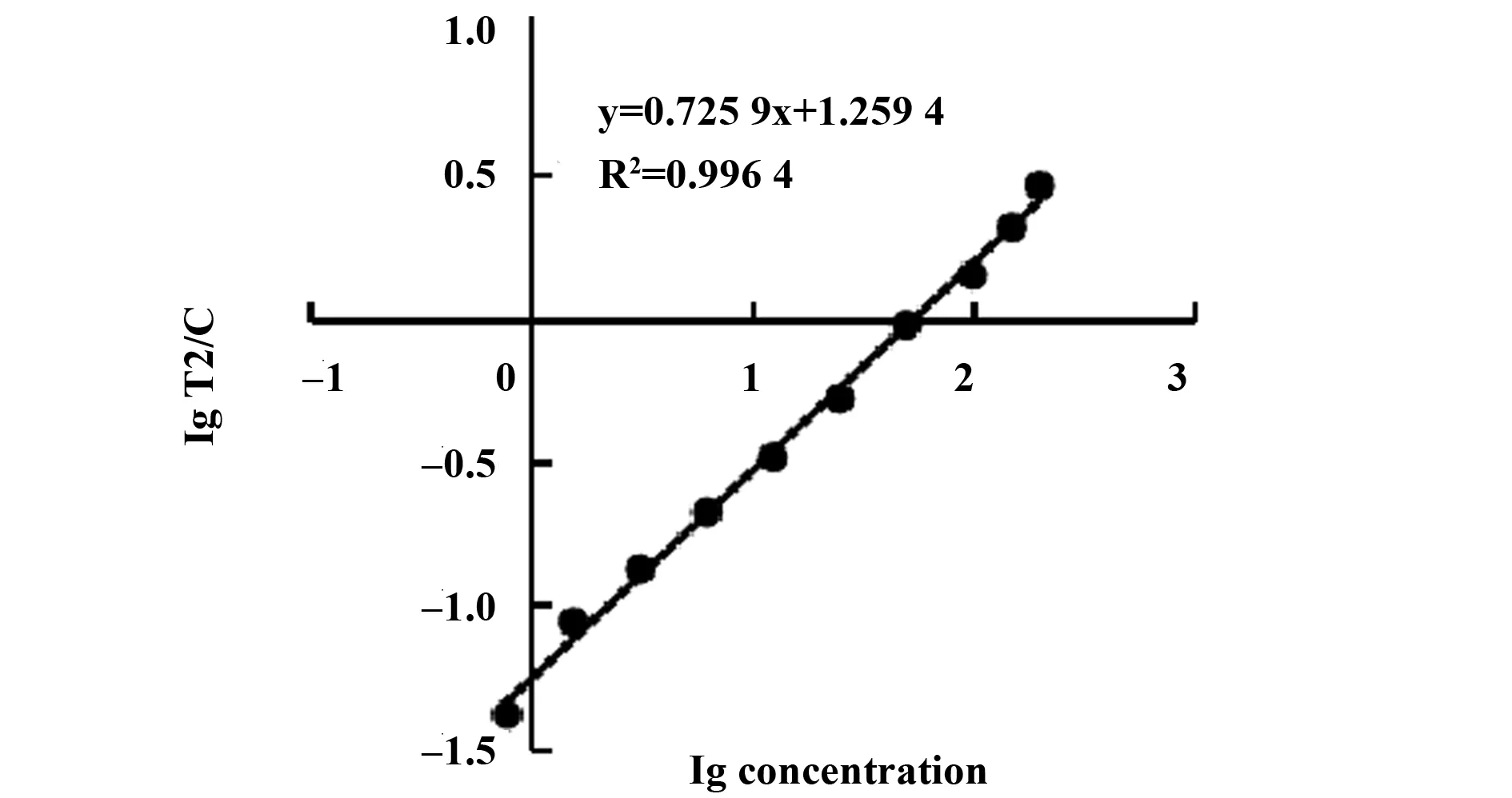
图3 CRP标准曲线Fig.3 Sandard curve of CRP
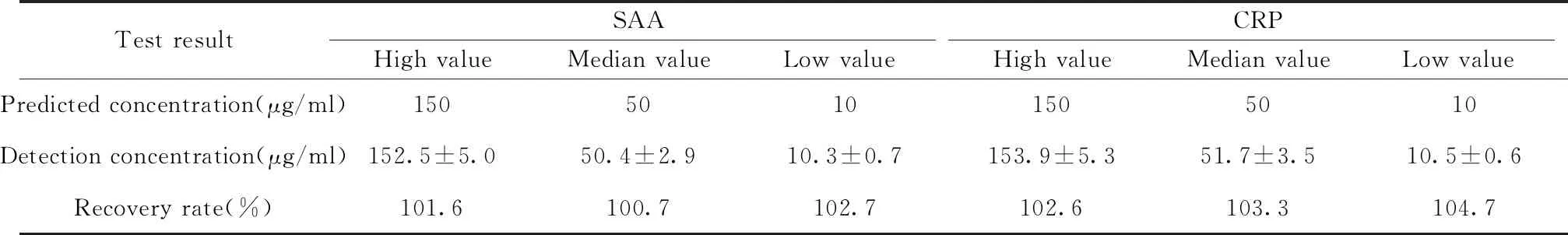
Test resultSAAHigh valueMedian valueLow valueCRPHigh valueMedian valueLow valuePredicted concentration(μg/ml)15050101505010Detection concentration(μg/ml)152.5±5.050.4±2.910.3±0.7153.9±5.351.7±3.510.5±0.6Recovery rate(%)101.6100.7102.7102.6103.3104.7
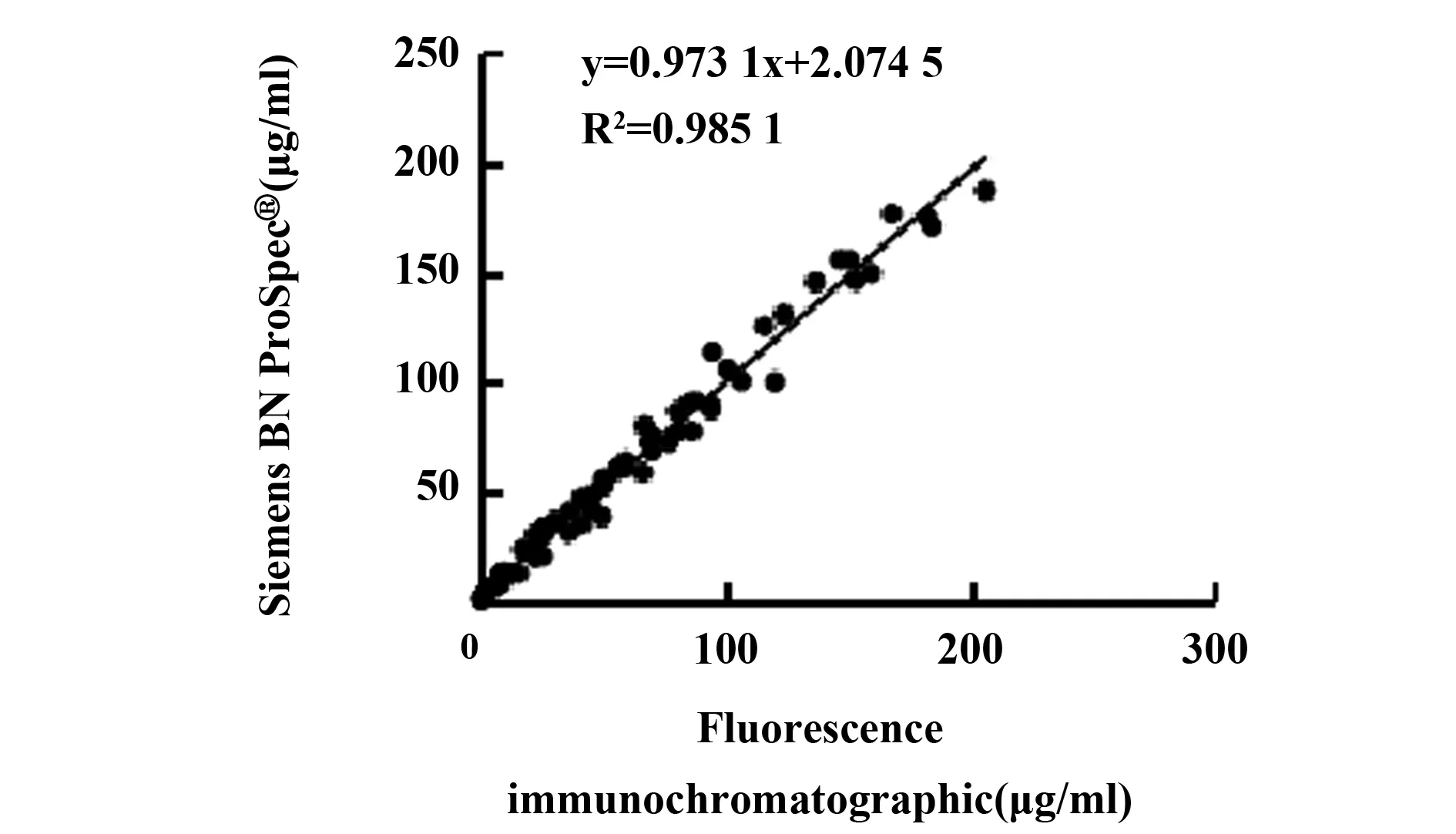
图4 SAA荧光免疫层析法与散射比浊法的相关性分析Fig.4 Correlation analysis between SAA fluorescence immunochromatography and scattering nephelometry

图5 CRP荧光免疫层析法与散射比浊法的相关性分析Fig.5 Correlation analysis between CRP fluorescence immunochromatography and scattering nephelometry
2.2.3准确度 采用本方法制备的SAA、CRP联合检测免疫层析试纸条回收率检测结果如表2所示,SAA高、中、低值回收率分别为101.6%、100.7%、102.7%;CRP高、中、低值回收率分别为102.6%、103.3%、104.7%,均符合回收率85%~115%的要求。
2.2.4交叉反应 从实验结果可知滴加不同浓度SAA样品时,只有T1线和C线有荧光条带,而T2线没有条带出现;在滴加仅含有CRP的样品时,只有T2线和C线出现荧光条带,而T1线无条带出现。表明,SAA和CRP两种抗原进行联合检测时没有交叉反应,互不干扰。
2.3方法学比对 与西门子BN ProSpec®特定蛋白分析系统对比分析SAA、CRP检测结果如图4、5。两种方法检测SAA的相关方程为: y=0.973 1x+2.074 5,R2=0.985 1;CRP的相关方程为: y=0.980 7x+1.008 2,R2=0.980 4。表明本方法制备的SAA、CRP联合检测免疫层析试纸条检测SAA、CRP与西门子BN ProSpec®特定蛋白分析系统相关性较好。
3 讨论
感染性疾病发病急、进展快,若早期未及时诊断治疗,病情进展可能危及生命。临床上常以CRP作为指标鉴别细菌和病毒感染,指导医师有针对性应用抗生素[7],但多项研究表明,其单独检测特异性不高[8,9]。SAA是由肝脏合成的急性时相蛋白[10],在细菌或病毒感染早期均可升高,而CRP在病毒感染时一般不增高[11]。崔海涛等[12],潘克女等[13]研究发现SAA和CRP的联合检测相对于单独检测CRP对感染性疾病的早期诊断敏感性更高、特异性更好,可为早期细菌和病毒感染的鉴别诊断提供有力的证据,减少不必要的抗生素应用。目前SAA、CRP常用的检测方法有免疫比浊法、酶联免疫吸附法,由于免疫比浊法需配备大型检测设备,酶联免疫吸附法操作繁琐,使床旁快速检测及社区基层医院的推广应用受到限制。
本研究以镧系稀土元素Eu3+羧基时间分辨荧光微球作为标记物,与葛宇新等[14]以CdTe量子点为标记物建立的C反应蛋白荧光免疫层析检测方法相比,显著增强了荧光强度,提高了荧光稳定性,保证了检测结果的灵敏度和特异性。本研究采用EDC、NHS两步法活化荧光微球,先加入EDC活化微球表面羧基,与蛋白质或抗体形成O-酰基脲中间体后,再加入NHS溶液,进一步形成更稳定的N-羟基琥珀酰亚胺酯,显著提高了微球抗体偶联物的稳定性。此外,在课题组前期技术积累的基础上,优化了微球复溶液配方,解决了试纸条研发中普遍遇到的稳定性差的关键问题。通过检测低、中、高定值SAA、CRP样本,进行批间、批内精密性研究,SAA、CRP批内、批间精密性(CV)均<15%,符合精密性要求。经优化SAA、CRP配对抗体标记、包被比例,使本研究建立的SAA、CRP荧光免疫层析联合检测试纸条检测CRP的线性范围可达0.78~200 μg/ml,较葛宇新等[14]建立的C反应蛋白荧光免疫层析检测方法(线性范围为0.1~1 000 ng/L)宽,检测SAA灵敏度可达0.35 μg/ml,较李启欣等[15]建立的血清淀粉样蛋白A免疫荧光层析法灵敏度(3 mg/L)高。通过筛选特异性优良的SAA、CRP配对抗体,使SAA、CRP联合检测时彼此无交叉反应,互不干扰,可在满足急诊需求的前提下使CRP和SAA的临床检验更便捷、更精准。
本研究选用80例CRP、SAA含量从低值到高值定值血清作为样本,使用本研究建立的联合检测方法与西门子BN ProSpec®特定蛋白分析系统(散射比浊法)同时检测,显示测定血清中SAA和CRP相关系数分别为0.985 1、0.980 4,两者线性良好。同时由于时间原因,本方法存在检测样本量有限等问题,后期需大样本重复验证。综上所述,本方法精密度、准确性、系统间一致性评价的结果均满足临床使用的要求,可作为国内该项目联合检测的新一代快速检测试剂,值得广泛推广和运用,同时也为其他标志物的联合检测提供了借鉴。

