茯苓酸通过激活Nrf2/HO-1信号通路改善OX-LDL诱导的人脐静脉内皮细胞损伤①
刘 凤 刘增长
(重庆医科大学附属第二医院,重庆 400000)
冠状动脉性心脏病(冠心病)是发达国家首位致死病因。在我国,随着社会经济的发展及人民生活方式的改变,冠心病发病率及死亡率居高不下,俨然成为重大的公共卫生问题[1]。其死亡率超过肿瘤及其他疾病,位居首位,所以探究有效的冠心病防治方法仍然是我们研究的重中之重。
动脉粥样硬化是冠心病的主要病理基础,内皮功能受损是动脉粥样硬化机制中的早期关键事件[2],而外界刺激产生的过量活性氧(ROS)将致使细胞发生氧化应激损伤,这是内皮功能障碍的主要原因。过量的ROS产生导致细胞内抗氧化和促氧化的平衡失调,进而触发炎症信号的激活及线粒体介导的凋亡,加重动脉粥样硬化的发生发展[3]。过去的研究指出,清除体内过量的ROS或增强抗氧化能力可能是预防和治疗冠状动脉粥样硬化的关键点[4]。
茯苓酸是一种从茯苓中提取的三萜类化合物。目前,大量研究证据表明,茯苓酸具有多种药理作用,包括止吐、抗炎、抗癌等特性[5]。并且在许多细胞模型中均表现出抗氧化特性。作为天然活性物质,茯苓酸相比于人工合成的化学药物具有来源广泛、价格低廉、毒副作用小等优点。已有文章报道多种天然活性物质,如丹参素、姜黄素等均能够通过调节氧化应激相关信号通路对多种心血管疾病发挥保护作用[6,7]。因此将天然活性物质应用于临床疾病治疗是一种趋势。尽管此前已有文献报道,茯苓酸可以减轻血管紧张素Ⅱ(AngⅡ)诱导的H9C2细胞肥大和凋亡[8],还可通过抗炎及抗氧化作用改善脓毒症引起的急性肾损伤[9]。但此天然活性物质对于动脉粥样硬化的影响尚不清楚。故本研究旨在探究茯苓酸对氧化低密度脂蛋白(OX-LDL)诱导的人脐静脉内皮细胞氧化应激损伤的影响及其潜在的机制,以明确其可否通过改善冠状动脉粥样硬化内皮损伤,从而具有治疗冠心病的潜能。
1 材料与方法
1.1材料 人脐静脉内皮细胞株(HUVEC)购自莱博斯生物技术有限公司;茯苓酸(Pachymic acid,PA)、CCK-8试剂盒购自北京索莱宝科技有限公司(Solarbio);总超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所;氧化低密度脂蛋白(OX-LDL)购自YiYun Biotechnologies;活性氧(ROS)检测试剂盒购自碧云天生物技术研究所;血红素加氧酶抑制剂Znpp购自美国APExBIO;Nrf2、HO-1、Bcl-2、Bax抗体均购于GeneTex;Cleaved-caspase3购于Cell Signaling Technology;RT-PCR中所使用的引物均购自上海生工公司。
1.2方法
1.2.1细胞培养 人脐静脉内皮细胞培养于完全RPMI1640培养基中[含10%热灭活胎牛血清(FBS)、100 μg/ml链霉素以及100 U/ml青霉素],放入5%CO2、37℃恒温培养箱中。根据细胞生长密度进行换液和传代培养。取对数生长期的细胞约2×105个/ml接种到培养瓶或培养板中,待其生长状态达到实验要求后进行分组给药。
1.2.2药物制备 将茯苓酸粉末溶于二甲基亚砜(DMSO)中制成茯苓酸储备溶液(20 mmol/L),然后在使用前用无血清的RPMI1640培养基稀释成所需的浓度。并且保证在用于处理细胞的溶液中DMSO的终浓度不超过0.1%,以规避DMSO的细胞毒性作用。OX-LDL在使用前用无血清培养基稀释成所需浓度,在特定的实验组中,用PA预处理HUVEC 12 h,然后再暴露于70 μg/ml OX-LDL 24 h[10]。
1.2.3CCK-8法检测细胞活力 将细胞接种到96孔板中,密度为4 000个/孔,细胞培养过夜,用不同浓度(10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L)的茯苓酸预处理HUVEC 12 h,再暴露于OX-LDL 24 h。处理好细胞后,向每孔加入10 μl CCK-8溶液,后将96孔板放回培养箱内孵育1 h。用酶标仪测定在450 nm处的吸光度。细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100。
1.2.4流式细胞术检测细胞凋亡 收集处理好的细胞,用PBS洗3次后加入500 μl PBS重悬细胞,置于1.5 ml EP管中,每管在避光条件下分别加入5 μl Annexin V及5 μl PI,混匀,于室温避光条件下反应15 min,流式细胞仪(BD Calibur)检测凋亡率。
1.2.5ROS含量检测 细胞传代处理后,将细胞悬液接种于96孔培养板中,当细胞生长密度达到90%~95%时,按照对照组(未给予任何药物处理)、70 μg/ml OX-LDL组、70 μg/ml OX-LDL+PA组、PA组处理细胞,预先使用PA(10 μmol/L)预处理HUVEC 12 h,再用70 μg/ml OX-LDL接着处理细胞24 h后,吸出旧培养基并用PBS清洗2次。向96孔板加入10 μmol/L DCFH-DA,继续放在细胞培养箱内孵育30 min,用无血清培养基清洗3次,置于荧光酶标仪中,在488 nm激发波长和525 nm发射波长的条件下检测ROS相对荧光含量。
1.2.6SOD和MDA的检测 HUVEC根据相应的组别处理好后,用细胞刮收集细胞,加入200 μl PBS冰上超声破碎裂解细胞,然后再置于4℃离心机中,12 000 r/min离心10 min。取上清液按照SOD(超氧化物歧化酶)和MDA(丙二醛)试剂盒说明书检测其活性。
1.2.7RT-PCR检测Nrf2/HO-1的mRNA表达水平 使用RNA快速提取剂盒(上海奕杉生物)提取各处理组细胞总RNA,并检测其浓度。应用反转录试剂盒严格按照说明书将RNA逆转录为cDNA,进行PCR扩增。Nrf2及HO-1扩增引物购自Sangon Biotech(上海生工)。引物如下:Nrf2上游TCCAGTCAGAAACCAGTGGAT,Nrf2下游GAATGTCTGCGCCAAAAGCTG;HO-1上游AAGACTGCGTTCCTGC-TCAAC,HO-1下游AAGACTGCGTTCCTGCTCAAC。以GAPDH为内参,采用2-ΔΔCt法计算Nrf2及HO-1的mRNA相对表达量。
1.2.8蛋白免疫印迹法检测凋亡相关蛋白及Nrf2/HO-1的表达水平 为了探究PA潜在的作用机制,我们首先使用HO-1特异性抑制剂Znpp(10 μmol/L)处理细胞24 h,再用PA预处理HUVEC 12 h,最后加入70 μg/ml OX-LDL诱导细胞。收集处理好的细胞,在细胞样品中加入含有蛋白酶抑制剂的RIPA裂解缓冲液,收集裂解后蛋白样品置于4℃离心机,12 000 r/min离心10 min。吸取上清液,使用BCA试剂盒(北京索莱宝)测量蛋白质浓度。再将上清液与上样缓冲液混合并煮沸10 min,储存于-20℃条件下。蛋白样品采用25 μg上样量上样至SDS-PAGE凝胶,恒压电泳,然后转膜至PVDF膜,5%脱脂奶粉(TBST溶解)室温下封闭1 h,一抗4℃条件下孵育过夜。将条带置于相应属性的二抗中室温孵育1 h,采用ECL化学发光法显色。

2 结果
2.1PA增加OX-LDL诱导后的HUVEC细胞活力 PA的化学结构如图1A所示。与对照组相比,单独使用70 μg/ml OX-LDL诱导HUVEC后,细胞活力明显下降,而采用不同浓度(10 μmol/L、20 μmol/L、40 μmol/L、80 μmol/L)的PA预处理HUVEC后,PA浓度<80 μmol/L的组相比OX-LDL处理组,其细胞活力有所提升,其中10 μmol/L PA预处理后细胞活力提高最为显著(如图1B)。因此,在随后的实验中使用10 μmol/L PA处理细胞。
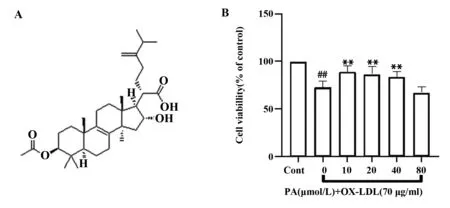
图1 人脐静脉内皮细胞(HUVEC)细胞活力分析Fig.1 Analysis of cell viability in HUVECNote:A.Chemical structure of PA;B.Effects of differernt concentrations of PA pretreatment on cell viability after OX-LDL induced HUVEC injury.Compared with the control group,##.P<0.01;Compared with OX-LDL group,**.P<0.01.
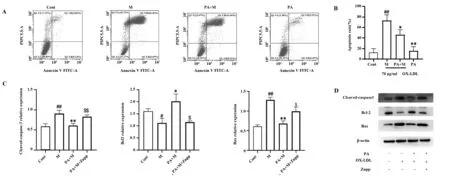
图2 PA对OX-LDL诱导的HUVEC凋亡的影响Fig.2 Effect of PA on apoptosis of OX-LDL-induced HUVEC Note:A,B.Flow cytometry was used to detect the apoptosis rate of cells in each treatment group after double staining of membrane conjugate protein V/PI.C,D.Expression of apoptosis-related proteins were detected by Western blot.Cont.Control;M.OX-LDL;PA+M.PA+OX-LDL;PA+M+Znpp.PA+OX-LDL+Znpp.Compared with the control group,##.P<0.01,#.P<0.05;Compared with OX-LDL group,**.P<0.01,*.P<0.05;Compared with PA+OX-LDL group,$$.P<0.01,$.P<0.05.

图4 HUVEC中PA诱导的保护基因及蛋白的表达分析Fig.4 Effects of PA on cytoprotective gene and protein expression in HUVEC cellsNote:A,B.The mRNA levels of cytoprotective genes,such as Nrf2 and HO-1 were evaluated using RT-PCR,with GAPDH as an internal control;C,D,E.The expression of Nrf2 and HO-1 in HUVEC were detected by Western blot.Compared with the control group,##.P<0.01;Compared with OX-LDL group,**.P<0.01;Compared with PA+OX-LDL group,$$.P<0.01.

图3 HUVEC氧化应激损伤分析Fig.3 Analysis of oxidative stress damage in HUVECNote:Compared with the control group,##.P<0.01;Compared with OX-LDL group,**.P<0.01.
2.2PA减弱OX-LDL诱导的HUVEC细胞凋亡 膜联蛋白V和PI双染色是比较常用的检测细胞凋亡水平的方法,因此采用流式细胞术检测各组细胞的凋亡率。与对照组相比,OX-LDL组的凋亡率明显升高,PA预处理则可以显著降低其凋亡率,而单独使用PA处理HUVEC对其凋亡率无影响(如图2A、B),这表明PA预处理HUVEC后可以减轻OX-LDL诱导的细胞凋亡。此外,蛋白免疫印迹分析显示,PA预处理可以逆转OX-LDL诱导HUVEC后与凋亡正相关的蛋白Cleaved-caspase3及Bax的上调,促使细胞保护蛋白Bcl-2的表达增加,而这一作用可以被HO-1特异性抑制剂Znpp(10 μmol/L)消除。这与流式细胞术检测结果一致。以上结果表明PA可以减轻OX-LDL诱导的HUVEC细胞凋亡,并且这种作用可能与HO-1表达水平有关。
2.3PA减轻OX-LDL诱导的HUVEC氧化应激损伤 使用活性氧(ROS)特异性荧光染料DCFH-DA检测细胞内ROS相对含量。结果显示,OX-LDL诱导HUVEC 24 h后细胞内ROS水平明显增加,PA预处理可以减少细胞内ROS的产生(如图3A)。促氧化剂丙二醛(MDA)含量和细胞内ROS水平均能反映细胞氧化应激损伤程度,故使用MDA试剂盒检测细胞内MDA含量,其结果与各处理组ROS水平是相呼应的,OX-LDL组与对照组相比,其细胞内MDA含量明显增加,PA预处理能够降低细胞内MDA含量(如图3B)。超氧化物歧化酶(SOD)属于抗氧化酶,与对照组相比,OX-LDL组SOD活性明显下降,而PA预处理能够上调SOD活性(如图3C)。 结果显示,PA预处理可以改善OX-LDL诱导的HUVEC细胞内氧化应激损伤。
2.4PA通过激活Nrf2/HO-1信号通路抑制氧化应激,减轻OX-LDL诱导的HUVEC细胞凋亡 为了探究PA保护内皮细胞免受损伤的潜在机制,使用相应药物处理HUVEC。在PA预处理12 h后显著逆转OX-LDL下调的内皮细胞中Nrf2/HO-1的mRNA水平。同时我们使用蛋白免疫印迹法检测各处理组Nrf2/HO-1的表达情况(如图4)。发现与对照组相比,OX-LDL处理的HUVEC中Nrf2及HO-1蛋白表达水平下降,PA预处理可以上调细胞内Nrf2及HO-1蛋白的表达。在使用HO-1特异性抑制剂Znpp后,PA上调细胞内Nrf2、HO-1蛋白及mRNA表达水平的作用则失效。这表明PA可以激活Nrf2/HO-1信号通路发挥保护作用。
3 讨论
冠状动脉粥样硬化斑块破裂将导致血流阻塞、心肌缺血,进而发展为一系列恶性心血管事件。严重危害人类健康并给患者带来巨大的经济负担。尽管临床上有相当多的干预手段及药物可减轻危害程度,然而最终的临床结果却不尽人意。故将关注点放在对冠心病早期发病机制的防治上可能是改善目前状况的一个有效方法。本研究旨在探究PA对OX-LDL诱导的内皮细胞损伤的保护作用。OX-LDL可通过诱导细胞产生过量的ROS损害内皮细胞功能。更重要的是,我们研究发现PA预处理可通过激活Nrf2/HO-1信号途径抑制氧化应激并减少细胞凋亡,从而有效改善内皮细胞功能。
PA可能是通过减弱OX-LDL诱导的内皮细胞氧化应激损伤进一步发挥抗凋亡作用。最近有研究提出,OX-LDL能够刺激细胞产生过量ROS并上调黏附分子的表达将单核细胞募集到内皮下,从而损害内皮细胞的分泌功能并降低其抗氧化能力,诱导内皮细胞凋亡[11]。因此通过抗氧化剂消除过量的ROS并提高其抗氧化能力可能是抑制OX-LDL诱导内皮损伤的关键方法。我们的研究表明,OX-LDL诱导后的HUVEC细胞内产生大量ROS,引起细胞内氧化还原稳态的失衡,表现为抗氧化酶SOD活性降低,促氧化物MDA含量升高,使细胞发生氧化应激损伤。但PA预处理能够显著降低ROS及MDA的产生,并且提升内源性抗氧化酶SOD活性。这些结果表明PA可能是通过提升细胞内抗氧化剂浓度来抑制OX-LDL诱导的内皮损伤。另有研究报道称,高水平的氧化应激可干扰线粒体PT孔正常开放与关闭及电子转移,从而导致细胞凋亡[12]。细胞凋亡主要是由半胱天冬酶(caspase)分子执行的细胞程序性死亡,细胞内Bcl2蛋白家族是caspase活化的中心调节因子,其中包括抗凋亡蛋白Bcl-2及促凋亡蛋白Bax[13]。此前有研究者证实,Bcl-2的上调和Bax的下调能够抑制OX-LDL诱导的巨噬细胞凋亡[14]。故我们猜测在OX-LDL诱导的HUVEC细胞损伤模型中是否也有同样的表现,并进一步做了验证,发现与过往研究一致。在本研究中,流式细胞术和蛋白免疫印迹结果均显示,OX-LDL作用于HUVEC后,细胞凋亡率明显增加,且Bcl-2表达下调、Bax和Cleaved-caspase3表达上调。尤其值得关注的是,PA预处理后下调促凋亡蛋白(Bax、Cleaved-caspase3)的表达,并上调抗凋亡蛋白(Bcl-2)的表达进而减弱OX-LDL诱导的细胞凋亡。这一结果表明OX-LDL引发HUVEC氧化应激损伤后,可进一步通过调节Bcl-2和Bax蛋白平衡,触发细胞凋亡,而这一恶性过程可被PA预处理所终止。
PA可通过激活Nrf2/HO-1信号途径对OX-LDL诱导后的HUVEC发挥保护作用。Nrf2/HO-1途径被认为是细胞抗氧化防御的关键机制。越来越多研究表明,天然活性产物能通过激活Nrf2/ARE途径保护心血管功能[15]。核因子E-2相关因子2(Nrf2)是维持氧化还原稳态和细胞抗氧化防御的关键调节因子[16],能够通过抗氧化反应元件(ARE)调节多种抗氧化剂及Ⅱ期解毒酶的表达。其中包括血红素加氧合酶1(HO-1)、醌氧化还原酶(NQO1)、超氧化物歧化酶(SOD)[17]。在Nrf2调节的抗氧化剂及Ⅱ期解毒酶中,血红素加氧合酶(HO-1)被认为在动脉粥样硬化性疾病中起关键的保护作用[18]。HO-1能够作为抗氧化酶催化促氧化剂血红素降解产生铁、一氧化碳(CO)、胆绿素等代谢产物从而发挥抗炎、抗氧化、抗凋亡等作用。此前有大量研究证实,HO-1的表达上调有助于细胞抵御外界刺激,响应于氧化应激损伤[19-21]。与此一致,我们在蛋白和基因层面均发现PA预处理12 h后上调了Nrf2核易位及下游靶标HO-1的表达,表明PA通过上调内皮细胞内Nrf2/HO-1表达水平而表现出抗氧化活性。此外,在使用HO-1特异性抑制剂Znpp后,消除了PA对于内皮细胞的保护作用。这证实PA通过增加Nrf2核易位及HO-1的表达来介导抗氧化应激及抗凋亡作用。
综上所述,PA作用于HUVEC后通过激活Nrf2/HO-1信号途径发挥抗凋亡、抗氧化作用,从而改善OX-LDL诱导的内皮细胞功能障碍,可作为早期抗动脉粥样硬化疾病的潜在药物。

