枯草芽孢杆菌Prob1822喷雾干燥制备益生菌粉工艺优化
肖怀秋1,2,李玉珍1,*,赵谋明2,林亲录3,刘 军1,周 全1,姜明姣
(1.湖南化工职业技术学院制药与生物工程学院,湖南株洲 412000; 2.华南理工大学食品科学与工程学院,广东广州 510640; 3.中南林业科技大学食品科学与工程学院,湖南长沙 410004; 4.湖南中威制药有限公司,湖南株洲 412000)
益生菌(probiotics)是指具有维持人体内菌群平衡,对人体健康产生有益作用的微生态制剂[1]。口服足量活性益生菌有助于缓解急慢性胃肠炎、治疗腹泄、改善消化,缓解乳糖不耐症等症状[2],在减少病原菌在肠内定植和生长、提升免疫力、缓解神经发育障碍等方面具有显著功能[3]。枯草芽孢杆菌(Bacillussubtilis)是益生菌的重要来源之一[4],其活菌制剂口服液可用于肠炎、支气管炎和腹泻等疾病治疗和预防[5]。
喷雾干燥由于受热时间短、料温低和生理活性物质活性损失小而广泛应用于益生菌菌体干燥[6],具有干燥时间极短,产品分散性和溶解性好,生产过程简单,设备成本低等优点,特别适用于工业化连续生产。提升益生菌喷雾干燥菌体存活率是实现益生菌微生态制剂长期保存和提高益生菌生理功能的重要基础,常用策略有增强菌体热耐受性、使用抗热保护剂和优化喷雾干燥工艺[7]。研究表明,热诱激能增强菌体热耐受性,特别是稳定期细胞,但要注意热诱激温度选择[8]。范娜等研究发现,糖类与蛋白质联用作为复合抗热保护剂能增强菌体热耐受性[9]。肖怀秋等对喷雾干燥前的BacillussubtilisProb1822益生菌菌体进行了热诱激预处理,确定了最佳热诱激条件,并进行了复合抗热保护剂对菌株抗热保护的影响,优化得到复合抗热保护剂配方(海藻糖9.0%、蔗糖5.0%和脱脂奶粉6.8%),在复合抗热保护剂保护下菌体存活率达95.24%±0.84%[7]。除热诱激处理和使用抗热保护剂外,对喷雾干燥工艺参数优化也是提升菌体存活率的重要策略。
本试验选择热诱激预处理和使用复合抗热保护剂,以菌体存活率为评价指标,通过单因素实验筛选对菌体存活率影响较重要的3个因素,结合中心复合响应面优化技术对进料速率(X1)、进风量(X2)和出口温度(X3)3个关键因素的水平进行优化,建立了因素与响应值的数学模型和回归方程,获得了菌体喷雾干燥的最优参数,为枯草芽孢杆菌喷雾干燥制备益生菌菌粉提供理论支持。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌(Bacillussubtilis)Prob1822 实验室保藏;海藻糖 食品级,海北鹏宇生物科技有限公司;蔗糖 食品级,市售;脱脂奶粉 食品级,伊利集团;其它试剂为国产分析纯。
UV-2500紫外可见分光光度计 日本岛津公司;BBS-SSC超净工作台 济南腾览仪器有限公司;DH-360电热恒温培养箱 北京科伟永兴仪器有限公司;LDZX-50FAS立式压力蒸汽灭菌器 上海申安医疗器械厂;KRH-PJ-10L发酵罐 江苏镇江科海生物工程设备有限公司;SP-1500喷雾干燥机 上海顺仪实验设备有限公司。
1.2 实验方法
1.2.1 培养基配制方法 菌种活化采用牛肉膏蛋白胨固体斜面培养基,种子培养采用牛肉膏蛋白胨液体培养基。牛肉膏蛋白胨培养基组成为牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L,pH7.4,固体培养基加入15~20 g琼脂;发酵培养基[10]组成为冷榨花生粕蛋白胨12 g/L、酵母膏5 g/L、NaCl 5 g/L,pH7.4。所有培养基配制完成后均于131 ℃灭菌20 min,经检验无菌后备用。
1.2.2 菌种活化、菌悬液制备及喷雾干燥 取冷冻保存(-18 ℃)的枯草芽孢杆菌菌种1环转接于牛肉膏蛋白胨固体斜面培养基,于37 ℃恒温培养24 h进行菌种活化培养;活化完成后,用接种环从斜面刮取两环菌种接种至牛肉膏蛋白胨培养基中进行种子培养(100 mL/250 mL),37 ℃、120 r/min恒温振荡培养24 h;按5%(v/v)接种量将种子液接种于发酵罐中,37 ℃、120 r/min恒温培养至稳定期(26 h);4000 r/min离心15 min,弃上清液,沉淀用无菌水洗涤并重新悬浮,上述操作重复3次;菌悬液于55 ℃热诱激10 min,并按预定百分比例(w/v,以菌悬液体积为基准)加入复合抗热保护剂(海藻糖∶蔗糖∶脱脂奶粉=0.43∶0.34∶0.33,w/w),充分混匀后再进行喷雾干燥制备益生菌菌粉。
1.2.3 活菌计数与益生菌存活率计算 准确称取1.0000 g喷雾干燥后收集的菌粉用稀释平板法进行活菌计数;选取3个相邻稀释度的菌液0.1 mL倾入牛肉膏蛋白胨琼脂平板上,涂布均匀后于37 ℃倒置培养48 h,记录培养皿上菌落数量(CFU),菌落数以CFU/g计。菌体存活率计算公式:
菌体存活率(%)=喷雾干燥后总活菌数(cfu·g-1)/喷雾干燥前总活菌数(cfu·g-1)×100
1.2.4 水分含量的测定 水分含量根据GB 5009.3-2016直接干燥法测定。准确称取喷雾干燥后收集的菌粉10.0000 g置于101~105 ℃干燥箱中,瓶盖斜支于瓶边,干燥2~4 h后,盖好取出,放入干燥器内冷却至室温称量,记录质量,然后再放入101~105 ℃干燥箱中继续干燥1 h,取出冷却后称重,重复此过程直至前后两次质量差不超过2 mg,即为恒重。
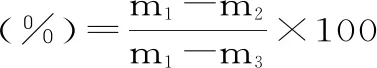
式中:m1为称量瓶和试样的质量,g;m2为称量瓶和干燥后试样的质量,g;m3为称量瓶的质量,g。
1.2.5 单因素实验
1.2.5.1 复合抗热保护剂用量 在入口温度80 ℃,进风量50 m3/h,出口温度55 ℃,进料速率400 mL/h条件下,考察复合抗热保护剂用量(0、5%、10%、15%和20%,w/v)对喷雾干燥的影响,测定菌体存活率和含水量,以菌体存活率为主要评价指标。
1.2.5.2 入口温度 在复合抗热保护剂添加量15%,进风量50 m3/h,出口温度55 ℃,进料速率400 mL/h条件下,考察入口温度(60、80、100、120和140 ℃)对喷雾干燥的影响,测定菌体存活率和含水量,以菌体存活率为主要评价指标。
1.2.5.3 进料速率 在复合抗热保护剂添加量15%,入口温度100 ℃,进风量50 m3/h,出口温度55 ℃条件下,考察进料速率(200、400、600、800和1000 mL/h)对喷雾干燥的影响,测定菌体存活率和含水量,以菌体存活率为评价指标。
1.2.5.4 进风量 在复合抗热保护剂添加量15%,入口温度100 ℃,进料速率600 mL/h,出口温度55 ℃条件下,考察进风量(30、50、70、90和110 m3/h)对喷雾干燥的影响,测定菌体存活率和含水量,以菌体存活率为主要评价指标。
1.2.5.5 出口温度 在复合抗热保护剂添加量15%,入口温度100 ℃,进料速率600 mL/h,进风量90 m3/h条件下,考察出口温度(50、55、60、65和70 ℃)对喷雾干燥的影响,测定菌体存活率和含水量,以菌体存活率为主要评价指标。
1.2.6 中心复合响应面优化喷雾干燥工艺参数 对进料速率(X1,mL/h)、进风量(X2,m3/h)和出口温度(X3, ℃)进行中心复合响应面优化,各因素设计5个水平,即±r(上下星号臂),±1(上下水平点)和0(中心点,N=3)。本试验星号臂r=1.682[11]。试验因素水平与编码如表1所示。
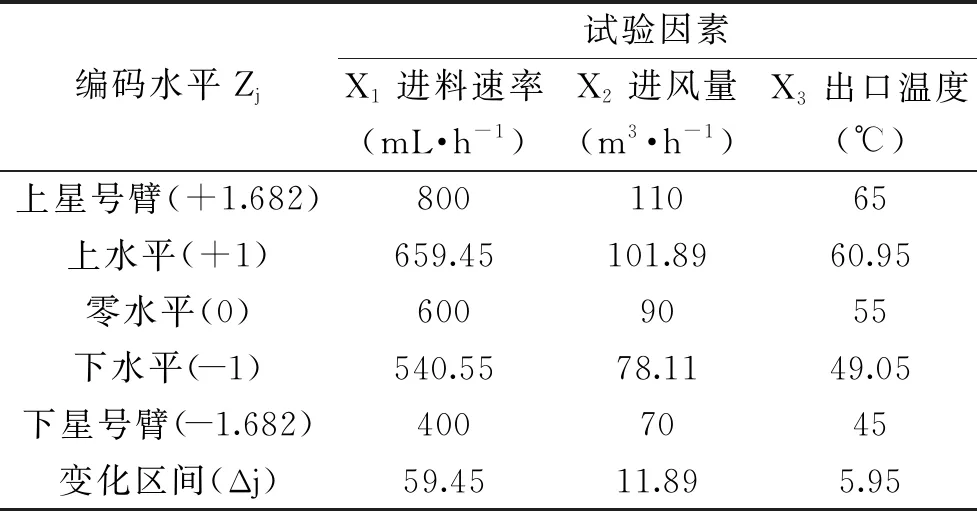
表1 中心复合响应面优化设计因素水平与编码Table 1 Experimental levels and codes for CCD-RSM
注:r=1.682,z为编码值,x为试验值。零水平Z0j=(Z1j+Z2j)/2,Δj=(Z2j-Z0j)/r,编码线性变换xj=|Zj-Z0j|/Δj。
1.3 数据处理
试验结果均采用(n=3)标示;均数多重比较采用SPSS Statistics 25最小显著性差异法(LSD)进行,显著性水平选用α=0.05和α=0.01,P<0.01为差异极显著,用“**”表示;0.01
2 结果与分析
2.1 单因素实验结果
2.1.1 复合抗热保护剂用量 复合抗热保护剂用量对菌体存活率和含水量的影响如图1所示。
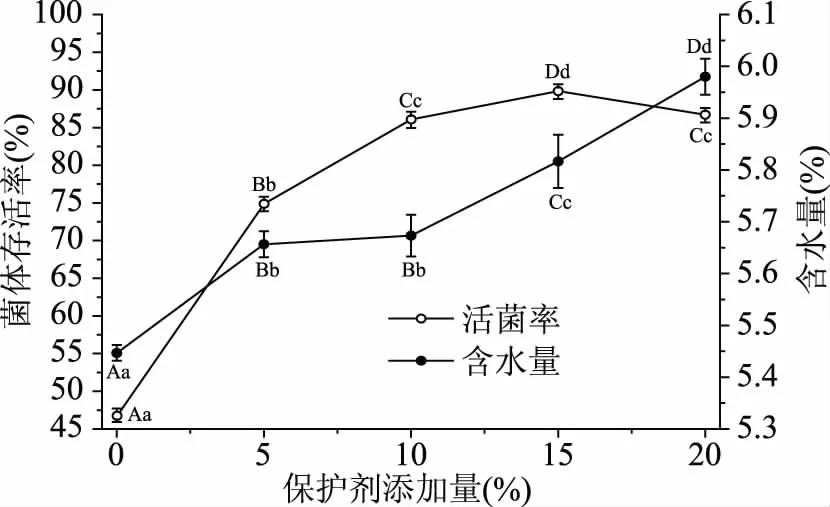
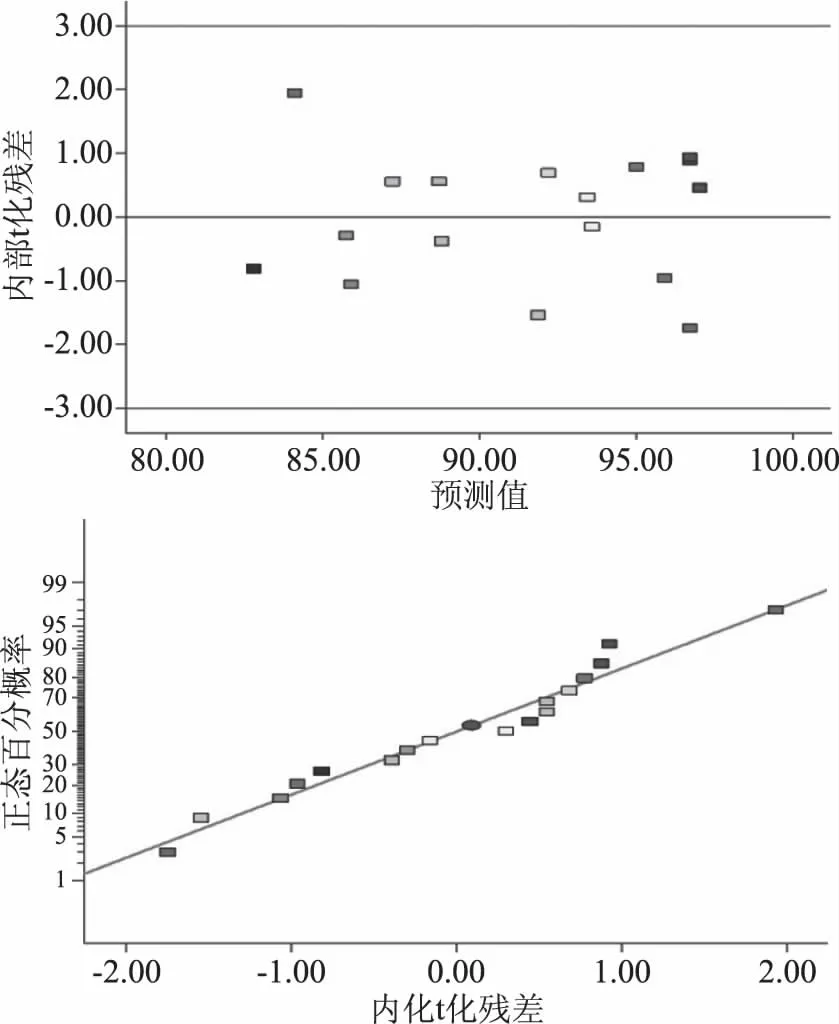
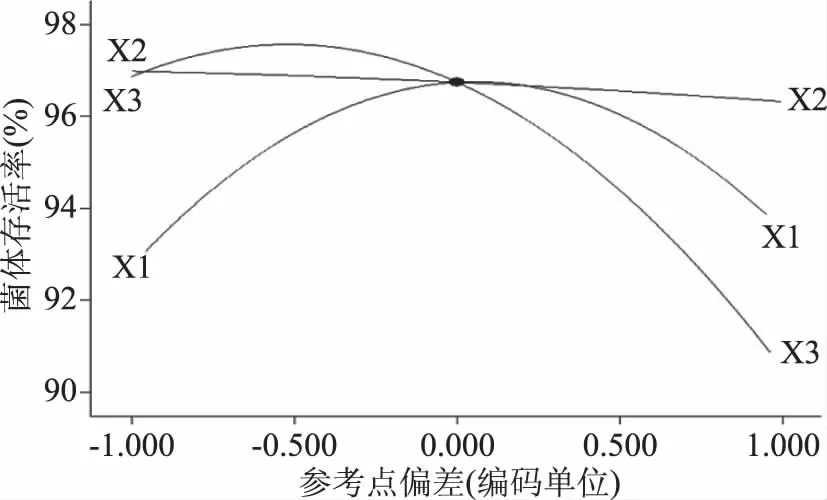
图1 复合保护剂用量对菌体存活率与含水量的影响Fig.1 Effects of anti-thermal compound protectant’s usage on CSR and WC注:标注相同字母表示差异不显著(P>0.05), 不同字母表示差异显著(0.01 由图1可看出,复合抗热保护剂在一定范围内(0~15%),随着使用量的增加,喷雾干燥后菌体存活率呈上升趋势;复合抗热保护剂添加量15%与不添加保护剂相比,菌体存活率存在极显著差异(P<0.01),菌体存活率达到最高(89.77%±0.99%),比未添加保护剂的对照存活率提高了91.78%,样品含水量为5.82%±0.05%;复合抗热保护剂进一步增加时,菌体存活率反而下降,且样品含水量进一步增加,达到了5.98%±0.03%,主要是由于抗热保护剂添加过量时,喷雾干燥基质中含糖量较高,不利于菌体雾化,且料液黏度较大,干燥过程中水分失去速率较慢,使菌体热接触时间延长,菌体存活率呈下降趋势[12]。因此,后续研究中复合抗热保护剂添加量均为15%。 2.1.2 入口温度 入口温度是喷雾干燥的重要参数,对干燥速率、产品形貌及产品稳定性等有重要影响[13]。入口温度对菌体存活率和含水量影响如图2所示。 图2 入口温度对菌体存活率和含水量的影响Fig.2 Influence of inlet temperature on CSR and WC 由图2可以看出,入口温度60、80和100 ℃时,菌体存活率分别为89.40%±0.40%、89.15%±0.28%和89.07%±0.61%,差异不显著(P>0.05);入口温度120和140 ℃时,菌体存活率分别为78.85%±0.71%和74.26%±0.94%,相比入口温度100 ℃时分别下降了11.47%和16.63%,菌体存活率差异极显著(P<0.01)。随着入口温度的提高,喷雾干燥菌体粉末的含水量也越低,存在极显著差异(P<0.01);综合考虑到入口温度对菌体存活率、产品含水率的影响以及喷雾干燥过程温差,后续试验喷雾干燥入口温度均为100 ℃。 2.1.3 进料速率 进料速率过快常造成干燥不完全或菌体结块,产品含水量高,若进料速率过低时,益生菌菌体热接触时间较长,影响菌体存活率[14]。进料速率对菌体存活率和含水量的影响如图3所示。 图3 进料速率对菌体存活率和含水量的影响Fig.3 Effects of feeding speed on CSR and WC 由图3可看出,在200~600 mL/h的进料速率范围内,随着进料速率的增加菌体存活率呈上升趋势,进料速率为600 mL/h时,菌体存活率最高92.31%±0.93%,与其它进料速率存在极显著差异(P<0.01);进料速率提升至800和1000 mL/h时,菌体存活率分别下降至82.77%±0.97%和73.69%±1.40%;研究发现,随着进料速率提升,喷雾干燥产品的含水量呈线性上升趋势,表明进料速率较大时,产品干燥不完全。因此,进料速率宜选择600 mL/h为好。鉴于进料速度对产品存活率有显著影响,选定为重要的响应面因素进行进一步优化。 2.1.4 进风量 进风量对菌体存活率和含水量的影响如图4所示。 图4 进风量对菌体存活率和含水量的影响Fig.4 Influence of air intake on CSR and WC 由图4可以看出,进风量在30~90 m3/h范围内,随着进风量增加,菌体存活率呈上升趋势,这是由于进风量增加,水分移除速率加快,有利于菌体干燥[7]。进风量在30~90 m3/h范围内,菌体存活率呈现极显著差异(P<0.01);进风量90和110 m3/h差异不显著(P>0.05);进风量为90 m3/h时,菌体存活率最高92.33%±0.57%。因此,进风量选择90 m3/h较好。鉴于进风量对菌体存活率有显著影响,选定作为响应面重要因素进行进一步优化。 2.1.5 出口温度 出口温度对菌体存活率和含水量的影响如图5所示。 图5 出口温度对菌体存活率和含水量的影响Fig.5 Effects of outlet temperature on CSR and WC 由图5可看出,随着出口温度的提高,菌体存活率呈显著下降趋势;出口温度为50和55 ℃时菌体存活率差异不显著(P>0.05),分别为93.36%±0.58%和93.2%±0.56%;随着温度的进一步提高,菌体存活率呈显著下降趋势;与出口温度55 ℃相比,存在极显著性差异(P<0.01),特别是出口温度70 ℃(75.09%±0.81%),相比55 ℃时菌体存活率下降了19.43%。Teixeira等[8]研究认为,喷雾干燥温度64 ℃以下可引起细胞膜亚细胞结构损伤,超过65 ℃可引起细胞壁和蛋白质等细胞结构和生物大分子损伤,甚至引发核糖体不可逆损伤[7]。因此,出口温度不宜过高。随着出口温度的提高,喷雾干燥后菌粉含水量呈显著下降趋势,除65和70 ℃之间喷雾干燥后菌粉含水量差异不显著(P>0.05)外,其它温度间差异均极显著(P<0.01);综合考虑菌体存活率和含水量,选择出口温度为55 ℃较好。鉴于出口温度对菌体存活率有显著影响,选定作为响应面重要因素进行进一步优化。 根据各因素对菌体存活率影响的显著性分析结果,确定进料速率(X1,mL/h)、进风量(X2,m3/h)和出口温度(X3, ℃)为重要因素,进一步应用中心复合响应面优化技术研究对菌体存活率的影响,试验安排与试验结果(含模型预测值)如表2所示。 表3 数学模型构建的序贯分析Table 3 Sequential analysis for mathematical model building 注:**表示差异极显著(P<0.01);*表示差异显著(0.01 表4 模型方差分析与回归分析表Table 4 ANOVA analysis and regression analysis of model 表2 中心复合响应面优化试验设计结果(含模型预测值)Table 2 Experimental design and results of CCD-RSM(with predicted values) 2.2.1 序贯分析优选数学模型 通过对各阶数学模型进行序贯分析(sequential analysis,SA)来优选构建数学模型(表3)。 2.2.2 模型方差分析与回归分析 模型方差分析与回归分析结果如表4。 2.2.3 模型诊断与因素重要性解析 残差分析是基于模型无法解释全部变异的理论基础上进行的。模型选择合适,残差呈随机均匀分布且呈正态概率分布[15]。由图6可看出,模型内部t化残差呈随机独立均匀分布且符合正态概率分布,说明模型残差是符合要求的。 图6 模型内部t化残差图和t化残差正态分布概率图Fig.6 Internally studentized residuals plot and normal probability plot of model 微扰曲线(perturbation plot)可在响应面优化曲面特定区域比较各试验因素对响应值的影响。如曲线陡直,则表明该因素对响应值敏感,若曲线平缓,则表明对响应值影响不敏感[15]。由图7可以看出,因素X3(出口温度)对菌体存活率最敏感,为最重要因素,其次为X1(进料速率),因素X2(进风量)曲线较为平缓,为最不重要因素,与因素的显著性分析结果完全一致。 图7 模型微扰曲线Fig.7 Perturbation plot of model 2.2.4 模型交互作用项影响分析 其它因素保持在中心水平时,观察两个因素交互作用对响应值的影响可得到其等高线图(图8)。等高线图呈圆形表示因素间交互作用不明显,椭圆形则表示交互作用显著。由图8可以看出,X1X3等高线图为椭圆形,影响极显著(P<0.01),交互作用项X1X2和X2X3影响不显著(P>0.05)。 图8 模型因素交互作用项等高线图Fig.8 Contour plot of the model factors interaction items 2.2.5 模型求解与验证试验 应用Design Expert优化模块求得方程最优解,即X1=-0.12,X2=-1,X3=-0.54,经转换可得到因素实际水平为进料速率为598.81 mL/h,进风量为78.11 m3/h和出口温度为51.79 ℃。为操作方便,将参数修约为进料速率600 mL/h,进风量80 m3/h和出口温度52 ℃,优化条件下验证试验结果为96.64%±1.43%,与模型预测理论值97.82%比较接近。 单因素结果表明,复合抗热保护剂用量为15%、入口温度为100 ℃、进料速率为600 mL/h、进风量为90 m3/h和出口温度为55 ℃条件下,菌体存活率相对较高;优选进料速率、进风量和出口温度为重要因素,并采用中心复合响应面优化技术研究了进料速率(X1)、进风量(X2)和出口温度(X3)对菌体存活率的影响,构建了三元二阶非线性回归方程;模型方差与回归分析表明,出口温度(X3)对菌体存活率影响极显著(P<0.01),进料速率(X1)与进风量(X2)影响不显著(P>0.05);模型信躁比SNR>4,所构建模型噪音小,可靠性较高;模型C.V=0.84%,表明模型精密度和准确度均较高。微扰曲线分析发现,出口温度(X3)对菌体存活率最敏感,为最重要因素。模型最优解求解并转化和修约得到喷雾干燥最优参数为进料速率600 mL/h,进风量80 m3/h及出口温度52 ℃,该优化条件下验证试验结果为96.64%±1.43%,模型预测理论值为97.8248%,表明在抗热保护剂的保护作用下菌体可以保持较高的存活率。 喷雾干燥过程中的热损伤和脱水干燥对益生菌亚细胞结构、胞内生物大分子及细胞器可能产生热损伤,常采取添加抗热保护剂进行菌体抗热保护[16],常用抗热保护剂有糖类和蛋白质[17]。周竞等[18]在未添加抗热保护剂条件下对B.subtilisBSD-2进行喷雾干燥并对喷雾干燥条件进行优化分析,优化条件下菌体存活率为75%;钟蔚[19]在未使用抗热保护剂条件下对B.subtilisBS1进行喷雾干燥,菌体存活率为89.2%;刘宇等[20]在未使用抗热保护剂条件下对猪源枯草芽孢杆菌进行喷雾干燥并进行工艺条件优化,优化条件下菌体平均存活率为75.7%;王雪莲等[21]应用响应面优化技术对生防菌B.subtilisB073抗热保护剂配方进行优化,优化配方为溶性淀粉(0.46%)、糊精(1.25%)、蔗糖(1.22%)、谷氨酸钠(0.37%),优化条件下菌体存活率为70%;杨正楠等[22]以脱脂乳作为喷雾干燥保护剂,喷雾干燥存活率达到93.6%,脱脂奶粉对菌体的保护效果要显著优于其他保护剂;本试验以海藻糖+蔗糖+脱脂奶粉为复合抗热保护剂进行喷雾干燥并对干燥工艺进行了优化分析,优化条件下菌体存活率高达96.64%±1.43%,研究结论与Ananta[23]、Leslie[24]和Hoobin[25]等结论相同;由此可说明,抗热保护剂的添加能较好的实现菌体的抗热保护,且不同抗热保护剂对菌体的抗热保护效果存在显著差异,以多糖和蛋白质作为复合抗热保护剂保护效果较好[26-27]。其可能原因是由于低聚糖等小分子保护剂为多羟基化合物,具有很好的亲水性,可与细胞膜磷脂或蛋白质极性基团形成氢键或水化层,保护细胞膜、细胞器膜及胞内生物大分子结构的完整性,而蛋白质等大分子保护剂则主要通过“包埋”形成天然“隔热屏障”;两种保护剂的保护机制不同,联合使用抗热保护效果更好[7]。 除热诱激增强菌体热耐受性和使用抗热保护剂提高菌体存活率外,对喷雾干燥工艺参数进行优化也可以提高菌体的热耐受性,优化喷雾干燥参数是益生菌喷雾干燥的重要研究内容,也是正确设定喷雾干燥工艺参数的关键所在,本实验也可为枯草芽孢杆菌微生态固态制剂提供理论与技术支持。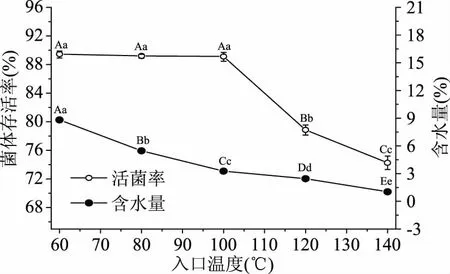



2.2 响应面优化喷雾干燥工艺参数



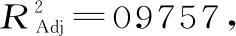


3 结论与讨论

