IGF1通过BMP2-Smad1/5信号通路调控犬上颌窦黏膜干细胞成骨分化
廖春晖, 李明飞, 叶金梅, 彭伟, 陈松龄
1.广州市妇女儿童医疗中心口腔正畸科,广东 广州(510000); 2.中山大学附属第一医院口腔科,广东 广州(510080)
上颌后牙区骨量不足牙种植目前仍是种植领域的难题[1]。上颌窦底提升术是解决上颌后牙种植区骨量不足的常用的方法,其核心机制是窦底提升术后的空间成骨效应[2]。上颌窦黏膜在窦底提升术后不仅起到天然的生物屏障作用,同时因其本身具有成骨潜能的干细胞,在上颌窦底提升术后空间成骨扮演着重要的作用[3]。现有的研究多关注于上颌窦黏膜干细胞(maxillary sinus membrane stem cells,MSMSCs)的成骨能力,而对其核心的分子调控机制的研究甚少。为明确胰岛素样生长因子1(insulin-like growth factor1,IGF1)参与调控MSMSCs 成骨分化的分子调控机制,本研究拟将构建的IGF1 基因表达重组腺病毒Ad-IGF1 感染上颌窦黏膜干细胞,通过Western blot、免疫组化染色观察在上颌窦黏膜干细胞分化过程中,BMPSmads 通路中重要信号蛋白骨形态形成蛋白2(bone morphogenetic protein2,BMP2)和Smad1/5 的磷酸化水平以及核转位变化情况;利用BMPSmads 通路抑制剂Noggin 和p38MAPK 的通路抑制剂SB203580 处理感染Ad-IGF1 的细胞,观察成骨标志物的表达变化;并观察抑制剂处理感染Ad-IGF1 的细胞后磷酸化Smad1 蛋白表达变化情况。本研究获得中山大学附属第一医院伦理委员会批准。
1 材料与方法
1.1 实验动物和主要试剂
Beagle 犬(高要市康达实验动物科技有限公司),年龄1~2 周岁,体重15~20 kg。胎牛血清(Gibco,美国);中性蛋白酶(Roche,美国);Ⅱ型胶原酶(Gibco,美国);α-MEM 基础培养基(武汉市博士德公司);CD146 磁珠分选试剂盒(Macs,美国);LipofectamineTM2000(Invitrogen,美 国);Trizol Reagent(Invitrogen,美国);DAB 试剂盒(Abcam,英国);荧光定量PCR 检测试剂盒(Takara,日本);兔抗犬Runx2、OPN、p-p38、p-Smad1/5、Smad1/5、BMP2多克隆抗体(Abcam,英国);羊抗兔IgG-HRP(Abcam,英国);图像Pro 5.0 分析系统(Media Cybernetics,美国);茜素红(Thermo Fisher Scientific,美国)。
1.2 犬上颌窦黏膜干细胞的分离与培养
Beagle 犬上颌窦黏膜的取材按本课题组前期报道的方法去采集[3]。使用酶消化法进行细胞的原代培养,培养至70%~80%汇合时传代,按照1∶3 的比例进行传代扩增培养。按照CD146 磁珠分选试剂盒操作方法进行免疫磁珠法分选CD146 阳性细胞,简述如下:单细胞悬液中按4 μL/mL 加入小鼠抗犬CD146 免疫磁珠,混合均匀后置于4 ℃孵育30 min,PBS 润洗2 次,避免干燥。准备磁力架和磁柱,PBS 润洗2 次,把结合了磁珠的细胞悬液放入磁柱中,过柱,PBS 清洗混匀。并取样品滴于载玻片和细胞计数器上,分别进行细胞纯度分析和活力测定。用倒置相差显微镜观察细胞生长情况及细胞形态。
1.3 IGF1 基因表达重组腺病毒Ad-IGF1 载体构建
根据IGF1 基因序列,设计末端带NheI 和HindⅢ的酶切位点的特异性引物,将通过PCR 扩增的IGF1 基因序列克隆到PDC316-mCMV-ZsGreen 载体中,构建PDC316-mCMV-ZsGreen-IGF1 腺病毒载体(图1),即Ad-IGF1 载体。IGF1 引物扩增总长度为462 bp,引物序列设计如下。IGF1-NheI-F:5′-CTAGCTAGCACCATGGGAAAAATCAGCAGTCTTCC-3′;IGF1-HindⅢ-R:5′-CCAAGCTTCTACATTCTGTAGTTCTTGTTTCCTG-3′。
Figure 1 Map of PDC316-mCMV-ZsGreen-IGF1 vector图1 PDC316-mCMV-ZsGreen-IGF1 腺病毒载体示意图
1.3.1 PCR 扩增目的基因 PCR 扩增IGF1,在引物中引入NheI+ HindⅢ酶切位点,按以下组分制备PCR 反应体系:5 × Fastpfu buffer 10 μL,dNTP Mix(2.5 mM)4 μL,正向引物(10 μM)2 μL,反向引物(10 μM)2 μL,Fastpfu polymerase 1 μL,模板DNA(100 ng/μL)1 μL,ddH2O 30 μL,Total 50 μL。按以下条件设置反应程序进行PCR 反应:变性95 ℃×3 min 1 个循环,变性95 ℃,退火55 ℃× 30 s 30 个循环,延伸72 ℃× 2 min,延伸72 ℃× 5 min 1 个循环。琼脂糖凝胶回收目的条带进行分析。
1.3.2 载体质粒PDC316-mCMV-ZsGreen 及目的基因NheI+HindⅢ双酶切 酶切反应在37 ℃水浴反应2 h,载体质粒酶切体系如下:质粒PDC316-mCMVZsGreen/IGF1 1 μg,10×Buffer 2 μL,10×BSA 2 μL,NheI 1 μL,HindⅢ1 μL。分别回收质粒PDC316-mCMV-ZsGreen酶切大片段和目的基因酶切产物。
1.3.3 质粒PDC316-mCMV-ZsGreenNheI+ HindⅢ回收大片段与目的基因连接 连接反应在22 ℃反应2 h,连接反应体系如下:目的基因6 μL,PDC316-mCMV-ZsGreen 2 μL,10 × DNA Ligase Buffer 1 μL,T4 DNA Ligase 1 μL。
1.3.4 连接产物转化 取10 μL 上述连接产物和100 μL JM109 感受态细菌混合均匀后冰浴30 min,在42 ℃下热激45 s,立即放置冰上2 min,放入预热至室温的400 μL 的LB 培养基,在37 ℃恒温摇床培养1 h 后,4 000 rpm 离心1 min,弃400 μL 上清夜,用移液器混匀剩余100 μL 后均匀涂布在含100 μg/mL Ampicillin 抗性LB 板上,在37 ℃恒温培养箱中倒置培养过夜。
1.3.5 重组质粒提取、挑选鉴定及病毒包装 选取4 个单菌落接种于含有100 ug/mL Ampicillin 抗性的5 mL LB 培养液中,250 rpm,在37 ℃恒温摇床培养过夜,使用小量质粒抽提试剂盒提取质粒,经质粒NheI+ HindⅡ双酶切鉴定,克隆并切出462 bp 条带。测序验证鉴定正确的重组克隆。测序引物为:
CMV-F(CGCAAATGGGCGGTAGGCGTG)。PDC316-mCMV-ZsGreen-IGF1 与PDC316-mCMV-ZsGreen 腺病毒病毒包装。用携带有目的基因的重组质粒PDC316-mCMV-ZsGreen、PDC316-mCMV-ZsGreen-IGF1 和骨架质粒共转染HEK293 细胞,获得携有目的基因的腺病毒,然后通过扩增技术获得高滴度的病毒,标记为AD-IGF1,对照病毒为仅携带绿色荧光蛋白(green fluorescent protein,GFP)的AD-GFP。
1.3.6 基因表达重组腺病毒Ad-IGF1 感染效率检测 取对数生长期P3 代MSMSCs,以2.5×105个/瓶接种于到T25 培养瓶中,分为IGF1 感染组(Ad-IGF1)和阴性对照组(Ad-GFP),仅携带GFP 的空载体腺病毒Ad-GFP 作为阴性对照组。在37 ℃,5%CO2α-MEM 基础培养中培养。待细胞贴壁后,将IGF1 基因表达重组腺病毒Ad-IGF1 按感染复数(multiplicity of infection,MOI)为50~200 感 染 细胞,感染细胞后更换α-MEM 成骨诱导培养基培养24 h。每组重复3瓶。24 h后对感染Ad-IGF1和Ad-GFP 的细胞进行显微镜拍照。收集实验组和对照组的细胞,用于qRT-PCR 检测。
1.4 Noggin 或 者SB203580 处 理 感 染Ad-IGF1 的细胞
取感染Ad-IGF1 的P3 代MSMSCs 以1 × 105个/孔接种于6 孔板中,分为Noggin 处理组(Ad-IGF1+Noggin),单纯Ad-IGF1 感染的对照组(Ad-IGF1)以及Ad-IGF1 感染合并α-MEM 培养基培养的空白对照组(Ad-IGF1+ medium)。采用BMP-Smad 依赖特异性抑制剂Noggin,进行功能实验探索IGF1 在MSMSCs 成骨中作用机制。具体细胞处理步骤如下:感染Ad-IGF1 的P3 代MSMSCs 以1 × 105个/孔接种于6 孔板中,37 ℃,5%CO2α-MEM 基础培养基中培养。待细胞贴壁后100 g/mL BMP-Smads 信号通路抑制剂Noggin 或者等体积的α-MEM 培养基预处理细胞1 h,之后更换α-MEM 成骨诱导培养基培养3 d,单纯感染Ad-IGF1 细胞在α-MEM 成骨诱导培养基中培养3 d,并作为对照组,每组重复3 孔。
同上,p38MAPK 特异性抑制剂SB203580 处理及分组和Noggin 处理一致,其预处理浓度为20 uM,分组为单纯Ad-IGF1 感染的对照组(Ad-IGF1)以及SB203580 处理组(Ad-IGF1+SB203580)。
1.5 茜素红染色
为了明确不同实验组(Ad-IGF1、Ad-IGF1+Noggin、Ad-IGF1+ medium)的MSMSCs 钙盐沉积情况,使用茜素红染色进行分析。具体步骤如下:4%的多聚甲醛固定30 min,PBS 漂洗3 次,每次5 min,0.1%的茜素红(pH 7.2)染色10 min,PBS 漂洗后拍照。
1.6 免疫组化染色
细胞爬片收集后,经过固定,透膜和抗原修复后,加入1∶400 的p-Smad1/5 抗体,4 ℃下孵育过夜,1∶500 羊抗兔IgG-HRP 耦联一抗,DAB 显色,苏木素复染,拍照并分析。
1.7 qRT-PCR
Trizol 收集各个时间点各组细胞的RNA,经过萃取,酒精清洗后得到干净的RNA,Nanodrop 测定浓度后,逆转录1 000 ng/样本为cDNA,按照表1 设计引物,其中GAPDH 为内参,定量检测IGF1,Runx2、ALP 和OPN mRNA 表达量。

表1 qRT-PCR 引物序列Table 1 Nucleotide sequences of the qRT-PCR primers
1.8 Western blot 检测
RIPA 收集细胞蛋白,BCA 法测量浓度后,取20 μg 蛋白进行定量,电泳分离不同大小蛋白,使用PVDF 膜进行蛋白转膜,裁剪不同分子量大小的膜,经过封闭,清洗后,孵育一抗(BMP2、Smad1/5、p-Smad1/5、RUNX2、OPN、p-p38)过夜;次日进行清洗,HRP 显影,定量分析。
1.9 统计学方法
实验数据用均数±标准差表示,采用SPSS19.0统计学软件分析,采用独立样本t检验来比较两组差异,采用单因素方差分析比较三组及以上差异。P<0.05 认为差异具有统计学意义。
2 结 果
2.1 IGF1 基因表达重组腺病毒构建及感染效率
在AD-IGF1 和AD-GFP 包装第1 天,通过荧光显微镜观察HEK293 细胞内可见绿色荧光,呈满天星状分布,包装第9 天,呈彗星状分布,说明IGF1和GFP 基因表达腺病毒包装过程顺利(图2a)。同时经凝胶电泳检测示质粒酶切后的两个产物均为阳性克隆,产物大小为462 bp 的IGF1 目的基因条带(图2b)。MSMSCs 感染携带有绿色荧光蛋白的AD-IGF1 和AD-GFP 后,免疫荧光检测细胞形态没有明显改变,仍然呈多角形或长梭形,细胞质中可见绿色荧光信号(图2c、2d)。MSMSCs 细胞感染Ad-IGF1 培养24 h 后IGF1 mRNA 表达量明显升高,较感染AD-GFP 组升高了5 倍,两组间表达量差异有统计学意义(图2e)。
2.2 MSMSCs 的IGF1 上调促进磷 酸 化Smad1/5 核转位,并呈时间和剂量依赖性正向调控BMP2 及磷酸化Smad1/5 的表达
通过免疫组化结果显示,感染Ad-IGF1 的MSMSCs 高表达磷酸化Smad1/5,表达部位主要位于胞核,部分胞浆亦可见表达;感染Ad-GFP 细胞的胞核和胞浆不表达或低表达磷酸化Smad1/5,空白对照不表达(图3a~3c)。进一步通过使用不同浓度的Ad-IGF1(MOI 50-100、150-200、250-300)作用于MSMSCs。细胞成骨诱导3 d 后,基于免疫印迹实验发现,与Ad-GFP 阴性对照组相比,BMP2 蛋白表达逐渐增强,且随着Ad-IGF1 滴度增加呈梯度上升,各实验组与对照组相比,差异均有统计学意义(图3d)。Smad1/5 总蛋白量无变化,而Smad1/5磷酸化(p-Smad1/5)水平增高,且随着Ad-IGF1 滴度增加呈梯度上升,各实验组与对照组相比,差异均有统计学意义(图3e)。同时观察了不同时间点(3 h、6 h、12 h、24 h、48 h)的BMP2 和p-Smad1/5 的动态变化。与0 h 组相比,BMP2 蛋白水平呈时间依赖性增强趋势,在24 h 时达到高峰,48 h 后表达开始轻微减弱,但48 h 组仍高于0 h 组(图3f)。Smad1/5 总蛋白量无变化,Smadl/5 的磷酸化水平在12 h 时达到高峰,24 h 后表达轻微减弱,但24 h 和48 h 组仍高于0 h 组(图3g)。
2.3 IGF1 依赖BMP-Smad 信号通路而非p38MAPK信号通路调控MSMSCs 的成骨分化
为了进一步探索IGF1 介导MSMSCs 的成骨分化的内在核心机制,首先使用BMP-Smads 信号通路抑制剂Noggin 处理Ad-IGF1 感染的MSMSCs,成骨诱导培养3 d,发现磷酸化Smad1/5 水平降低明显,与单纯感染Ad-IGF1 的对照组相比,两组间表达量差异有统计学意义(图4a)。并且成骨相关的标志物Runx2、OPN 和ALP mRNA 表达量降低明显,与对照组相比,各组间mRNA 表达量差异有统计学意义(图4b)。更重要的是,茜素红染色结果表明单纯感染Ad-IGF1 的细胞α-MEM 成骨诱导培养基中培养28 d 后,有大量染为红色的矿化结节形成;Noggin 处理Ad-IGF1 感染的MSMSCs 后,成骨诱导培养28 d 也有矿化结节形成,但矿化结节明显 减少;Medium 处 理Ad-IGF1 感 染的MSMSCs 后(空白对照),其矿化结节量和单纯感染Ad-IGF1 类似(图4c~4e)。然后验证BMP-非Smads 信号通路在IGF1 调控MSMSCs 成骨的作用。采用p38MAPK信号通路抑制剂SB203580 处理Ad-IGF1 感染的MSMSCs 成骨诱导培养3 d 后,p38 磷酸化水平与单纯感染Ad-IGF1 的对照组相比,两组间表达量差异无统计学意义(图4f)。并且成骨相关的标志物Runx2、OPN 和ALP mRNA 表达量与单纯感染Ad-IGF1 的对照组相比变化不明显(图4g)。这结果提示IGF1 主要通过BMP-Smads 信号通路调控MSMSCs成骨分化效应。

Figure 2 Restriction of the AD-IGF1 gene and its infection efficiency图2 IGF1 基因表达重组腺病毒构建及感染效率
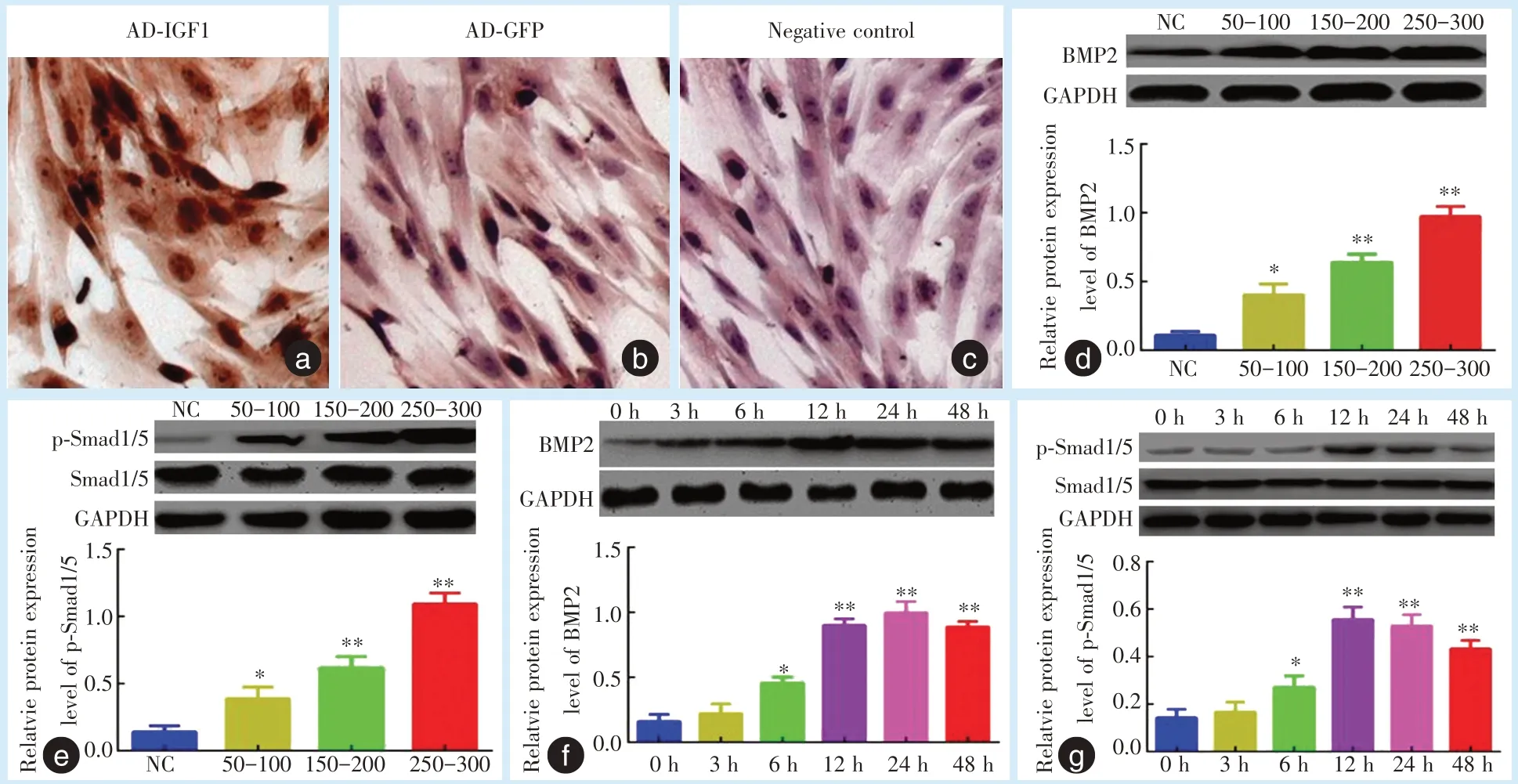
Figure 3 Upregulation of IGF1 promotes p-Smad1/5 protein nuclear translocation and positively regulates BMP2 and p-Smad1/5 protein expression in MSMSCs in a time-and dose-dependent manner图3 MSMSCs 中IGF1 上调促进p-Smad1/5 核转位,并呈时间和剂量依赖性正向调控BMP2 及p-Smad1/5 的表达

Figure 4 IGF1 depends on the BMP-Smad but not the p38MAPK signaling pathway to regulate MSMSCs osteogenic differentiation图4 IGF1 依赖BMP-Smad 信号通路而非p38MAPK 信号通路调控MSMSCs 的成骨分化
3 讨 论
上颌窦黏膜干细胞是一类具有成骨潜能的上颌窦黏膜来源的细胞,在上颌窦底提升术后空间成骨及维持黏膜内稳态中扮演重要作用[4]。IGF1是一种具有内分泌和旁分泌特性的多功能肽,通过与细胞表面的IGF1 受体结合来激活受体的酪氨酸激酶活性,然后使受体-配体复合物发生内化并激活信号反应来调节细胞生长、分化和细胞外基质中多种因子的表达[5-6]。课题组在前期研究工作中发现IGF1 上调可以促进上颌窦黏膜干细胞的碱性磷酸酶、RUNX2 和OPN 的表达,正向参与上颌窦黏膜干细胞的成骨分化效应,然而IGF1 内在的成骨调控通路未进行深入探讨[7]。在骨髓间充质干细胞成骨向分化过程中,有研究表明BMP2 刺激细胞成骨分化的功能需依赖于IGF1 激活相关信号通路如PI3K/AKT 或MAPK 信号通路[8]。而BMP2 为骨基质中存在的重要骨生长因子,可通过与细胞膜上I 型和Ⅱ型受体结合,激活下游信号蛋白Smad1 或Smad5 蛋白质羧基末端,从而磷酸化Smad1/5,磷酸化的Smad1/5 与Smad4 结合,形成复合物后由胞浆进行核转位,在核内蓄积后直接作用于下游的靶基因,或与其它转录调节因子一起调控下游靶基因[9-10]。因此课题组推测IGF1 是否可以在细胞成骨分化过程中激活BMP-Smads 信号转导通路调控上颌窦黏膜干细胞的成骨效应。
为了揭示IGF1 和BMP2-Smads 的关系,本研究采用PDC316-mCMV-ZsGreen-IGF1 载体构建重组腺病毒Ad-IGF1,经测序证明载体所连序列正确。然后以不同滴度的Ad-IGF1(50-100、150-200、250-300)作用于上颌窦黏膜干细胞成骨诱导培养24 h后,通过Western blot 检测发现,BMP2 蛋白表达逐渐增强,且随着Ad-IGF1 滴度增加呈梯度上升,Smad1/5 蛋白被激活,磷酸化水平逐渐升高。并且在不同时间点检测BMP2 蛋白水平和磷酸化Smad1/5 水平变化,有趣的是,IGF1 可呈浓度和时间依赖性上调BMP2 表达和Smad1/5 活性。免疫组化结果也证实IGF1 可以促使磷酸化Smad1/5 从上颌窦黏膜干细胞的胞浆转移到核内。随后,为进一步探讨BMP-Smads 信号在IGF1 介导的促上颌窦黏膜干细胞成骨分化中的作用,采用Noggin 进行BMP-Smads 信号抑制。Noggin 是BMP-Smads 信号通路的直接抑制剂,其结构上存在典型的“胱氨酸结”结构域,线性排列的Noggin 二聚体同呈蝴蝶形的BMP 二聚体结合,形成一个较大的戒指样结构,能够有效地屏蔽BMP 上的受体结合位点,抑制BMP 受体的激活和下游靶蛋白的磷酸化[11-13]。使用Noggin 处理Ad-IGF1 感染的细胞后,再对细胞进行成骨诱导分化,发现与单纯感染Ad-IGF1 组相比,磷酸化Smad1/5 蛋白表达量明显降低,成骨相关标志物Runx2、OPN 和ALP mRNA 表达量降低明显,矿化结节明显减少。说明BMP-Smads 信号通路是IGF1 活化成骨效应不可或缺的。据此,本实验研究结果表明IGF1 可通过BMP2-Smad1/5 信号通路,促进BMP2 的表达并诱导细胞内Smad1/5 磷酸化和核转位机制,调控上颌窦黏膜干细胞成骨分化效应。
随着对BMPs 信号通路研究增加,逐渐明确BMPs 通路可分为2 种:一种是Smads 蛋白依赖性信号转导通路,这种信号传导通路需通过经典的Smads 信号分子传递信号;另外一种是Smads 蛋白非依赖性信号转导通路,这种信号传导通路不直接依赖转录因子Smads 的激活[14-16]。更重要的是,在成骨机制研究中证实细胞成骨分化除了依赖经典的BMP-Smads 信号转导通路外,也可通过Smads蛋白非依赖性信号通路(如MAPK、PI3K 等)进行信号传导[17-18]。其中p38MAPK 是其中一条重要的通路,可以通过胞外信号激活MAPK,继而激活MKK3/MKK6,再激活p-p38 来调控信号转导过程[19]。现有的研究发现p38MAPK 信号转导可激活相关的转录因子,引起细胞增殖、分化,参与细胞的应激反应和介导细胞的骨架重构等一系列生物学效应,在成骨细胞分化中具有重要的调控作用[20-21]。然而p38MAPK 信号通路是否能在IGF1 介导下调控上颌窦黏膜干细胞的成骨效应尚不明确。
基于此,本研究进一步探讨p38MAPK 信号通路是否参与IGF1 介导的上颌窦黏膜干细胞成骨分化进程。 使用p38MAPK 信号通路抑制剂SB203580进行功能实验。SB203580,4-(4 氟苯基)-2-(4-甲基亚磺酰苯基)-5-(4-吡啶基)-咪唑,一种药理的化学合成物,可以抑制p38MAPK 对MAPK/APK-2 的激活以及后续磷酸化的级联反应,是p38MAPK 的选择性抑制剂[22]。SB203580 处理Ad-IGF1 感染的细胞后成骨诱导培养3 d,与单纯感染Ad-IGF1 的对照组相比,磷酸化p38 水平无明显变化,成骨标志物Runx2、OPN 和ALP mRNA 表达水平亦无明显变化,实验结果提示p38MAPK 信号通路可能在IGF1 介导的促上颌窦黏膜干细胞成骨分化过程中并不发挥作用。SB203580 抑制效果在上颌窦黏膜干细胞中p-p38 及成骨基因变化不明显的原因可能是因为:①SB203580 通过与ATP 结合区连接来抑制p38MAPK 的催化活性,但是不能抑制上游激酶对p38MAPK 的磷酸化[23],因此p-p38 的表达变化不明显;②p38MAPK 信号通路在炎症调节及发生发展中具有重要意义,其可能在上颌窦黏膜干细胞成骨分化中,其成骨效应作用甚微,从而成骨基因变化不明显;③不排除在上颌窦黏膜干细胞成骨分化进程中存在p38 竞争性结合因子,从而影响了抑制剂本身的药物机理。实验结果较倾向于p38MAPK 可能在IGF1 介导的上颌窦黏膜干细胞成骨过程中并不是主导的信号调节通路。
总之,上颌窦黏膜干细胞成骨分化过程中,IGF1 通过经典的Smads 蛋白依赖性信号转导通路BMP2-Smad1/5 促进成骨,而Smads 蛋白非依赖性信号转导通路p38MAPK 在IGF1 介导的上颌窦黏膜干细胞成骨过程中可能并不发挥作用。

