Matrilin-4对大鼠牙髓损伤后修复性牙本质形成的促进作用
谢金芳,孟 琳,高华丽,李雪洋,胡 雪,张颖丽,尹 硕
(1.吉林大学口腔医院综合口腔治疗科, 吉林 长春 130021; 2. 吉林大学口腔医院病理科, 吉林 长春 130021;3. 吉林大学口腔医院牙体牙髓科, 吉林 长春 130021;4.吉林省长春市口腔医院修复科, 吉林 长春 130022)
牙本质与牙髓一起构成牙髓-牙本质复合体,在保护和滋养整个牙齿方面起着至关重要的作用。牙髓-牙本质复合体的活力极大地影响牙齿的存活和预后[1-2]。一方面,完整的牙本质为牙髓提供了相对封闭的环境,保护牙髓免受细菌侵入和其他物理或化学刺激。当牙本质受损时,刺激物可通过牙本质小管或暴露的牙髓引发牙髓炎症。另一方面,牙髓可通过成牙本质细胞和细胞突提供氧气、营养物质以及牙本质液来维持牙本质的活力,以保持其矿化程度。龋病、创伤和医源性损伤均可使牙本质损伤甚至牙髓暴露,导致牙齿支撑力降低、牙髓炎、牙髓坏死,最终可能导致牙齿折裂甚至牙齿脱落[3]。因此,在牙髓暴露的处理中,牙本质再生和牙髓活力保持尤为关键[4]。
Matrilin-4是非胶原性细胞外基质蛋白家族的一员。研究[5]显示:Matrilin-4在健康牙髓组织成牙本质细胞层呈阳性表达,而在深龋牙髓组织中,在龋损下方的成牙本质细胞层及相邻牙髓细胞中可见其阳性表达。推测Matrilin-4可能是牙髓干细胞向成牙本质细胞分化的标志,可能与修复性牙本质的形成有关[6-7],但将Matrilin-4作为盖髓剂应用于大鼠牙齿的治疗尚未见报道。本研究通过构建大鼠牙髓机械性损伤的模型,将Matrilin-4作为盖髓剂置于牙髓暴露断面,以牙本质涎蛋白(dentin sialoprotein,DSP)作为修复性牙本质形成的特异性标志物[8],观察Matrilin-4盖髓后成牙本质细胞中DSP的表达情况,探讨Matrilin-4在修复性牙本质形成过程中的作用。
1 材料与方法
1.1 实验动物、主要试剂和仪器 8周龄清洁级雄性Wistar大鼠28只,体质量180~220 g,吉林大学动物中心提供,动物许可证号:SCXK(吉)2015-0001。水合氯醛、EDTA溶液、4%多聚甲醛和生理盐水(北京恒业中远化工有限公司),DSP多克隆抗体(英国Biorbyt公司),EDTA抗原修复液、兔S-P试剂盒和DAB显色试剂盒(北京中杉金桥生物科技有限公司)。胶原蛋白海绵(吉林大学口腔颌面外科提供),富士Ⅸ玻璃离子(吉林大学口腔医院提供),Matrilin-4(美国Sigma公司)。1/4 钨钢球钻和高速涡轮机(上海医用器械设备厂),BX71显微镜和照相系统(日本OLYMPUS公司),自制开口器。
1.2 实验动物分组和标本制备 28只Wistar大鼠称体质量,适应性饲养1周后,用3%水合氯醛腹腔注射麻醉(3.5 mL·kg-1),仰卧位,固定四肢于手术板上。2% 碘伏溶液消毒口腔,分别于每只大鼠双侧上颌第一磨牙用1/4球钻在颌面中央备洞,透粉时停止操作,探针穿髓,生理盐水冲洗。无菌棉球压迫止血并干燥窝洞后,左侧露髓处放置含Matrilin-4的胶原蛋白海绵(Matrilin-4组),右侧露髓处放置含PBS的胶原蛋白海绵盖髓(PBS组),双侧均用玻璃离子充填窝洞。以上所有操作均由同一名临床经验丰富的医生独立完成。分别于盖髓术后 3、7、14和28 d心脏灌流固定处死大鼠各7只,迅速分离各大鼠的上颌骨并制备包含双侧上颌第一磨牙的骨组织块。然后将各组骨组织块置于新配置的4%多聚甲醛中,常温固定48 h后置于100 g·L-1EDTA(pH值为7.4)溶液中脱钙12周。梯度乙醇脱水、二甲苯透明、常规石蜡包埋后,平行于牙体长轴方向行近、远中向连续切片(厚度为5 μm)。
1.3 HE 染色观察大鼠牙髓组织形态表现 取上述各组大鼠牙体组织切片常规脱蜡至水,分别经苏木素染色10 min,流水冲洗;1%盐酸乙醇分化1~3 s,流水冲洗;氨水返蓝5~10 s,0.5%伊红溶液染色5 min,流水冲洗 5 min;梯度乙醇脱水、二甲苯透明、中性树胶封片。在显微镜下观察各组大鼠修复性牙本质的形成情况并采集图像。
1.4 免疫组织化学染色检测大鼠牙本质细胞中DSP阳性表达强度 取上述各组大鼠组织切片脱蜡至水,用PBS洗涤并擦干组织周围的多余水分后,微波抗原修复后自然冷却30 min后流水冲洗冷却至室温,PBS缓冲液冲洗3 min×3次;滴加内源性过氧化物酶阻断剂室温孵育10 min,PBS缓冲液冲洗3 min×3次;滴加封闭用正常山羊血清工作液,室温孵育15 min,倾去血清,不洗;滴加稀释的DSP抗体(1∶100), 4℃湿盒过夜;次日37℃复温 45 min,PBS缓冲液冲洗3 min×3次;滴加生物素标记山羊抗兔IgG室温孵育15 min,PBS缓冲液冲洗3 min×3次;滴加辣根酶标记链霉卵白素工作液室温孵育15min,PBS缓冲液冲洗3 min×3次;DAB显色;苏木素轻度复染3 min、流水冲洗、分化、返蓝、梯度乙醇水化后、二甲苯透明、中性树胶封片;显微镜下观察DSP表达情况并拍照。在高倍镜下从每张切片的DSP染色阳性区各随机选取3个不重叠区域,用Image-Pro Plus 6.0 软件检测其阳性区的吸光度(A)值,取均值代表DSP阳性表达强度。
2 结 果
2.1 各组大鼠牙髓组织HE 染色结果 3 d时,PBS组大鼠穿髓孔下方有炎症细胞聚集,并可见扩张的血管,穿髓处散在分布牙本质碎屑;Matrilin-4组大鼠牙体组织穿髓孔下方有少量炎症细胞聚集,并可见明显扩张的血管,未见明显的前期牙本质形成。7 d时,PBS组大鼠穿髓孔下方炎症反应加重,大量炎症细胞聚集并向髓腔方向浸润,可见少量前期牙本质形成;Matrilin-4组大鼠穿髓孔下方炎症反应较3 d时加重,血管扩张明显,成牙本质细胞层及牙本质之间可见前期牙本质。14 d时,PBS组大鼠穿髓孔下方炎症细胞密集及纤维组织增生,可见前期牙本质不均匀增厚而形成修复性牙本质,但未封闭暴露的牙髓组织;Matrilin-4组大鼠穿髓孔下方可见较连续完整的修复性牙本质桥形成,覆盖露髓区域,但修复性牙本质桥之间可见隧道缺陷,牙髓组织中无明显炎细胞浸润。28 d时,PBS组大鼠穿髓孔下方可见一定量修复性牙本质形成,髓室内大量炎症细胞浸润呈变性坏死表现 ;Matrilin-4组大鼠穿髓孔下方连续完整的修复性牙本质桥较14 d时增厚,牙本质桥下面有重组的成牙本质细胞层,无明显炎症细胞浸润,牙髓形态正常。见图1(插页五)。
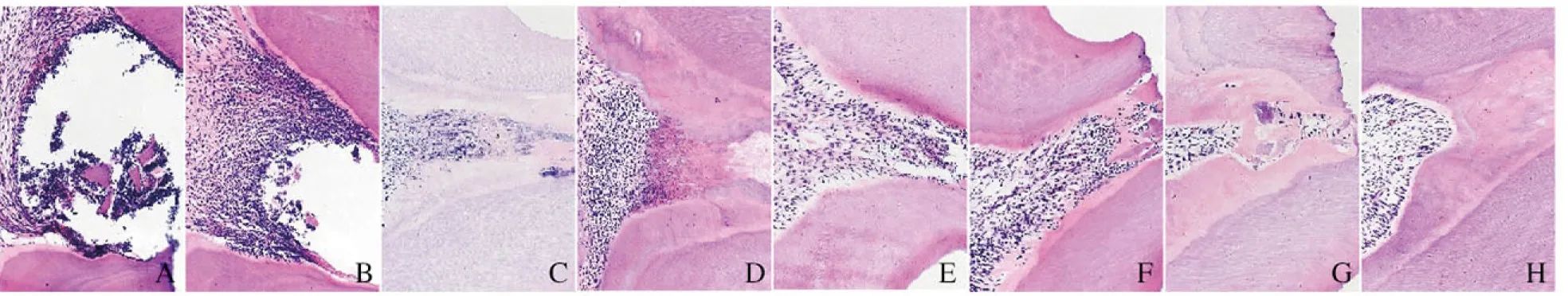
A-D: PBS group; E-H: Matrilin-4 group; A,E: 3 d; B,F: 7 d; C,G: 14 d; D,H: 28 d.
图1 不同时间各组大鼠牙髓组织形态表现(HE,×200)
Fig.1 Morphology of pulp tissue of rats in various groups at different time(HE,×200)
2.2 各组大鼠成牙本质细胞中DSP阳性表达强度 3 d时,PBS组大鼠穿髓孔下方的成牙本质细胞无明显DSP阳性表达;Matrilin-4组大鼠穿髓孔下方的成牙本质细胞DSP呈弱阳性表达。7 d时,PBS组大鼠穿髓孔下方的成牙本质细胞DSP呈弱阳性表达;Matrilin-4组大鼠穿髓孔下方的成牙本质细胞DSP呈阳性表达,强度高于3 d时。14 d时,PBS组大鼠穿髓孔下方的成牙本质细胞DSP呈阳性表达,但其强度较同时段Matrilin-4组弱;Matrilin-4组大鼠穿髓孔下方的成牙本质细胞DSP呈强阳性表达,此时阳性表达达高峰。28 d时,PBS组大鼠穿髓孔下方的成牙本质细胞DSP呈弱阳性表达,其强度较同时段Matrilin-4组弱;Matrilin-4组大鼠穿髓孔下方的成牙本质细胞DSP呈弱阳性表达。见图2(插页五)。
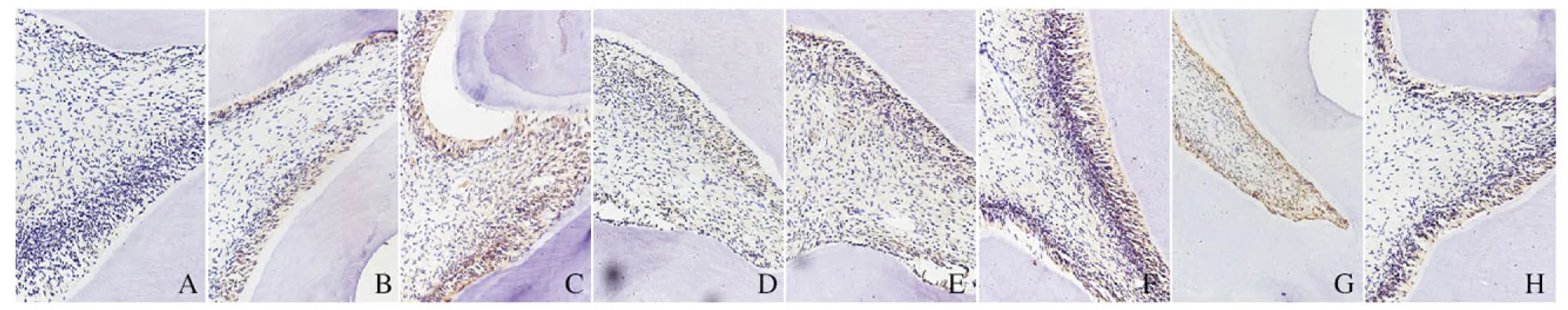
A-D: PBS group ;E-H: Matrilin-4 group; A,E: 3 d; B,F: 7 d; C,G: 14 d; D,H: 28 d.
图2 不同时间各组大鼠成牙本质细胞中DSP表达情况(免疫组织化学, ×200)
Fig.2 Expressions of DSP in odontoblasts of rats in various groups at different time(Immunohistochemistry,×200)
与PBS组比较, 实验 3、7和14 d时Matrilin-4组大鼠牙髓组织中DSP阳性表达强度明显升高(P<0.01),28 d 时差异无统计学意义(P>0.05)。见表1。
3 讨 论
牙髓作为牙组织中唯一的软组织,具有形成、营养、感觉和防御功能,其对维持牙体组织的强度发挥重要的作用。外伤性或机械性刺激等均可造成牙髓暴露,不能及时有效的治疗终将导致牙髓感染、坏死甚至根尖周炎等不可逆性损伤。一旦牙髓坏死,牙本质就无法获得供应并逐渐变脆,从而导
表1 不同时间各组大鼠成牙本质细胞中DSP阳性表达强度Tab.1 Positive expression strengths of DSP in odontoblasts in two groups at different time
*P<0.01 compared with PBS group.
致牙齿折裂或牙冠变色[9]。尤其对根尖未发育完成的年轻恒牙,保存其牙髓活性可促进牙根继续发育及生理性牙本质的形成[10]。直接盖髓术作为牙髓暴露的重要治疗方法,需要对暴露的牙髓组织充分保护而不损伤其活力和功能[11-12],并刺激牙髓细胞分化为成牙本质样细胞,促进受损的牙髓愈合及形成修复性牙本质[13]。氢氧化钙作为最常用的盖髓剂,可成功诱导硬组织屏障和反应性牙本质形成[4],但其修复性牙本质桥可出现明显的隧道缺陷,渗透性差,易受细菌重新定植,最终可能导致牙髓治疗失败[14]。三氧化钙无机聚合物(mineral trioxide aggregate, MTA)因其良好的封闭性及生物性能成为近年来被广泛应用于活髓保存治疗中[15],但其临床操作较困难且治疗后引起牙冠变色[16-20]。有研究[21]表明:MTA因释放较高浓度有害金属离子,具有潜在细胞毒性。Marilin-4广泛分布于疏松和致密结缔组织、皮肤、消化道上皮组织、骨、软骨、血管壁和神经系统[7],新生小鼠切牙始基、人牙髓细胞和深龋成牙本质细胞中也存在Matrilin-4的表达[8]。推测Marilin-4可能与牙本质形成有关,本实验将Marilin-4作为盖髓剂用于大鼠机械性牙髓损伤的治疗,并以 PBS作为对照,观察Marilin-4及PBS盖髓后牙髓组织的炎症反应、修复性牙本质的形成及成牙本质细胞中DSP的表达情况,以探讨Marilin-4作为新型盖髓剂的可行性。本研究中HE染色结果显示:3 d时PBS组大鼠穿髓孔下方有炎症细胞聚集及扩张的血管,7 d时穿髓孔下方炎症反应加重且向髓腔方向浸润,可见少量前期牙本质形成,14 d时可见修复性牙本质的形成,28 d时虽有一定量修复性牙本质形成,但髓室内大量炎症细胞浸润呈变性坏死表现;Matrilin-4组大鼠3 d时穿髓孔下方有少量炎症细胞聚集,并可见明显扩张的血管,14 d时穿髓孔下方可见连续完整的修复性牙本质桥形成,无明显炎症细胞浸润。由此可推测Marilin-4具有一定的抗炎作用,可以促进血管再生及修复性牙本质的形成。本研究中免疫组织化学染色结果显示:3 d时Marilin-4组大鼠成牙本质细胞中DSP呈弱阳性表达,随后逐渐增强并于盖髓后14 d达到最高峰, 28 d 时DSP阳性表达强度减弱,且盖髓后各时间段DSP阳性表达均强于PBS组;与 PBS 组比较, Marilin-4组大鼠在 3、7、14 d 时DSP阳性表达强度明显升高,术后 28 d 时DSP阳性表达强度差异无统计学意义。本研究结果提示:Marilin-4可增强成牙本质细胞和牙髓细胞的活跃性,调节成牙本质细胞样细胞[22],促进修复性牙本质的形成,推测Marilin-4可作为一种良好的盖髓剂。
综上所述, 将Marilin-4作为盖髓剂用于大鼠机械性损伤的露髓处,在一定程度上可增强成牙本质细胞的活跃性并促进修复性牙本质的形成。Marilin-4可以作为一种良好的盖髓剂,与氢氧化钙和MTA等盖髓剂联合应用于临床,改善现有的盖髓剂的不足之处,本研究为开发新的盖髓剂提供了理论依据。

