HTK液3种不同灌注方法对兔心脏保存移植后心肌组织ICAM和IL-17表达的影响
韦雪梅,郭义龙,徐志新
供体心脏通常需要经过一定时间的保存才能进行移植,此时离体心脏的保存技术可能对受体心脏发生缺血再灌注损伤和急性排斥反应产生重要影响[1]。再灌注损伤和急性排斥反应也是导致心脏移植失败、受体心脏复跳欠佳和失能的主要机制[2-3]。低温和HTK停搏保护液是目前应用最成熟的离体心脏保存技术,可显著降低心肌能耗,保护心肌功能[4]。其中HTK液单纯低温浸泡应用最广泛,简单、安全,缺点是不能及时清除停搏期间心肌组织代谢产物和氧自由基,补充心肌代谢需要,导致钙超载、细胞水肿、炎症反应、氧化应激、免疫损伤等[5]。研究发现[6-7],持续灌注或间断2 h灌注可明显改善复跳效果,降低心律失常和心肌损伤风险,提高受体心脏存活率。细胞间黏附分子(intercellular adhesion molecule, ICAM)-1和白细胞介素(interleukin, IL)-17的表达在同种异体心脏移植早期再灌注损伤和急性排斥反应过程中表达明显上调,可能参与受体心脏存活和功能恢复过程[8-9]。既往关于HTK液不同灌注方式对移植心脏受体心肌免疫损伤和炎症反应的研究较少,因此,该研究通过比较HTK液3种不同灌注方法对同种异体兔心保存移植后心肌组织ICAM-1和IL-17表达的影响,探讨HTK液灌注方式对心脏移植后急性排斥反应的影响机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 18对36只2个月大小雌雄不限的健康新西兰兔购于长沙市天勤生物技术有限公司,供受体配对,平均体质量(2.15±0.33)kg,合格证号43006700016096数量10只,合格证号43006700016142数量10只,合格证号43006700016249数量16只。由我院动物实验中心购买和饲养,饲养环境:通风透气,除添水、添料、清扫卫生和观察健康的时间外,兔舍内均保持黑暗。兔舍温度保持25 ℃左右,湿度55%~65%。
1.1.2实验试剂与仪器 HTK灌注液和KH缓冲液(德国科勒化学制药公司),TRIzol提取试剂和反转录试剂(美国Sigma公司),HE染色试剂和ECL显色液(南京碧云天有限公司),BCA蛋白提取试剂(美国Invitrogen 公司),鼠抗兔ICAM-1、IL-17和GAPDH一抗和二抗(美国R&D公司),TUNEL试剂(美国Santa Cruz公司)。显微外科手术器械(上海医用器械厂),离体心脏灌流系统(上海奥尔科特生物公司)。
1.2 实验方法18对实验兔随机抓取分为3组,分别是单纯低温浸泡组(单纯组)5对、持续灌注组(持续组)5对和间断2 h灌注组(间断组)8对。腹腔注射戊巴比妥钠麻醉,气管插管人工呼吸,静脉肝素化,开胸阻断主动脉,灌注HTK保护液,剪断上下腔静脉及肺动脉充分引流,离体取出心脏,经主动脉根部灌注HTK停跳液保护心脏,悬挂于Langendorff灌注模型上。首先对离体心脏进行平衡灌注,采用KH缓冲液(37 ℃、pH 7.4)经95% O2+5% CO2预处理,灌注压力为7.35 kPa,5~10 min后心脏搏动处于稳定状态,然后进行停跳灌注。单纯组灌注HTK保护液(4 ℃、5~6 ml)后静置保存,间断组间隔2 h灌注HTK保护液(30 ml/kg),持续组采用微量泵,灌注速度0.025 ml/(g·h);处理完成后于4 ℃保存8 h。建立移植心脏模型参照改良Ono术式[10],即分别将供心升主动脉与受体腹主动脉端端吻合,供心肺动脉与受体下腔静脉吻合,建立在体动静脉循环。
对心脏移植供、受体进行血型、HLA抗原、淋巴细胞毒及群体反应性抗体等检测,采用氨基酸三联体及交叉反应方法对供、受者匹配程度进行评价。
1.3 观察指标与检测方法根据改良Ono术式完成心脏移植模型,取出供体心脏。常规制作心肌切片,厚度5 μm,石蜡包埋,用于HE染色观察组织和细胞的病理改变;分别采用实时定量RT-PCR和蛋白印迹法检测组织ICAM-1和IL-17水平,TUNEL试剂检测细胞凋亡率。
TUNEL检测细胞凋亡主要步骤:石蜡切片经脱蜡、水化、H2O2封闭抗体、蛋白酶消化、缓冲液保湿等处理后;根据说明书提示,首先取出Td T和DIG-d-UTP各1 μl,与缓冲液混匀,湿盒内37 ℃反应2 h;洗涤后滴加生物素-抗地高辛抗体反应30 min,洗涤后滴加SABC反应30 min,DAB显色。凋亡细胞的判断以胞核中出现棕黄色颗粒为阳性,凋亡率计算方法:每例标本随机挑选5张切片,每张切片随机挑选4个高倍镜视野(400×)人工计数,凋亡细胞占所有视野下细胞百分比即凋亡率,取平均值。
RT-PCR法主要步骤:根据试剂操作提示提取总RNA,测定浓度和纯度,合成cDNA;由专业生物公司设计目的引物序列,ICAM-1:(F)5′-GGAATTGGAGGAGAGCA-3′,(R)5′-ACAGATCCTCAATCTT-3′,123 bp;IL-17:(F)5′-AACGGCTCTTGGCT-3′,(R)5′-GTTAAGGCAGACCGCA-3′,252 bp;GAPDH:(F):5′-CGAGCCGATGACAG-3′,(R):5′-GCTGTGCGCGTAT-3′, 69 bp。PCR扩增体系为Master Mix 10 μl+上下游引物各0.5 μl+cDNA模板1 μl,加反应水至20 μl。扩增条件为95 ℃、5 min,(95 ℃、25 s、60 ℃、30 s)共30个循环,60 ℃、40 s终止反应,电泳扩增产物,获得融解曲线,系统软件自动计算Ct值,结果以2-△△Ct法表示。
Western blot主要步骤:加入细胞裂解液,提取总蛋白,BCA法测定蛋白浓度,参照蛋白GAPDH作标准化处理;各组分别取30 μg样品蛋白,经8% SDS-PAGE上样加热,分离电泳并转移至PVDF膜,摇床室温封闭;洗涤后滴加鼠抗兔ICAM-1、IL-17和GAPDH抗体(1 ∶2 000)静置过夜,洗涤后滴加辣根过氧化物酶标记羊抗鼠二抗(1 ∶500)室温孵育4 h,ECL显色,结果行半定量分析。
1.4 统计学处理以SPSS 20.0统计软件对计量资料作单因素方差分析,组间两两比较采用LSD-t法检验,3组间比较采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组HE染色结果比较HE染色发现,3组大部分心肌组织结构完整,伴细胞水肿、黏液样变性或坏死、炎性细胞浸润、脂肪化生及小血管生成。见图1。半定量分析发现,间断组细胞水肿、炎性细胞和小血管数目明显少于持续组,单纯组最多(P<0.05)。见表1。
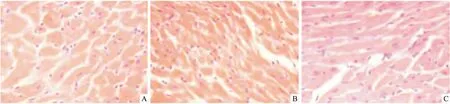
图1 HE染色观察各组心肌组织的病理改变 ×200
表1 HE染色半定量分析各组心肌组织的
与单纯组比较:aP<0.05;与持续组比较:bP<0.05
2.2 各组心肌组织ICAM-1和IL-17 mRNAs和蛋白表达水平的比较间断组ICAM-1和IL-17 mRNAs和蛋白表达水平显著低于持续组,单纯组最高(P<0.05)。见表2、图2。

表2 各组心肌组织ICAM-1和IL-17 mRNAs和
与单纯组比较:aP<0.05;与持续组比较:bP<0.05
2.3 各组心肌细胞凋亡率的比较间断组细胞凋亡率低于持续组,单纯组最高(P<0.05)。见图3、4。
3 讨论
临床和实验中需要挑选最佳的心脏停搏保护液,其中HTK液单次低温灌注可实现较低的心脏基础代谢,提供必要的心肌代谢底物和氧气,不增加心肌损伤和心脏移植后的功能障碍,而且易制备、操作简单、安全性高。良好的供体心脏保存技术是移植心脏得以存活的重要环节。HTK液灌注不仅持续提供停搏期间心肌代谢需要的营养物质和氧气,同时可及时清除代谢产物,减轻酸碱失衡、细胞水肿、氧化功能障碍、炎症反应等损伤[10]。该研究提出HTK液不同灌注方式可能对受体移植心脏的再灌注损伤和急性排斥反应可能产生不同的影响,进而影响心脏复跳后的功能恢复。
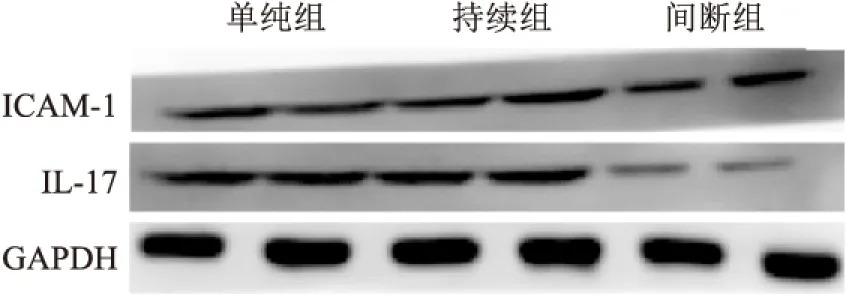
图2 Western blot法半定量比较各组心肌组织ICAM-1和IL-17蛋白表达水平 ×200
本研究显示,3组大部分心肌组织结构完整,伴细胞水肿、黏液样变性或坏死,炎性细胞浸润、脂肪化生及小血管生成。提示停跳期间心肌细胞保持低水平的能量代谢,离体对心肌细胞产生一定的影响,如无氧糖酵解、细胞肿胀、钙超载、氧自由基产生过多、炎性细胞浸润、新生血管等。半定量分析表明,间断组细胞水肿、炎性细胞和小血管数目明显少于持续组,单纯组最多。提示间断灌注对心肌损伤程度较轻。进一步研究显示,间断组ICAM-1和IL-17 mRNAs和蛋白表达水平显著低于持续组,单纯组最高。急性排斥反应是移植心脏较常见的并发症,也是受体心脏复跳失败和失能以及慢性排斥反应的重要原因。ICAM-1主要识别白细胞表面的特定结构,具有高度特异性,进而趋化白细胞、淋巴细胞聚集,发挥杀伤外源性分子,介导细胞间黏附功能,在免疫反应、肿瘤转移等多种生物行为中扮演重要角色[11]。在移植物免疫排斥反应中,受体器官可高表达ICAM-1,与排斥反应时间相一致,其升高水平与细胞毒性T淋巴细胞的功能活化程度密切相关[12]。此外,ICAM-1可协同抗原呈递细胞共同识别异源性分子,激活细胞和体液免疫反应。具体反应过程是在免疫识别阶段,ICAM-1强化辅助性T细胞和抗原提呈细胞的黏附、聚集活性,趋化有活性T细胞向移植物内皮细胞黏附,增加内皮细胞损伤,增加血管壁通透性,释放多种细胞因子和炎症介质,如IL-17、TNF-α[13];免疫效应阶段主要强化毒性T细胞与移植物细胞黏附和杀伤作用,导致移植物细胞功能障碍,凋亡增加。IL-17主要由辅助性T淋巴细胞分泌,在抗原呈递、介导细胞毒性T细胞和NK细胞杀伤病原体和异源性细胞、激活B淋巴细胞中发挥重要作用[14]。间断组细胞凋亡率低于持续组,单纯组最高。细胞凋亡是再灌注损伤、急性排斥反应、供体复跳失败的重要机制,也是供体心脏功能恢复不佳的重要原因。
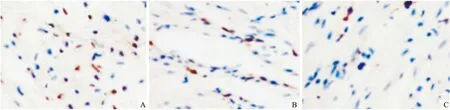
图3 TUNEL比色法检测心肌凋亡 ×400
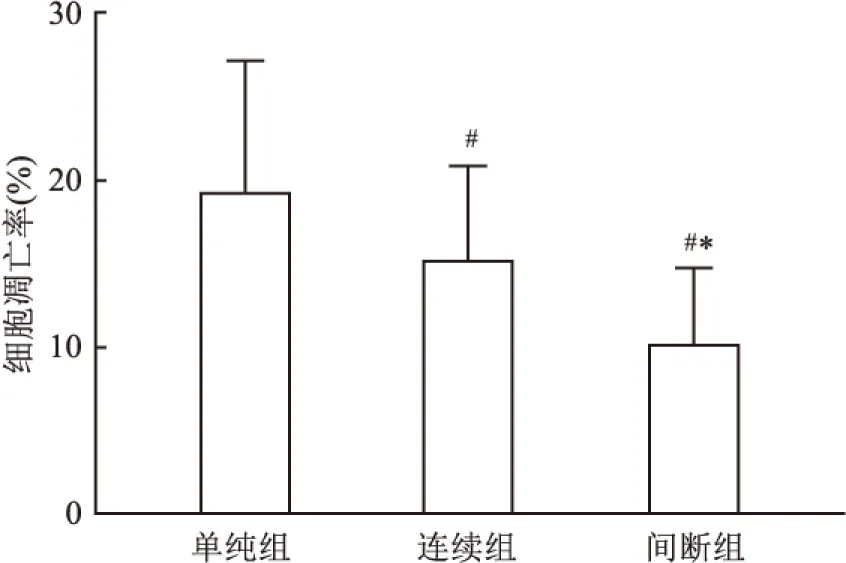
图4 TUNEL法检测各组心肌细胞凋亡率
与单纯组比较:#P<0.05;与连续组比较:*P<0.05
综上所述,HTK液不同灌注方法对同种异体兔心移植后的急性排斥反应影响不同,以间断2 h灌注可明显降低受体心肌ICAM-1和IL-17表达,抑制细胞凋亡效应最明显。移植心脏后功能是否能够恢复至移植前的影响因素和参与机制较多,如何探寻特异性的干预靶点,对提高供体保存技术和受体移植物存货质量具有十分重要的意义。

