橙皮素通过内质网应激通路诱导人肺癌细胞PC9发生凋亡
汪 超,彭万仁,童斯浩,王 华,施险峰,孙国平
肺癌的死亡率在全球因恶性肿瘤导致的死亡中位居首位,放、化疗对晚期肺癌患者的生存改善不甚显著,肺癌的病死率依然极高(5年生存率仅为16.8%)[1]。随着分子生物学和免疫学研究的深入,针对肺癌驱动基因和肿瘤微环境中免疫抑制分子的靶向干预药物正成为肺癌治疗的重要方式;但此类靶向药物的原发/继发性耐药和高昂的治疗成本限制了其在肺癌治疗中的应用。
橙皮素可诱导肿瘤细胞凋亡[2],抑制肿瘤血管生成[2],减少肿瘤细胞扩散[3]。目前认为,橙皮素介导的抗炎及抗氧化效应是其抗肿瘤作用的主要机制[4],但具体机制尚未完全明确。该研究观察橙皮素对肺腺癌细胞株PC9的增殖及凋亡的影响,并探讨其诱导PC9细胞内质网应激反应与凋亡发生的相关性。
1 材料与方法
1.1 仪器恒温CO2培养箱为美国Thermo公司产品;酶标仪为美国BIO-RAD公司产品;流式细胞仪为美国BD公司产品;双人单面超净台为中国苏州净化设备有限公司产品;台式离心机、高速大容量冷冻离心机为德国Eppendorf公司产品;倒置相差显微镜为日本Olympus公司产品。
1.2 细胞培养PC9细胞株购自中国科学院上海细胞库。PC9细胞使用含10%胎牛血清和1%青-链霉素的DMEM培养基进行培养,置于37 ℃含5% CO2的恒温培养箱中。细胞每1~2天进行1次换液,细胞生长密度大于90%时进行传代。冻存细胞定期进行复苏,观察复苏细胞形态,进行生长曲线分析及污染检测。细胞培养至对数生长期时进行后续实验。
1.3 乳酸脱氢酶(LDH)法检测细胞毒性LDH细胞毒性检测试剂盒购自碧云天生物技术有限公司。准备4个96孔板,将PC9细胞接种于96孔板中,置于CO2培养箱中培养至细胞密度约80%。每个板设置不同处理孔:单培养基孔(无细胞)、细胞对照孔(不加药物)、细胞最大酶活性对照孔、药物处理孔,在各药物处理孔中加入含有不同浓度(50、100、200、300、400、500、600 μmol/L)橙皮素的DMEM培养基,分别继续培养8、12、24、48 h。取出96孔板在细胞最大酶活性对照孔中加入LDH释放试剂,继续孵育1 h。收集各孔培养液,离心后取上清120 μl加入新的96孔板。在新孔板各孔中分别加入60 μl LDH检测工作液,混匀后避光孵育30 min。酶标仪测参考波长655 nm,检测波长490 nm的吸光度值。根据测定的值计算细胞毒性:细胞毒性=(处理样品吸光度-样品对照孔吸光度) / (细胞最大酶活性的吸光度-样品对照孔吸光度)×100%。
1.4 细胞凋亡流式细胞术检测Annexin V-FITC/PI凋亡检测试剂盒购于上海贝博生物科技有限公司。将PC9细胞接种于6孔板中,每孔1×105个细胞,置于CO2培养箱中培养至细胞密度约60%,更换培养基,分别加入含不同浓度(0、50、100、200、300、400 μmol/L)橙皮素的DMEM培养基,继续置于CO2培养箱中培养24 h。取出6孔板,收集各孔细胞,消化、离心、洗涤后置于流式管中,使用400 μl 1×Annexin V结合液重悬细胞,加入5 μl Annexin V染液,振荡混匀,2~8 ℃避光孵育15 min;加入10 μl PI染液,2~8 ℃避光孵育5 min。使用流式细胞仪检测凋亡。
1.5 Western blot法检测凋亡及内质网应激相关蛋白Caspase-3、Caspase-9、Apaf-1、Bcl-2、细胞色素C、CHOP、Caspase-4、Bip、p-JNK、p-Perk、IRE1、ATF6抗体及山羊抗鼠、山羊抗兔二抗均购自美国CST公司。用不同浓度(0、100、200、400 μmol/L)的橙皮素处理PC9细胞24 h后,消化、离心、洗涤细胞,并收集细胞置于1.5 ml EP管中,加入PBS和裂解液,混匀后煮沸15 min。取出EP管置于高速大容量冷冻离心机中离心10 min(4 ℃,12 000 r/min),取上清液(即蛋白),BCA法测定蛋白浓度。蛋白可保存于-80 ℃冰箱。蛋白样品经电泳后转膜于PVDF膜上。将PVDF膜置于5% BSA中室温封闭1 h,TBST洗膜3×10 min,一抗4 ℃孵育过夜,TBST洗膜3×10 min,二抗室温孵育1 h,TBST洗膜3×10 min。在PVDF膜上加入发光液,于胶片固定在一起,在暗室中显影。

2 结果
2.1 橙皮素对人肺腺癌PC9细胞株杀伤效应呈剂量-时间依赖图1A中可见,在处理时间相同时,随着药物处理时间增加,橙皮素对PC9细胞的杀伤效应逐渐增加,与8 h组相比,12、24、48 h组杀伤效应明显增加(P<0.01)。在同一处理时间时,随着药物剂量的增大,橙皮素对PC9细胞的杀伤效应逐渐增加,在处理时间为8 h时,与0 μmol/L组相比药物浓度达到300 μmol/L时杀伤作用才有明显统计学差异(P<0.01);处理时间为12 h时,与0 μmol/L组相比200 μmol/L时即有明显杀伤作用(P<0.01);处理时间为24 h和48 h时,与0 μmol/L组相比100 μmol/L时即有明显杀伤作用(P<0.01)。表1中所列数据为不同浓度橙皮素处理不同时间后的细胞毒性。图1B为不同剂量橙皮素处理PC9细胞48 h后的细胞光镜图,图中可以看出随着浓度的增加,活细胞数量逐渐降低,细胞形态变圆,细胞碎片增多。

表1 橙皮素对PC9细胞的细胞毒性
2.2 不同剂量橙皮素处理PC9细胞对细胞凋亡的诱导效应分别使用0、50、100、200、300、400 μmol/L剂量的橙皮素处理PC9细胞,流式细胞术检测结果可以看出随着药物浓度的增高,细胞凋亡率逐渐增高,以早期凋亡(Annexin V阳性,PI阴性)细胞增多为主(图2A)。图2B为总凋亡率的统计分析,0、50、100、200、300、400 μmol/L组凋亡细胞比例依次为:(0.08±0.06)、(6.86±1.38)、(14.50±1.62)、(17.65±2.36)、(23.43±3.55)、(32.03±2.91),50 μmol/L的橙皮素即可明显诱导PC9细胞的凋亡(F=75.56,P<0.05)。
2.3 橙皮素处理PC9细胞后凋亡相关蛋白的变化采用Western blot法检测不同剂量橙皮素处理后PC9细胞凋亡相关通路中的蛋白水平变化。图3A中可见,活化的Caspase-3、Caspase-9、Apaf-1、细胞色素C的条带随着药物浓度的增加逐渐增粗,Bcl-2条带逐渐变细。图3B统计中在橙皮素浓度为0、100、200、400 μmol/L时,活化Caspase-3蛋白水平相对Actin比率分别为(0.31±0.05)、(0.57±0.05)、(0.75±0.08)、(0.87±0.07),差异有统计学意义(F=44.08,P<0.05);活化Caspase-9相对比率分别为(0.74±0.07)、(0.76±0.07)、(0.92±0.09)、(1.01±0.09),差异有统计学意义(F=8.07,P<0.05);细胞色素C相对比率分别为(0.26±0.04)、(0.31±0.04)、(0.32±0.05)、(0.57±0.08),差异有统计学意义(F=19.73,P<0.05);Apaf-1相对比率分别为(1.31±0.06)、(1.43±0.11)、(1.51±0.19)、(1.75±0.11),差异有统计学意义(F=6.427,P<0.05)。Caspase-3、Caspase-9、细胞色素C、Apaf-1水平在橙皮素处理后均上调;而橙皮素浓度处理后Bcl-2水平明显降低,药物浓度为0、100、200、400 μmol/L时相对比率分别为(2.43±0.11)、(1.36±0.13)、(0.91±0.08)、(0.61±0.10),差异有统计学意义(F=175.5,P<0.05)。
2.4 橙皮素处理PC9细胞后内质网应激通路相关蛋白的变化在不同浓度橙皮素处理PC9细胞后,使用Western blot法检测了内质网应激通路相关蛋白(CHOP、Caspase-4、Bip和p-JNK)的表达水平。图4 A显示在橙皮素浓度分别为0、100、200和400 μmol/L 时,CHOP、Caspase-4、Bip和p-JNK这4个蛋白的条带呈增粗趋势。图4B统计显示,CHOP、Caspase-4、Bip和p-JNK蛋白表达水平在橙皮素处理后均上调,在橙皮素处理浓度为0、100、200和400 μmol/L时相对比率分别为CHOP:(0.68±0.05)、(0.68±0.08)、(1.05±0.13)、(1.11±0.09),差异有统计学意义(F=18.33,P<0.05);Caspase-4:(0.16±0.02)、(0.28±0.02)、(0.43±0.05)、(0.58±0.07),差异有统计学意义(F=50.92,P<0.05);Bip:(0.42±0.06)、(0.5±0.06)、(0.67±0.07)、(1.04±0.11),差异有统计学意义(F=37.23,P<0.05);p-JNK:(0.76±0.09)、(1.14±0.09)、(1.31±0.15)、(1.51±0.16),差异有统计学意义(F=18.77,P<0.05)。

图1 橙皮素对PC9细胞的细胞毒性随剂量和时间变化 ×200
A:橙皮素对PC9细胞的细胞毒性随剂量和时间变化;与8 h组相比,**P<0.01,与0 μmol/L组相比,##P<0.01;B:不同浓度处理PC9细胞48 h光镜图;1:0 μmol/L;2:50 μmol/L;3:100 μmol/L;4:200 μmol/L;5:300 μmol/L;6:400 μmol/L;7:500 μmol/L;8:600 μmol/L

图2 流式细胞术检测PC9细胞凋亡

图3 Western blot检测PC9细胞凋亡相关蛋白水平
1:Activated Caspase-3;2:Activated Caspase-9;3:Bcl-2;4:Apaf-1;5:细胞色素C, 与0 μmol/L组相比:*P<0.05,**P<0.01
2.5 橙皮素处理PC9细胞后内质网应激通路中感受器蛋白水平变化在内质网应激通路中,除相关蛋白外,还检测了相关感受器蛋白p-Perk、IRE1和c-ATF6的水平。图5A中p-Perk、IRE1及c-ATF6的剪切体水平均随橙皮素浓度增大而升高。图5B统计图显示,p-Perk、IRE1和c-ATF6蛋白水平在橙皮素处理后明显增高。在橙皮素处理浓度为0、100、200和400 μmol/L时,p-Perk表达相对比率分别为(0.43±0.05)、(0.71±0.07)、(1.2±0.13)、(1.26±0.1),差异有统计学意义(F=55.11,P<0.05);IRE1相对比率分别为(0.45±0.04)、(0.64±0.08)、(0.82±0.08)、(0.94±0.1),差异有统计学意义(F=22.55,P<0.05);c-ATF6相对比率分别为(0.04±0.003)、(0.07±0.01)、(0.12±0.01)、(0.34±0.04),差异有统计学意义(F=109.4,P<0.05)。
3 讨论
流行病学研究[5]表明,蔬菜、水果的日常摄取量和肿瘤等慢性疾病发生率呈负相关。其中富含的黄酮类化合物被广泛应用于肿瘤的预防及化疗中的辅助用药。作为柑橘类水果中含量最丰富的黄酮类化合物,橙皮素被证实在体外可诱导多种肿瘤细胞发生凋亡及细胞周期阻滞[6]。本实验中,橙皮素在体外可显著抑制人肺腺癌细胞株PC9的增殖,且此抑制效应为时间-剂量依赖性。试验中50 μmol/L橙皮素处理即可显著诱导PC9细胞发生凋亡,橙皮素诱导的凋亡被认为和其诱导的靶细胞线粒体膜渗透性改变相关。Bcl-2家族蛋白是决定线粒体渗透的主要效应蛋白,当Bcl-2/Bax蛋白比例降低,线粒体膜的稳定性下降、通透性升高,线粒体内促凋亡因子如细胞色素C等释放至胞浆内,结合Apaf-1后继而招募、活化Caspase9/3,最终导致细胞凋亡发生[7]。本实验中,随着橙皮素处理浓度的升高和凋亡程度增多,PC9细胞中Caspase-9、Caspase-3、Apaf-1以及细胞色素C的表达水平均显著升高,伴随Bcl-2的表达下调,证实橙皮素通过诱导线粒体应激启动PC9细胞凋亡。
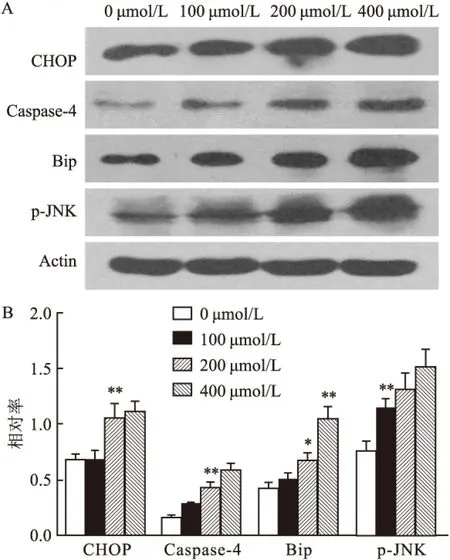
图4 Western blot检测PC9细胞内质网应激相关蛋白
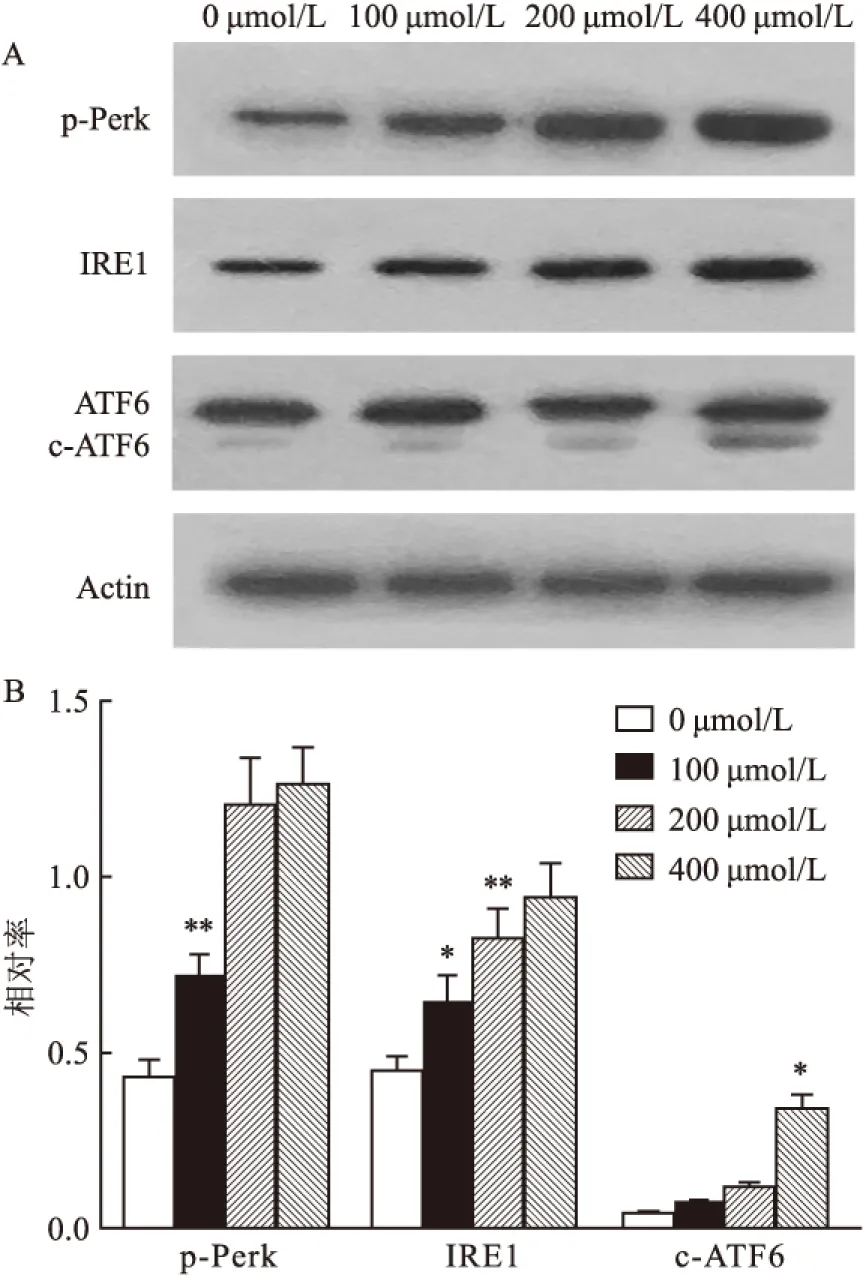
图5 Western blot检测PC9细胞内质网应激相关感受器蛋白
内质网应激(endoplasmic reticulum stress, ER stress)为内质网对氧化应激反应、射线损伤、血糖升高及异常蛋白堆积等异常因素的一种保护性反应,旨在维持细胞内环境保持相对稳态而免于发生凋亡。目前认为,ER stress和线粒体应激相互关联。在特定的细胞类型中,线粒体诱导的凋亡发生很大程度上需要ER stress参与,称为ER stress依赖的凋亡[8]。ER stress的发生和未折叠蛋白积聚有关,p-Perk、IRE1及c-ATF6是介导ER stress发生的主要信号通路[9]。p-Perk可以介导eIF2α磷酸化,进而抑制胞内蛋白合成,降低ER stress的强度,避免诱导凋亡发生[10]。Bip(又名GRP-78)在细胞发生ER stress时表达量亦会上调,其主要功能是作为分子伴侣协助未折叠蛋白进行正确折叠,降低ER腔内蛋白堆积程度,下调ER stress强度[11]。但eIF2α的活化会增加CHOP分子表达,而CHOP是可以直接诱导细胞凋亡的。可见ER stress是一个动态变化的过程,其结局是协助细胞对抗应激存活或是(联合线粒体应激)诱导凋亡发生,取决于ER stress的强度和持续时间[12]。本实验中,PC9细胞中p-Perk、IRE1及c-ATF6在接受橙皮素处理后均显著上调,可见ER stress效应分子Bip及CHOP的表达增加,提示橙皮素可诱导PC9细胞发生ER stress。IRE1和Perk可以激活JNK通路,尤其是ER stress程度加剧时,JNK的活化可以加速细胞凋亡进程[13]。本研究中,橙皮素处理可以明显上调PC9细胞JNK表达水平,伴随ER stress中Caspase 4表达增加。以上结果均提示,橙皮素诱导PC9发生了内质网和线粒体联合应激,并最终导致细胞凋亡发生。

