NRP1基因敲除对放射性肺纤维化进程的影响及其作用机制
董 卓, 李嘉乐, 陈肖逸, 王 蕊, 衣峻萱, 魏新锋, 金顺子
(吉林大学公共卫生学院 国家卫健委放射生物学重点实验室,吉林 长春 130021)
放射性肺纤维化(radiation-induced pulmonary fibrosis, RIPF)作为胸部肿瘤放疗常见的严重并发症,对9%~30%接受胸部肿瘤放疗的癌症患者的预后和生活造成严重影响,其主要特征是肺泡上皮细胞损伤及成纤维细胞、肌成纤维细胞的聚积,以及胶原和细胞外基质(extracellular matrix, ECM)的沉积[1]。其中,参与形成RIPF病灶的成纤维细胞有多种来源,其主要来源之一是发生上皮-间质转化(epithelial-mesenchymal transition,EMT)的肺泡Ⅱ型上皮细胞(alveolar type Ⅱ epithelial cells,AT-Ⅱ),并且预防EMT被认为是抑制组织纤维化的有效手段[2-4]。有研究[5-6]表明:Wnt/β-连环蛋白(β-catenin)信号通路和转化生长因子β1(transforming growth factor-β1, TGF-β1)/Smads通路与EMT的发生发展及ECM沉积有关。神经菌毛蛋白1(neuropilin-1,NRP1)是最初在神经系统内被发现的一种多功能的跨膜糖蛋白,其在生理或病理条件下均可作为TGF-β1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet-derived growth factor,PDGF)和信号素3A(semakin 3A,Sema 3A)等多种生长因子或其配体的共受体,进而发挥不同的生物学作用。在神经、肿瘤和免疫等系统中发挥多种生物学功能[6-10]。目前,NRP1已被证明在增强TGF-β1信号传导和促进成纤维细胞发生EMT的过程中起重要作用[11],但其在RIPF中的作用尚未见报道。本研究采用野生型C57BL/6J小鼠和AT-Ⅱ细胞中特异性敲除NRP1基因小鼠建立RIPF小鼠模型,探讨NRP1对RIPF进程的影响及其在Wnt/β-catenin和TGF-β1/Smads通路所介导的EMT过程及ECM沉积中的作用机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器 携带FloxP位点的纯合子C57BL/6J转基因小鼠(NRP-1flox/flox)和肺组织中ATⅡ细胞特异性表达Cre重组酶的C57BL/6J转基因小鼠(美国Jackson 实验室)。他莫昔芬(美国Sigma公司),苏木素和伊红(中国索莱宝公司),Masson染色试剂盒、DAB显色试剂盒和免疫组织化学试剂盒(中国福建迈新公司),RNA提取试剂盒、逆转录试剂盒和实时荧光定量-聚合酶链反应(qRT-PCR)试剂盒(中国大连宝生物工程公司),鼠抗GAPDH抗体和兔抗NRP1抗体(美国Abcam公司),兔抗TGF-β1抗体、兔抗Smad2抗体、兔抗α平滑肌肌动蛋白(α-SMA)抗体和兔抗Ⅰ型胶原(collagen type Ⅰ, ColⅠ)抗体、HRP标记山羊抗兔二抗和HRP标记山羊抗鼠二抗(美国Bioworld公司),兔抗β-catenin抗体(美国Cell Signaling Technology公司)。X-RAD320生物辐照仪(美国PXI公司),自动酶联免疫标记仪和EX180TM酶标仪(美国Bio-Tek公司),正置荧光显微镜和Olympus AX-70真彩图像分析系统(日本Olympus公司),PCR扩增仪(美国Bio-Red公司)。
1.2 实验分组和RIPF模型建立 通过将携带FloxP位点的纯合子C57BL/6J转基因小鼠(NRP1flox/flox)与AT-Ⅱ细胞特异性表达Cre重组酶的C57BL/6J转基因小鼠经过几轮交配,最后经鉴定得到基因型为NRP1flox/flox-Cre+的C57BL/6J小鼠进行后续实验。对符合基因型的160只C57BL/6J小鼠进行编号排列,并按实验设计根据照射后不同时间点分为4周组、8周组、16周组和24周组,每组按随机数字表法将小鼠又分野生型(Con)组、野生型单纯照射(IR)组、NRP1基因特异性敲除(KO-Con)组和NRP1基因特异性敲除+照射(KO+IR)组,每亚组10只小鼠。
KO-Con和KO+IR组小鼠腹腔注射他莫昔芬(75 mg·kg-1),每 24 h注射 1 次,连续 5 d,特异性敲除AT-Ⅱ细胞NRP1基因。利用X-RAD 320生物照射仪对 IR组和KO+IR组小鼠进行全胸廓照射(其他部位用铅板遮挡),电压为180 kV,电流为12.0 mA,靶皮距为70 cm,剂量率为2.0 Gy·min-1,单次照射剂量为20 Gy。并于照射后4、8、16和24周处死各组小鼠,取肺组织进行后续实验。
1.3 小鼠肺组织HE染色和Masson 染色 所提取小鼠肺组织用4%多聚甲醛固定24 h后进行石蜡包埋、4 μm厚切片。对切片进行HE染色和Masson染色,在100倍光镜下观察肺组织形态表现和胶原蛋白沉积情况。
1.4 免疫组织化学法检测小鼠肺组织中Col Ⅰ和 α-SMA 蛋白表达 将小鼠肺组织用4%中性甲醛固定,梯度乙醇脱水,石蜡包埋,4 μm厚切片。之后进行脱蜡、水化及抗原修复,按照免疫组织化学试剂盒说明书操作,对肺组织中 Col Ⅰ 和α-SMA蛋白进行染色。最后,光学显微镜下观察到棕黄色或棕褐色颗粒者为 Col Ⅰ和α-SMA 蛋白的阳性表达。
1.5 Western blotting法检测小鼠肺组织中NRP1、TGF-β、Smad 2和β-catenin 蛋白表达水平 小鼠肺组织加入遇冷的蛋白裂解液,电动匀浆至完全裂解,离心收集上清液,BCA蛋白定量,加入蛋白上样缓冲液并煮沸 5 min。蛋白上样,SDS-PAGE 凝胶电泳并转印至 PVDF 膜,5% 脱脂奶粉封闭2 h,一抗4℃孵育过夜,TBST洗膜3次,二抗室温孵育2 h,TBST洗3次,ECL 显色液显色,暗室曝光。在凝胶成像系统中显影,检测各条带的灰度值,以GAPDH作为内参照。目的蛋白相对表达水平=目的条带灰度值/GAPDH条带灰度值。
1.6 qRT-PCR法检测小鼠肺组织中NRP1、Col Ⅰ、α-SMA、β-catenin、TGF-β1、Smad2、上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)mRNA表达水平 在 PubMed 的 GenBank数据库中检索出NRP1和肺纤维化相关标志物的基因序列,委托上海生工生物科技有限公司设计并合成荧光定量 PCR 引物,引物序列见表1。用RNA提取试剂盒提取肺组织总RNA,逆转录试剂盒进行逆转录,利用qRT-PCR试剂盒于PCR扩增仪中检测基因相对表达水平。 PCR 反应条件: 95℃、5 min;95℃、30 s,60℃、30 s,72℃、30 s,40个循环。以GAPDH作为内参照,采用2-△△Ct法计算目的基因mRNA相对表达水平。

表1 qRT-PCR引物序列Tab.1 Sequences of qRT-PCR primers
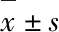
2 结 果
2.1 各组小鼠肺组织HE染色和Masson染色结果 照射后8周内,与Con组比较,KO-Con组小鼠肺组织无明显变化;IR组小鼠肺组织主要表现为放射性肺炎,炎细胞增多,肺纹理增粗,肺间隔增宽;KO+IR组小鼠肺组织可见少许的肺泡壁增厚和肺泡腔的融合扩大,炎症反应较IR组弱。至照射后第24周,与Con组比较,KO-Con组小鼠肺组织无明显变化;IR组小鼠肺组织可见小片纤维化逐渐发展成为典型的纤维化病灶,肺组织结构紊乱,肺泡间隔增厚,肺泡结构消失;KO+IR组小鼠肺组织仅见部分肺泡萎陷,局部间隔增宽,病理形态表现较IR组轻。IR组和KO+IR组小鼠肺组织RIPF病理形态表现随照射后时间延长而逐渐加重,且KO+IR组小鼠RIPF病理形态表现在照射后各时间点均较 IR组轻。见图1(插页一)和图2(插页二)。
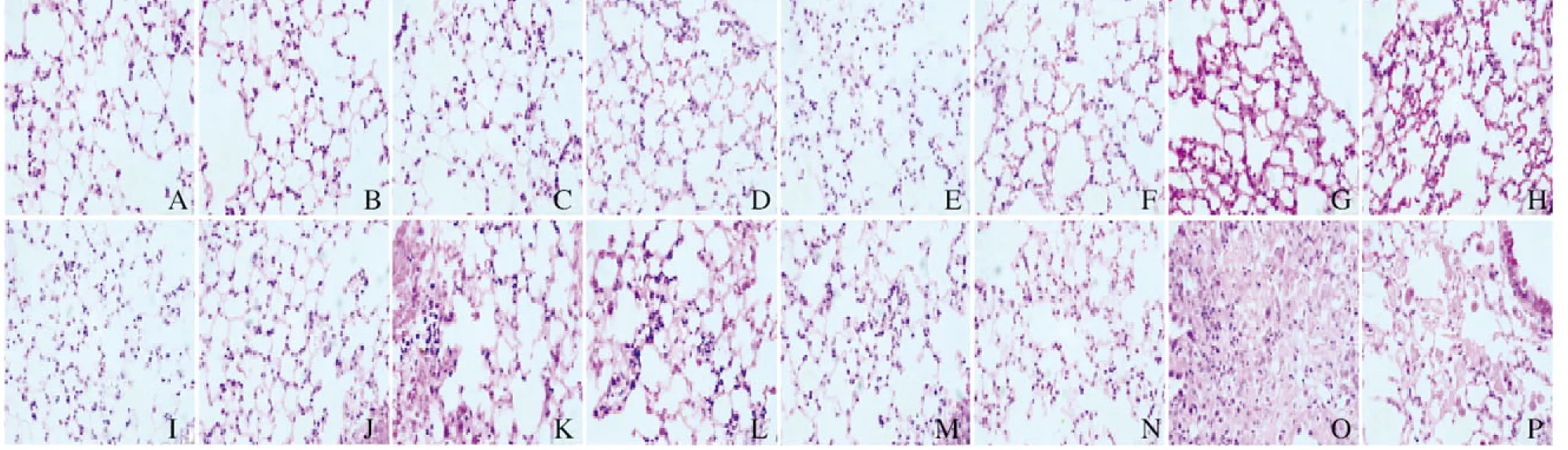
A-D:4 weeks;E-H:8 weeks;I-L:16 weeks;M-P:24 weeks;A,E,I,M:Con group;B,F,J,N:KO-Con group;C,G,K,O:IR group;D,H,L,P:KO+IR group.
图1 HE染色观察照射后不同时间各组小鼠肺组织形态表现(×100)
Fig.1 Morphology of lung tissue of mice at different time after irradiation in various groups observed by HE staining (×100)
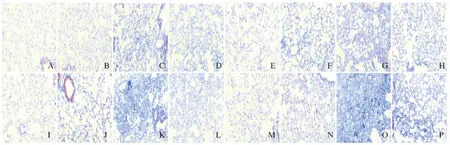
A-D:4 weeks;E-H:8 weeks;I-L:16 weeks;M-P:24 weeks;A,E,I,M:Con group;B,F,J,N:KO-Con group;C,G,K,O:IR group;D,H,L,P:KO+IR group.
图2 Masson染色观察各组小鼠肺组织胶原沉积情况(×100)
Fig.2 Collagen deposition in lung tissue of in mice in various grouops observed by Masson staining (×100)
2.2 各组小鼠肺组织中NRP1蛋白和mRNA表达水平 Western blotting法检测结果:与 Con组比较,KO-Con组小鼠肺组织中NRP1蛋白表达水平均降低,IR组小鼠肺组织中NRP1蛋白表达水平随时间延长逐渐升高,24周时达到最高;与 IR组比较,KO+IR组小鼠肺组织中NRP1蛋白表达水平随时间延长逐渐降低(图3)。qRT-PCR法检测结果显示:与 Con组比较,KO-Con组小鼠肺组织中NRP1 mRNA表达水平均降低(P<0.05),IR组小鼠肺组织中NRP1 mRNA表达水平随时间延长逐渐升高(P<0.05或P<0.01),24周时达到最高(P<0.01);与 IR组比较,KO+IR组小鼠肺组织中NRP1 mRNA表达水平随时间延长逐渐降低,16和24周时差异有统计学意义(P<0.05或P<0.01)。见表2。

Lane 1:Con group;Lane 2:KO-Con group;Lane 3:IR group;Lane 4:KO+IR group.
图3 各组小鼠肺组织中 NRP1蛋白表达电泳图
Fig.3 Electrophoregram of expressions of NRP1 protein in lung tissue of mice in various groups
2.3 各组小鼠肺组织中Col Ⅰ和α-SMA蛋白和mRNA表达水平 免疫组织化学染色结果:与Con组比较,KO-Con组小鼠肺组织中Col Ⅰ 和α-SMA蛋白阳性表达量降低,IR组和KO+IR组小鼠肺组织中Col Ⅰ 和α-SMA蛋白阳性表达量逐渐升高,各时间点IR组均明显高于Con组。与IR组比较,KO+IR组小鼠肺组织中Col Ⅰ 和α-SMA蛋白阳性表达量在各时间点均明显降低(图4和5,见插页二)。qRT-PCR法检测结果:与Con组比较,KO-Con组小鼠肺组织中Col Ⅰ 和α-SMA mRNA表达水平明显降低(P<0.05),IR组小鼠肺组织中Col Ⅰ 和α-SMA mRNA表达水平随时间的延长逐渐升高(P<0.05或P<0.01)。与IR组比较,KO+IR组小鼠肺组织中Col Ⅰ 和α-SMA mRNA表达水平随时间延长逐渐降低,在16和24周时差异有统计学意义(P<0.05或P<0.01)。见表3。

A-D:4 weeks;E-H:8 weeks;I-L:16 weeks;M-P:24 weeks;A,E,I,M:Con group;B,F,J,N:KO-Con group;C,G,K,O:IR group;D,H,L,P:KO+IR group.
图4 各组小鼠肺组织中Col Ⅰ蛋白表达情况(免疫组织化学,×400)
Fig.4 Expressions of Col Ⅰ protein in lung tissue of mice in various groups (Immunohistochemistry,×400)

A-D:4 weeks;E-H:8 weeks;I-L:16 weeks;M-P:24 weeks;A,E,I,M:Con group;B,F,J,N:KO-Con group;C,G,K,O:IR group;D,H,L,P:KO+IR group.
图5 各组小鼠肺组织中α-SMA蛋白表达情况(免疫组织化学,×400)
Fig.5 Expressions of α-SMA protein in lung tissue of mice in various groups (Immunohistochemistry,×400)

表2 各组小鼠肺组织中 NRP1 mRNA 表达水平Tab.2 Expression levels of NRP1 mRNA in lung tissue of mice in various groups
*P<0.05,**P<0.01vsCon group;△P<0.05,△△P<0.01vsIR group.

表3 各组小鼠肺组织中Col Ⅰ和α-SMA mRNA 表达水平Tab.3 Expression levels of α-SMA and ColⅠmRNA in lung tissue of mice in various groups
*P<0.05,**P<0.01vsCon group;△P<0.05,△△P<0.01vsIR group.
2.4 各组小鼠肺组织中β-catenin、TGF-β1和Smad2蛋白和mRNA表达水平 Western blotting法检测结果:随时间的延长,KO-Con组小鼠肺组织中β-catenin、TGF-β1和Smad2 蛋白表达水平逐渐降低,各时间点均低于Con组; 随时间的延长,IR组和KO+IR组小鼠肺组织中β-catenin、TGF-β1和Smad2 蛋白表达水平逐渐升高,且各时间点均高于Con组;KO+IR组小鼠肺组织中β-catenin、TGF-β1和Smad2蛋白在各时间点均明显低于IR组,但仍高于Con组(图6)。 qRT-PCR法检测结果:与Con组比较,各时间点KO-Con组小鼠肺组织中β-catenin、TGF-β1和Smad2 mRNA表达水平均不同程度降低(P<0.05),IR组小鼠肺组织中β-catenin、TGF-β1和Smad2 mRNA表达水平明显升高(P<0.05或P<0.01)。与IR组比较,16和24周时KO+IR组小鼠肺组织中β-catenin和TGF-β1 mRNA表达水平及8、16和24周时Smad2 mRNA表达水平明显降低(P<0.05或P<0.01)。见表4。
2.5 各组小鼠肺组织中E-Cadherin、N-Cadherin和Vimentin mRNA表达水平 与Con组比较,各时间点KO-Con组小鼠肺组织中E-Cadherin mRNA表达水平明显升高(P<0.05),N-Cadherin和Vimentin mRNA表达水平明显降低(P<0.05),IR组小鼠肺组织中E-Cadherin mRNA表达水平明显降低(P<0.05),N-Cadherin和Vimentin mRNA表达水平明显升高(P<0.05或P<0.01)。与IR组比较,16和24周时KO+IR组小鼠肺组织中E-Cadherin mRNA表达水平明显升高(P<0.05或P<0.01),24周时N-Cadherin mRNA表达水平、16和24周时Vimentin mRNA表达水平明显降低(P<0.05或P<0.01)。见表5。
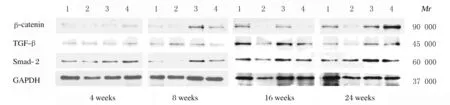
Lane 1:Con group;Lane 2:KO-Con group;Lane 3:IR group;Lane 4:KO+IR group.图6 各组小鼠肺组织中β-catenin、TGF-β1和Smad2 mRNA表达电泳图Fig.6 Electrophoregram of expressions of β-catenin,TGF-β1,and Smad2 mRNA in lung tissue of mice in various groups

表4 各组小鼠肺组织中 β-catenin、TGF-β1和Smad2 mRNA 表达水平Tab.4 Expression levels of β-catenin,TGF-β1 and Smad2 in lung tissue of mice in various groups
*P<0.05,**P<0.01vsCon group;△P<0.05,△△P<0.01vsIR group.
3 讨 论
放射治疗是目前肿瘤治疗三大手段之一,约70%的恶性肿瘤患者在其治疗过程中均会接受放射治疗。然而,在临床常见的胸部肿瘤放射治疗过程中,肺脏作为辐射中度敏感器官,肿瘤周围的正常肺组织因所受放疗剂量超过其生物效应的阈值而产生不同程度的损伤[12]。放射性肺损伤在前期表现为放射性肺炎,在后期(>6个月)表现为肺纤维化。本研究通过对野生型和AT-Ⅱ细胞特异性敲除NRP1基因的C57BL/6J转基因小鼠进行全胸局部单次X射线照射(20 Gy,2.0 Gy·min-1)成功建立RIPF小鼠模型, HE染色和Masson染色结果表明:NRP1基因的特异性敲除在小鼠RIPF发生过程中起到负向调节作用,可减少胶原的沉积,减轻肺纤维化程度。

表5 各组小鼠肺组织中 E-Cadherin、N-Cadherin和Vimentin mRNA表达水平Tab.5 Expression levels E-Cadherin,N-Cadherin and Vimentin mRNA in lung tissue of mice in various groups
*P<0.05,**P<0.01vsCon group;△P<0.05,△△P<0.01vsIR group.
有研究[13-14]显示:肺部受损伤后,成纤维细胞可激活分化为沉积纤连蛋白和胶原基质能力更强的肌成纤维细胞,分泌产生含有α-SMA、纤连蛋白和Col Ⅰ 的ECM。在正常的肺组织修复中,肌成纤维细胞可以通过凋亡而消除,但在 RIPF患者中肌成纤维细胞却持续存在而免于凋亡[15]。因此,肌成纤维细胞是RIPF病灶的关键效应细胞,引起过多的ECM沉积,导致RIPF。本研究从mRNA和蛋白层面对小鼠肺部ECM沉积情况进行检测,结果表明:NRP1基因的特异性敲除可明显抑制小鼠肺组织中α-SMA和Col Ⅰ 的表达。α-SMA表达降低说明成纤维细胞向肌成纤维细胞分化的能力减弱,NRP1基因的特异性敲除可能通过在RIPF过程中抑制成纤维细胞向肌成纤维细胞分化,从而抑制ECM沉积。
Wnt/β-catenin 信号通路是一条在进化中高度保守的信号通路,在胚胎发育、干细胞维持、伤口愈合和其他生理过程中起至关重要的调控作用[16]。Wnt/β-catenin 信号通路中Wnt配体包括Wntl、Wnt2、Wnt3、Wnt3a、Wnt8a、Wnt8b、Wnt10和Wnt10b,其中Wnt3a是Wnt经典途径的代表蛋白[17]。Wnt活化并激活肺上皮细胞中的β-catenin,这是肺纤维化的关键环节,可促进EMT,诱发成纤维细胞等间充质细胞的分化,加速ECM沉积,而抑制Wnt/β-catenin 信号通路相关蛋白表达可减弱甚至逆转肺纤维化和肾纤维化[5, 17]。有研究[5,18]表明:Wnt/β-catenin 信号通路在RIPF的发生发展过程中起调控作用,其与TGF-β 信号通路之间存在交叉串扰,Wnt/β-catenin 以TGF-β依赖的方式, 通过Smad3蛋白C-末端和β-catenin蛋白N-末端区域相互作用, 影响β-catenin,2个信号通路相互作用形成的胞内蛋白,在细胞核内启动系列基因的转录。本研究结果显示:NRP1基因的特异性敲除可能通过下调β-catenin的方式参与Wnt/β-catenin 信号通路在RIPF病灶抑制成纤维细胞向肌成纤维细胞分化和ECM过度沉积的调节,减轻RIPF的病理形态表现。
TGF-β1/ Smads通路的失调是组织纤维化的重要致病机制。TGF-β1作为重要的促纤维化生长因子,其在RIPF进程中主要起到促进成纤维细胞增殖分化和ECM合成及沉积等作用[19]。有研究[20]表明:NRP1可能在细胞膜捕获TGF-β1和LAP-TGF-β1过程中发挥重要作用,从而增强TGF-β1信号传导,促进TGF-β1分泌,进而促进EMT的发生发展。基质成纤维细胞中NRP1的下调减少了TGF-β1诱导的Smad 2/3磷酸化,从而降低了α-SMA的表达。本研究结果表明:NRP1基因的特异性敲除可能通过下调TGF-β1和Smad2的方式参与TGF-β1/Smads通路对RIPF的调节,抑制成纤维细胞向肌成纤维细胞分化并抑制ECM的过度沉积,进而抑制RIPF进程。
RIPF 的病灶主要由成纤维细胞、肌成纤维细胞和沉积的 ECM 构成。其中,肌成纤维细胞的可能来源包括驻留的基质成纤维细胞、骨髓来源的纤维细胞和一部分经历EMT的AT-Ⅱ细胞[21]。发生EMT 的AT-Ⅱ细胞是肺纤维化发生发展过程中成纤维细胞的重要来源[22]。AT-Ⅱ细胞在生理条件下合成和分泌大量蛋白质以产生肺表面活性物质并维持气道免疫防御[23]。同时,作为肺泡干细胞,AT-Ⅱ细胞通过分化成肺泡Ⅰ型细胞(alveolar type I epithelial cell,AT-Ⅰ)使肺泡上皮再生[24]。在肺组织受到损伤后,AT-Ⅱ细胞识别和清除错误折叠蛋白的能力降低,错误折叠蛋白在患者肺部大量积累,导致AT-Ⅱ细胞功能衰退[23]。EMT是一种动态的、可逆的过程,涉及胚胎发育、伤口愈合、癌症转移和纤维化等环节,并且与细胞迁移和侵入能力的增强有关[22, 25]。发生EMT的上皮细胞失去接触黏附能力和顶端-基底极性,形态发生改变。同时,其细胞骨架发生明显变化,获得迁移和ECM侵袭的能力并出现一些间充质特征[26-27]。也有研究[13]表明:发生EMT的细胞可能通过增强细胞硬度和提供促纤维化细胞因子的方式,间接刺激肌成纤维细胞群,诱导纤维化的发生,而不会分泌过多的胶原蛋白。本研究结果显示:NRP1基因的特异性敲除明显下调了N-cadherin与Vimentin的表达,上调了E-cadherin的表达,表明NRP1基因的敲除可抑制RIPF过程中AT-Ⅱ细胞向成纤维细胞的分化,进而抑制RIPF进程。
综上所述,NRP1可在RIPF进程中起到促进小鼠肺组织上皮细胞发生EMT,并同时促进小鼠成纤维细胞向肌成纤维细胞分化造成ECM过度沉积的作用,NRP1可能通过上调β-catenin的方式激活Wnt信号通路,通过上调TGF-β1和Smad2的方式激活TGF-β1/Smads通路,促进RIPF发展。NRP1基因的敲除可抑制RIPF的发生发展,其机制可能与调节小鼠肺组织中Wnt/β-catenin和TGF-β1/Smads信号通路的表达进而抑制EMT 进程有关。
本研究初步阐明了RIPF发病的分子机制,对下一步有针对性地研究靶向药物、提高胸部肿瘤放疗疗效具有重要意义。

