基于荧光共振能量转移技术的快速检测CA16型手足口病病原体新方法的建立及其评价
聂 玮,李 娟,曹晓炼,代天聪,郭潇潇,刘玉申,王 娟,李卓林
(吉林大学公共卫生学院流行病与卫生统计学教研室,吉林 长春 130021)
柯萨奇病毒A组16型(Coxsackie virus A16, CA16)是引发手足口病的主要病原体之一[1]。近年来,手足口病在我国暴发流行呈上升的趋势[2],因此高效、准确、特异性地检测CA16是控制和预防手足口病流行的关键。目前,对CA16的检测方法主要包括传统的分离培养鉴定法、免疫学检测法和分子生物学检测法等[3-5]。但上述检测方法已经无法满足疾病流行期间大样本量的实时同步诊断的要求,因此开发高效准确的检测新技术是做好传染病预防控制的关键。
荧光能量共振转移(fluorescence resonance energy transfer, FRET)技术是指当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,且两分子的距离在10 nm范围内时发生的一种非放射性的能量转移现象[6-7]。该技术可极大降低背景光,同时具有分辨率高和重现性好等优点,可弥补复杂生物体系样本荧光检测技术的不足,目前利用该技术构建生物探针是分析检测领域的研究热点[8]。FRET技术的应用主要体现在免疫分析方面,该技术作为一种简单的均相分析方法,不仅适用于小分子,还适用于大分子[9]。在免疫分析中,抗体的纯度和特异性在很大程度上影响了FRET的效率,常用的抗体有单克隆抗体和多克隆抗体,单克隆抗体由于其成本昂贵并不适用于现场检测中,因此,以鸡卵黄抗体(immunoglobulin yolk, IgY)为代表的多克隆抗体在检测领域中发挥着至关重要的作用[10]。IgY是指存在于经抗原免疫后的产蛋母鸡卵黄中的免疫球蛋白[11],是鸡血中的IgG经受体介导选择性地以垂直传播的方式转移到鸡卵黄中并产生大量的高特异性的抗体[12-13]。根据需要的不同,采用不同的抗原进行免疫,即可产生针对该抗原的特异性抗体[14]。
本研究基于FRET技术构建新型纳米“荧光开关”,根据本课题组前期研究[15]结果,首次建立了CA16型手足口病病原体的荧光淬灭-恢复检测体系,借助荧光分光光度计对CA16进行定性和定量检测,并对检测体系的灵敏度、特异度和临床检测效果进行评价,以期达到CA16快速检测的目的,为进一步实现手足口病的快速高效检测奠定基础。
1 材料与方法
1.1 毒株和细胞 CA16、肠道病毒71型(Enterovirus71,EV71)、人横纹肌瘤细胞(RD)和非洲绿猴肾细胞(Vero)为吉林大学公共卫生学院微生物实验室保存。
1.2 实验动物及主要试剂 雌性健康无特定病原(SPF)鸡购自山东昊泰实验动物繁育中心。弗氏完全佐剂、弗氏不完全佐剂和聚乙二醇PEG-6000购自美国 Sigma 公司,SDS-PAGE凝胶制备试剂盒购自上海康为世纪试剂有限公司,辣根过氧化物酶标记的羊抗鸡 IgY购自艾博抗(上海)贸易有限公司,CdSe/ZnS量子点购自星紫(上海)新材料技术开发有限公司。
1.3 病毒培养 取-80℃保存的CA16病毒接种于RD细胞,5% CO2、37℃培养箱培养12~24 h后,用显微镜观察细胞病变情况,当细胞出现80%以上病变时即可收获病毒。反复冻融3次,4℃、3 000 r·min-1离心30 min,收集上清病毒液,采用空斑法测定病毒滴度,用磷酸盐缓冲溶液(PBS)调节病毒液滴度为2×106PFU·mL-1。
1.4 CA16鸡卵黄抗体(CA16-IgY)的纯化和鉴定 将CA16-IgY经蛋白纯化仪纯化,并对纯化后的CA16-IgY进行SDS-PAGE凝胶电泳鉴定,BCA法测定蛋白水平,间接ELISA法测定抗体效价和特异性。分别用EV17、CA16和牛血清蛋白(BAS)测定抗体的交叉反应,以空白孔的吸光度[A(450)]值为对照,以P/N≥2.1为阳性判定标准。
1.5 金纳米粒子(AuNPs)及其生物探针(IgY-AuNPs)的制备和表征 采用柠檬酸三钠还原法制备粒径均匀,物理、化学性质稳定,分散性好的AuNPs[16]。具体步骤如下:取 50 mL 氯金酸(质量分数为 0.01%)用恒温磁力加热搅拌器加热到沸腾,迅速加入2 mL柠檬酸钠溶液(质量分数为1%,含0.05% 柠檬酸),继续加热待反应液变为酒红色,停止加热,继续搅拌 5 min 后撤去热源,冷却至室温,4℃ 避光保存。根据文献[17],将50 μg CA16-IgY通过静电自组装偶联至500 μL AuNPs表面,并通过紫外可见光谱(UV-Vis)、红外光谱(FTIR)和透射电子显微镜(TEM)等方法对所制备的AuNPs和IgY-AuNPs的尺寸、形貌和性能进行表征。
1.6 CA16检测方法的建立及评价 以本课题组前期研究建立的EV71检测方法为基础[15],基于FRET原理,建立一种CA16型手足口病病原体快速检测的新方法,首先,制备CA16鸡卵黄抗体金纳米生物探针(CA16-IgY-AuNPs),以AuNPs和量子点为基体,构建纳米“荧光开关”体系,以IgY-AuNPs调控“开关”,即在待检状态下,IgY-AuNPs与量子点相结合(dD-A < 10 nm),电荷从量子点转移到AuNPs表面,荧光发生淬灭,形成荧光“turn-off”淬灭平衡体系;当待检样本中存在病毒颗粒时,病毒颗粒竞争性结合免疫化的IgY-AuNPs,荧光淬灭平衡体系被破坏,使荧光量子点得以游离,荧光迅速恢复,形成荧光“turn-on”恢复体系,为使检测体系检测效果达到最佳,需对AuNPs-IgY浓度、NaCl用量和荧光恢复时间指标进行条件优化[18]。同时,选择16例感染CA16和其他肠道病毒的手足口病患者的粪便样本分别采用本研究建立的CA16检测方法和qRT-PCR法进行检测,对2种检测方法的灵敏度和特异度进行评价,灵敏度=[a/(a+c)]×100%,特异度=[d/(b+d)]×100%。
2 结 果
2.1 CA16-IgY鉴定结果 纯化后CA16-IgY呈现2条清晰明显的目的条带,重链相对分子质量约为75 000,轻链相对分子质量约为25 000(图1)。采用BCA法检测CA16-IgY的蛋白含量,标准曲线线性方程为y=0.535 8x+0.121 3,R2=0.994 6。根据所得到的线性标准曲线计算蛋白水平(图2A),免疫期间蛋白水平平均为12.15 mg·L-1。随着免疫次数的增加,CA16-IgY效价逐渐增高,在第3次免疫后的第10天抗体效价为1∶128 000,达到最高值,该效价持续近10 d(图2B)。CA16-IgY特异性测定结果见表1,空白孔A(450)值为0.046,以P/N≥2.1为阳性判定标准,CA16检测结果为阳性,EV71和BSA检测结果均为阴性,无交叉反应。见表1。
M: Protein marker; Lane 1: Purified IgY; Lane 2: Unpurified IgY.
图1 纯化后CA16-IgY的SDS-PAGE凝胶电泳纯度鉴定电泳图
Fig.1 Electrophoregram of SDS-PAGE identification of purity of purified CA16-IgY
2.2 AuNPs和CA16-IgY-AuNPs表征结果 紫外可见光谱表征结果:AuNPs在520 nm波长处出现特征吸收峰,峰型对称;当IgY偶联至AuNPs表面形成CA16-IgY-AuNPs时,可诱导吸收峰红移6 nm,且吸收峰值降低(图3 A)。红外光谱表征结果:AuNPs的特征峰出现在3 400 cm-1(-OH)。CA16-IgY-AuNPs的特征峰出现在3 400 cm-1(-OH)、2 850 cm-1(-CH2)、1 730 cm-1(-C=O)、1 550 cm-1(-NH)和1 220 cm-1(C-O)(图3 B)。AuNPs TEM观察结果(图3 C):AuNPs颗粒形状以球形为主,粒径均一,呈高度分散状态,平均直径为20 nm。CA16-IgY-AuNPs TEM观察结果:CA16-IgY标记的AuNPs颗粒仍呈高分散状态,标记后的AuNPs颗粒表面出现一圈均匀的CA16-IgY-AuNPs共轭体外层(图3 D)。

图2 CA16-IgY免疫应答期间抗体蛋白水平(A)和抗体效价(B)
Fig.2 Protein levels(A)and titers of CA16-IgY during immune response
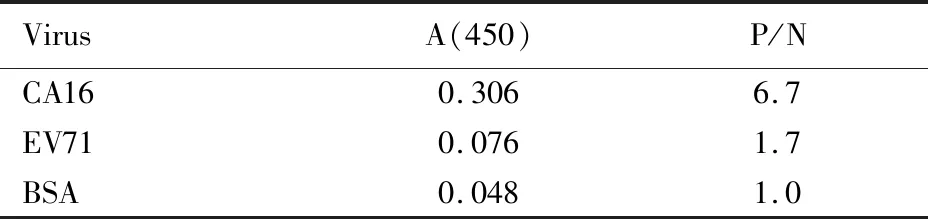
表1 CA16-IgY特异性检测结果Tab.1 Specificity test results of CA16-IgY
2.3 CA16荧光淬灭-恢复检测体系实验条件优化 IgY-AuNPs浓度优化结果:随着IgY-AuNPs浓度增加,荧光强度逐渐降低,当IgY-AuNPs浓度为0.52×10-3g·L-1时,检测体系荧光强度达到平台期,因此确定IgY-AuNPs的最佳浓度为0.52×10-3g·L-1(图4A)。在荧光检测体系中NaCl作为一种稳定剂对量子点有一定的淬灭作用,并且起到稳定金纳米生物探针的作用,因此本实验需对NaCl用量进行优化[18]。NaCl用量优化结果:随着NaCl用量的增加,荧光强度逐渐降低,当NaCl的用量为40 μL时,检测体系荧光强度达到最小值,因此NaCl的最佳用量为40 μL(图4B)。荧光恢复时间优化结果:当荧光淬灭体系中加入CA16后,随着反应时间的增加,荧光强度逐渐升高,在 90 min时荧光值达到最大,因此确定本实验的最佳荧光恢复时间为90 min(图4C)。
2.4 CA16荧光淬灭-恢复检测体系检出限测定结果 用所建立的检测方法检测不同浓度的CA16病毒液,实验重复3次。随着CA16浓度的增加,荧光值逐渐恢复(图5A),当CA16病毒滴度为1×104~ 2×106PFU·mL-1时,反应物在525 nm处荧光值与病毒滴度呈线性关系,其标准曲线为I525 nm= 15.452 IgC-9.746,R2=0.993 2,检测限为1×104PFU·mL-1(图5B)。

图3 AuNPs和CA16-IgY-AuNPs的UV-Vis图(A)、FTIR图(B)及AuNPs(C)和CA16-IgY-AuNPs(D)TEM图(Bar=10 nm)
Fig.3 UV-Vis spectra (A) and FT-IR spectra(B) of AuNPs and CA16-IgY-AuNPs and TEM images of AuNPs(C)and CA16-IgY-AuNPs(D)(Bar=10 nm)

A: Optimization of IgY-AuNPs concentration; B: Optimization of NaCl dosage; C:Time optimization of fluorescence recovery.图4 检测体系实验条件优化结果Fig.4 Experimental condition optimization results of detection system

A: Fluorescence spectra of different concentrations of CA16; B: Calibration curve for CA16 virus.
图5 检测体系检出限测定结果
Fig.5 Detection result of limit of detection system
2.5 CA16荧光淬灭-恢复检测体系特异性评价结果 向检测体系加入肠道病毒(EV71)、蛋白干扰物(BSA)和CA16,同时设空白对照组,检测反应物荧光值以验证方法的特异度。以P/N≥2.1为阳性判定标准,空白对照组荧光值为19.93±1.06,CA16组荧光值为54.46±3.79,故检测结果判定为阳性;EV71组荧光值为27.63±1.46,BSA组荧光值为24.71±1.81,结果均判定为阴性。结果提示本研究建立的检测方法特异性良好,可用于CA16的定性和定量检测。
2.6 临床样本检测结果 为了验证本实验建立的方法在临床样本检测中的准确性和实用性,按照已建立的检测方法构建CA16病原体检测试剂盒,使用该检测试剂盒检测16例感染CA16和其他肠道病毒的手足口病患者的粪便样本(表2),检测结果与临床标准检测方法qRT-PCR对比分析,经计算可得本方法的灵敏度为83.3%,特异度为100%,且检测方法与qRT-PCR法的一致率为93.75%(表3),说明本实验建立的检测方法可以应用于手足口病临床样本的检测。
3 讨 论
近年来,CA16型病原体手足口病的流行暴发引起了人们的广泛关注,由于针对CA16型病毒的疫苗尚未被研发应用,并且临床尚未开发出针对手足口病的特效药物[19],因此加强对CA16型病毒的高效、灵敏且特异的检测,对于控制其流行暴发,保护人群健康具有重要意义。由于传统的检测方法存在各种缺点,无法满足当今手足口病快速检测要求,因此开发一种高效准确的新检测方法是控制疾病流行的关键。
本研究对本课题组前期研究通过聚乙二醇沉淀

表2 16例不同类型肠道病毒感染的手足口病患者粪便样本检测结果Tab.2 Detection results of stool samples from 16 hand, foot and mouth disease patients with different enterovirus-infection
Note: Blank=22.28, 2.1×blank=46.7; “P” meaned positive test result; “N” meaned negative test result; “F” represented value of fluorescence intensity.

表3 FRET与qRT-PCR法检测16例不同类型肠道病毒感染的手足口病患者粪便样本的一致性Tab.3 Consistency of FRET method and qRT-PCR method in detection of stool samples from 16 hand, foot and mouth disease patients with different enterovirus infection
法[20]制备的CA16-IgY进行鉴定,并且通过静电自组装将IgY偶联至AuNPs表面制备可以特异性识别CA16的IgY-AuNPs,基于FRET技术,建立一种CA16型手足口病病原体快速检测新方法,结果显示:CA16-IgY纯度及特异度较好,效价高达1∶128 000,平均蛋白水平为12.15 mg·L-1,为下一步制备的可以特异性识别CA16的IgY-AuNPs提供了物质保障。通过UV-Vis、FTIR和TEM等方法对所制备的AuNPs及其生物探针的尺寸、形貌和性能进行表征,结果显示: IgY可以通过静电自组装偶联至AuNPs表面形成IgY-AuNPs;检测体系实验条件经优化,确定最佳IgY-AuNP浓度为0.52×10-3g·L-1,最佳NaCl用量为40 μL,荧光最佳恢复时间为90 min,在最优实验条件下,测定本方法的线性检测范围为1×104~ 2×106PFU·mL-1;根据检测体系荧光值与病毒浓度呈线性关系,计算得标准曲线为I525 nm=15.452 IgC-9.746,R2=0.993 2,判定检出限为1×104PFU·mL-1,且检测方法特异性良好,与EV71病毒无交叉反应;同时,该方法以试剂盒的形式对手足口病临床粪便样本检测,检测结果与临床标准检测方法qRT-PCR法对比分析,经计算可得本方法的灵敏度为83.3%,特异度为100%,且检测方法与qRT-PCR法的一致率为93.75%,表明本研究建立的检测方法可应用于临床样本的检测,为手足口病检测乃至其他病原体的检测奠定基础。

