茵杞调脂饮对非酒精性脂肪肝大鼠肝脏LXRα、CYP7A1 基因表达的影响
王俐钧,孙建光
(1.山东中医药大学,济南 250014 ;2.山东中医药大学附属医院,济南 250014)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)指除过量饮酒外其他因素引发的肝细胞脂肪变和脂质蓄积为特征的病理综合征,失治、误治则可能发展为肝炎、肝硬化、肝衰竭甚至肝癌。非酒精性脂肪肝的发病机制尚未明确,目前普遍认可的是“二次打击”学说,即肥胖、胰岛素抵抗导致糖脂代谢紊乱,进而发生氧化应激、脂质过氧化、线粒体损伤,细胞因子释放炎症介质。中医认为本病多由饮食不节、过度肥胖、情志失调等导致肝失疏泄、脾失健运,肾失气化,湿热、痰浊、瘀血丛生,膏脂堆积,阻滞肝络而成。研究[1]发现,NAFLD 与肥胖、脂代谢紊乱、高血压、糖尿病等代谢综合征相关。近年来,随着生活水平的提高及饮食结构的改变,肥胖人口迅速增加,与肥胖相关的NAFLD 发生率明显上升。他汀类药物如辛伐他汀在降低总胆固醇、三酰甘油方面显示出良好效果,但因其存在肌肉溶解、肝脏功损害、胃肠道不适等不良反应[2]。茵杞调脂饮系孙建光教授根据临床经验创制,前期研究[3-5]表明其在治疗NAFLD 方面有独特优势,但机制未明。本研究拟通过高脂饮食复制NAFLD 大鼠模型,探讨茵杞调脂饮作用机制。
1 材料与方法
1.1 实验动物 健康雄性SD 大鼠48 只,体质量150~190 g,由济南朋悦实验动物中心提供(合格证号:SCXK<鲁>2014-0007)。
1.2 药品及饲料 茵杞调脂饮方药组成:茵陈15 g,枸杞15 g,决明子15 g,生山楂15 g,瓜萎15 g,苍术12 g,薏米30 g,橘皮9 g,佩兰叶9 g,小蓟15 g,熟大黄3 g,生甘草6 g,由山东中医药大学附属医院煎药室水提、醇沉浓缩而成;辛伐他汀胶囊购自齐鲁制药有限公司,批号:S14200263233。高脂饲料由北京华阜康生物科技股份有限公司配置,参照本课题之前研究[6]成果,组成:基础饲料88%,猪油10%,胆固醇1.4%,胆盐0.6%。
1.3 检测试剂 三酰甘油测试盒等由上海茁彩生物科技有限公司提供;总胆固醇测定试剂盒等由南京建成生物工程研究所提供;RT-PCR 试剂盒由美国NEB 公司提供;Trizol 试剂由美国 Promega 公司提供。
1.4 方法
1.4.1 饲养条件 大鼠饲养于山东省千佛山医院实验室,室温(22±2)℃,湿度(55±5)%,自由饮水和进食。
1.4.2 造模及分组给药 大鼠适应性喂养1 周后随机分为6 组,正常组、模型组、茵杞调脂饮高、中、低剂量组及辛伐他汀阳性对照组,每组8 只。正常组给予普通饲料,余5 组给予高脂饲料。12 周后,正常组与模型组中分别选取1只,进行肝组织病理切片扫描,证实NAFLD 模型建成。茵杞调脂饮高、中、低剂量组分别按33.12 g/kg、16.56 g/kg、8.28 g/kg 的体质量标准灌胃(按成人用药每日159 g/60 kg 折算),西药组给予辛伐他汀以2.08 mg/kg 进行灌胃;正常组与模型组给予等量生理盐水,按1 mL/100 g 体质量计算。上述用药及生理盐水均1 次/d,治疗8 周。每周称1 次体质量,调整药量。
1.4.3 标本采集 用药8 周后,大鼠禁食12 h,10%水合氯醛腹腔麻醉,抽取腹主动脉血5 mL,离心10 min,测肝功、血脂等指标。摘取肝脏,取右叶新鲜组织,浸泡10%福尔马林固定液中,用于苏木精-伊红(HE)染色和油红O 染色;剩余部分置于于Ep 管中,-80 ℃超低温冰箱保存,用于检测肝组织指标。
1.5 检测方法 血清指标测定:采用全自动生化分析仪检测,此部分由山东中医药大学第一附属医学院检验科协助完成。病理学检测:福尔马林浸泡、固定肝脏标本,石蜡包埋、切片,行HE 染色、油红O 染色,在光镜下观察肝组织病变情况、脂肪含量及分布。肝组织指标测定:取肝组织100 mg,制成10%匀浆,离心,取上清液。严格按照说明书用RT-PCR 法检测肝组织LXRα、CYP7A1mRNA 表达。引物序列:GAPDH 上游5'-CTGGAGAAACCTGCCAAGTATG-3',下游5'-GGTGGAAGAATGGGAGTTGCT-3',138 bp;LXRα 上 游5'-CGAGCTATGCAGTGTATGTGGG-3',下游5'-ACACTCCTCCCTCATGCCTG-3',217bp;CYP7A1 上游5'-GGCATCTCAAGCAAACACCAT-3',下游5'-GCTGTGCGGATATTCAAGGAT-3',246 bp。扩增条件:95 ℃,15 s,40 个循环,60 ℃,60 s。
1.6 统计学方法 采用SPSS 17.0 软件对数据进行统计分析,计量资料以均数±标准差()表示,多组间比较采用方差分析,组间比较采用独立配对t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况 实验中茵杞调脂饮低剂量组大鼠死亡1 只,余正常。正常组大鼠体质量正常增长,皮毛整齐、光泽,精神状态佳,反应灵敏;模型组大鼠体质量增长较快,呈腹型肥胖体态,毛色泛黄、欠光泽,精神欠佳,反应迟钝;与模型组比较,用药组大鼠毛色、精神、体力均有所改善。
2.2 各组大鼠血清TG、TC 水平变化比较 见表1。
表1 各组大鼠血清TG、TC 水平变化比较() mmol/L

表1 各组大鼠血清TG、TC 水平变化比较() mmol/L
注:与空白组比较,## P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.3 各组大鼠血清HDL-C、LDL-C、FFA 测定结果比较 见表2。
2.4 对大鼠肝脏病理学的影响 HE 染色:空白组肝小叶结构完整清晰,肝窦正常,细胞核大而圆,位于中央,胞质均匀,未见脂肪空泡,无炎性细胞浸润。模型组大鼠肝小叶结构紊乱,肝窦狭窄,细胞核居边,细胞肿胀,呈气球样变,胞内可见大小不等的脂滴,大量炎细胞浸润。各用药组肝小叶结构较模型组改善,肝细胞变性、坏死、炎细胞浸润改善。其中以中药高剂量组改善最为明显,肝小叶轮廓略显清晰,细胞核形态基本规则,细胞数目增多,见图1。油红O 染色:正常组肝细胞内未见染红的脂肪沉积。模型组肝细胞内见大而圆的红色脂滴,分布密集,着色较重,部分脂滴连成片状。各用药组脂肪染色面积及浓度不同程度减轻,尤以中药高剂量组和辛伐他汀组变化最为显著,见图2。
2.5 对肝组织LXRα、CYP7A1 mRNA 表达的影响 与空白组比较,模型组大鼠肝组织LXRα mRNA 表达明显升高,CYP7A1 mRNA 表达明显降低(P<0.01);与模型组比较,各用药组大鼠肝组织LXRα 表达降低,CYP7A1 mRNA 表达升高(P<0.05);与辛伐他汀组比较,中药高剂量组LXRα mRNA 表达水平降低(P<0.05)。见图3,图4 和表3。
表2 各组大鼠血清HDL-C、LDL-C、FFA 测定结果比较() mmol/L

表2 各组大鼠血清HDL-C、LDL-C、FFA 测定结果比较() mmol/L
注:与空白组比较,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与辛伐他汀组比较,▲P<0.05
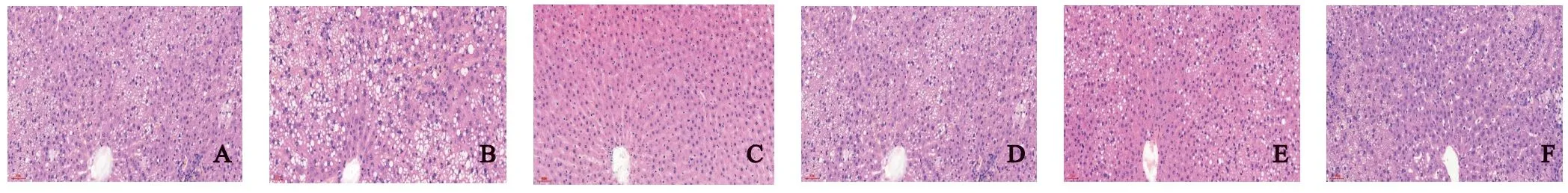
图1 茵杞调脂饮对NAFLD 大鼠肝组织HE 染色的影响(HE,×200)

图2 茵杞调脂饮对NAFLD 大鼠肝组织脂肪染色的影响(油红O,×200)

图3 各组大鼠肝组织LXRα 表达柱状图

图4 各组大鼠肝组织CYP7A1 mRNA 表达柱状图
表3 各组大鼠肝组织LXRα、CYP7A1 mRNA 相对表达量()

表3 各组大鼠肝组织LXRα、CYP7A1 mRNA 相对表达量()
注:与空白组比较,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与辛伐他汀组比较,▲P<0.05
3 讨论
茵杞调脂饮由12 味中药组成,方中茵陈、枸杞滋肾疏肝,以求治本;决明子、苍术、薏米消痰祛浊,山楂、小蓟、瓜蒌散滞行瘀,共治其标;加佩兰、橘皮芳香化湿理脾,大黄导湿热瘀浊从大便而出,生甘草解毒兼调和诸药。诸药合用,痰热瘀并治、脾肝肾同调,契合病机,故能奏效。
胆固醇7a-羟化酶(cholesterol 7-alpha hydroxylase,CYP7A1)属肝脏特异性微粒体细胞色素P450酶系,是胆汁酸合成代谢经典途径的限速酶,体内近50%的胆固醇通过CYP7AI 的催化转化为胆汁酸排出体外[7],其表达水平的高低反映出胆汁酸合成的快慢及机体清除胆固醇的能力。研究[8]发现给予7 周龄SD雄性大鼠乳酸发酵豆浆5 周,其肝组织CYP7A1mRNA表达较对照组显著增加(P<0.001),血清胆固醇水平显著降低(P<0.001)。当肝脏发生损伤时,肝非实质细胞如肝巨噬细胞、肝星状细胞可向肝细胞释放促炎细胞因子IL-6 等,这些细胞因子正是通过抑制CYP7A1 转录来抑制胆汁酸合成[9]。
LXRα 被称为胆固醇的感受器,可被特定的胆固醇氧化衍生物如22(R)-羟化胆固醇、24(S)-羟化胆固醇等激活[10],参与调控胆固醇逆转运。LXRα在脂肪的生成、氧化及炎症因子的产生等多环节发挥作用,因其结合于不同的靶基因上,可表现为相反的结果。它既可上调SREBP-1c、FAS 等基因表达,促进脂肪酸的从头合成,加重肝内脂质蓄积;又可上调CYP7A1、LPL 等基因表达,调节胆固醇代谢平衡,防止脂肪肝的进一步发展[11]。胆固醇转变成胆汁酸是体内胆固醇的主要清除途径,研究[12-13]表明当胆固醇及其代谢物在机体中累积,LXRα 被激活,诱导CYP7A1的表达。研究[14]认为中药复方可抑制NAFLD 动物模型中LXRα 的表达,进而下调靶基因SREBP-1c、FAS,阻止脂质沉积。此外,LXRα 被认为是抗炎因子,可以抑制炎症介质IL-6、TNF-α、MCP-1 等的表达,在炎症调控方面发挥重要作用[15]。
本实验中,NAFLD 模型组大鼠病理组织学显示脂肪变性及大量染红的脂肪沉积,血清TC、TG、LDL-C、FFA 及肝组织TC、TG、LXRαmRNA 升高,HDL-C、CYP7A1mRNA 表达降低,与正常组比较差异显著(P<0.01)。大鼠血清FFA 过多,吸收入肝的脂类增加,肝细胞TC、TG 蓄积,脂质代谢紊乱,诱导氧化应激反应引发肝脏损伤。肝脏的应激作用刺激氧固醇受体LXRα,在一定程度上提高CYP7A1活性[16],有利于胆固醇稳态的维持。但长期喂食高脂饮食,大鼠肝内胆固醇聚集、内源性胆汁酸堆积,对CYP7A1表现出负反馈调节,使CYP7A1 表达出现抑制而不是上调[17-18],胆固醇转化成胆汁酸的能力削弱,肝细胞内胆汁酸淤积,肝细胞损伤。与此同时,脂肪酸合成过多但氧化不足、载脂蛋白代谢障碍,LXRα 代偿性增加,激活相应靶基因,生成大量脂肪酸[19],引起肝细胞脂肪变性,出现LXRα 和CYP7A1 mRNA 表达出现分离的状态。服用不同浓度的茵杞调脂饮之后,肝组织LXRα mRNA 表达有所降低,CYP7A1 mRNA 表达有所升高,结合血脂、肝脂指标的改善,说明在药物的调治作用下,LXRα、CYP7A1 mRNA 表达水平逐渐恢复,二者的靶向调节关系重新趋于正常,激活下游与胆固醇和脂质稳态有关的基因,降低脂代谢相关蛋白酶活性,LDL-C 降低,体内运输至肝脏的胆固醇减少[20],HDL-C 升高,将肝脏中的磷脂和胆固醇转运出去,阻止脂质的沉积,抑制线粒体功能紊乱及胰岛素抵抗而对肝脏起保护作用,肝细胞得以修复,TC、TG 水平几近正常。
综上所述,茵杞调脂饮通过调节LXRα、CYP7A1 mRNA 表达,可调控体内脂肪合成,改善血脂、肝脂及肝组织病理变化,缓解NAFLD 进展。茵杞调脂饮具有中医调理的特色和优势,可整体治疗、标本兼治,临床疗效优于单纯降脂药物,该药应用安全性高,具有较好的应用前景。但其具体作用机制仍需进一步研究。

