Apelin-13通过eNOS/NO促进糖尿病小鼠主动脉细胞焦亡相关蛋白的表达
王炀佳,张 佳,李 宾,曾翔俊
(首都医科大学 生理学与病理生理学系,北京 100069)
血管并发症是2型糖尿病患者发病率和病死率的主要原因,血管并发症的主要发病机制与高血糖导致氧化应激和炎性反应增加密切相关[1]。糖尿病导致的血管壁内炎性反应可以引起血管内皮细胞和平滑肌细胞死亡、增殖、迁移和黏附分子蛋白异常表达等[2]。近年的研究表明炎性反应与细胞焦亡的发生密切相关[3]。细胞焦亡又称细胞炎性坏死,是一种独特的依赖于caspase-1[4]的新型细胞死亡方式,其特征在于细胞会不断胀大直至胞膜破裂,同时伴随强烈的炎性反应[5]。
焦亡作为细胞死亡的一种方式与其他类型的细胞死亡具有一定的联系,而之前的研究发现,血管活性多肽apelin参与心血管系统中细胞坏死、凋亡、自噬及炎性反应[6-7]。Apelin可介导内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的激活,通过eNOS途径产生的NO对许多内皮细胞功能起到重要作用[8],同时还可以通过eNOS调节心肌细胞凋亡及坏死的发生发展[9]。那么,糖尿病发病过程中,血清中增加的apelin是否通过eNOS/NO途径影响糖尿病小鼠血管壁细胞焦亡,从而影响血管结构及功能呢?
本研究通过观察apelin-13及L-NAME对糖尿病小鼠主动脉壁细胞焦亡相关蛋白表达的影响,探讨apelin是否通过其下游信号通路eNOS/NO影响糖尿病引起的血管壁细胞焦亡。
1 材料与方法
1.1 材料
1.1.1 动物:野生雄性C57/BL小鼠(SPF级,8周龄)作为正常对照组,体质量22~25 g(北京维通利华实验动物技术有限公司)。雄性kkAy小鼠(糖尿病小鼠,SPF级,8周龄),体质量25~30 g(北京华阜康实验动物技术有限公司)。
1.1.2 药品与试剂:apelin-13(Santa Cruz公司,规格为1 mg);Nω-nitro-L-arginine methyl ester hydrochloride(L-NAME)(Sigma-Aldrich公司);植入式渗透压泵管(北京西美杰科技有限公司);免疫组织化学染色试剂盒(上海基因科技有限公司);小鼠糖化血红蛋白(GHbA1c) ELISA试剂盒(武汉华美生物工程有限公司);重组兔单克隆caspase-1抗体和重组兔单克隆NLRP3抗体(华安生物公司);Gasdermin D抗体(Cell Signaling Technology公司)。
1.2 方法
1.2.1 动物的分组及处理:对照组小鼠(C57/BL小鼠),糖尿病小鼠(kkAy小鼠),apelin-13处理糖尿病小鼠组[kkAy小鼠皮下埋植缓释泵持续灌注apelin 14 d,剂量为30 μg/(kg·d)]和apelin-13与L-NAME共同处理糖尿病小鼠组[apelin灌注kkAy小鼠的同时,腹腔注射L-NAME,剂量为10 mg/(kg·d)]。
1.2.2 检测随机血糖和糖化血红蛋白:尾静脉取血测随机血糖,取全血,并分离血清和血细胞,反复冻融法使红细胞碎裂,ELISA试剂盒测定糖化血红蛋白值。
1.2.3 检测血压:用无创尾压法检测各组小鼠处理前后的血压值。
1.2.4 HE染色观察主动脉形态学变化:常规制片,HE染色,光学显微镜下观察主动脉组织形态学的变化。
1.2.5 免疫组织化学染色分析主动脉中eNOS及NLRP3、caspase-1、gasdermin D的表达:60 ℃烤片20 min,脱蜡至水,0.01 mol/L柠檬酸修复液进行抗原修复;3% H2O2溶液避光孵育10~15 min;血清封闭30 min;加一抗(eNOS,兔来源,1∶200;NLRP3,兔来源,1∶200;caspase-1,兔来源,1∶400;gasdermin D,兔来源,1∶200),37 ℃孵育2 h;室温静置30 min,二抗(驴抗兔,1∶200),室温孵育30 min;光学显微镜下DAB显色;苏木精染核1 min,盐酸乙醇分化1 s;梯度脱水透明,中性树胶封片。采用Image Pro Plus 3图像分析软件,计算阳性区域面积占血管总面积的比例。
1.3 统计学分析
2 结果
2.1 随机血糖和糖化血红蛋白的结果
与对照组相比,糖尿病小鼠、apelin-13处理组小鼠和apelin-13和L-NAME共同处理组小鼠的随机血糖明显升高(P<0.05)。糖尿病小鼠的糖化血红蛋白值明显高于对照组(P<0.05)(图1)。
2.2 血压测量的结果
与对照组相比,糖尿病小鼠的收缩压和舒张压明显升高(P<0.05);给apelin-13后收缩压明显下降(P<0.05)(图2)。

C57.control group; kkAy.diabetes group; A.radom blood glucose of each group; B.HbA1c in C57 and kkAy group of mice;*P<0.05 compared with control group
图1 各组小鼠的随机血糖值及对照组和糖尿病组小鼠的糖化血红蛋白值
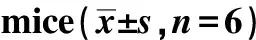
A.C57 was control group; kkAy was diabetes group,changes of systolic blood pressure before and after treatment in each group of mice were performed; B.changes of diastolic blood pressure before and after treatment in each group of mice were performed;*P<0.05 compared with control group;#P<0.05 compared with diabet mice group
2.3 主动脉形态学改变
与对照组相比,糖尿病小鼠主动脉内皮细胞排列紊乱,血管平滑肌细胞肥大、扭曲、弹力纤维排列紊乱、细胞核大小不一,细胞膜及胞核不清晰、不完整,胞质染色不均,可见肌纤维断裂;与糖尿病组小鼠相比,apelin-13处理组、apelin-13和L-NAME共同处理组,糖尿病小鼠的主动脉弹力纤维和内皮细胞排列紊乱没有明显改变(图3)。
2.4 主动脉中eNOS、NLRP3、caspase-1及gasdermin D的表达
与对照组相比,糖尿病组小鼠主动脉eNOS表达升高170%(P<0.05),与糖尿病组小鼠相比,apelin-13处理后,小鼠主动脉eNOS表达进一步升高118%(P<0.05),与apelin-13处理组相比,给予apelin-13和L-NAME共同处理后,糖尿病小鼠主动脉eNOS表达减少25%(P<0.05)。
与对照组相比,糖尿病组小鼠主动脉焦亡相关蛋白表达升高(NLRP3:160%,P<0.05;caspase-1:141%;gasdermin D:109%);与糖尿病组小鼠相比,Apelin-13处理后,糖尿病小鼠主动脉焦亡相关蛋白表达进一步升高(NLRP3:67 %,P<0.05;caspase-1:44%,P<0.05;gasdermin D:115%,P<0.05);与apelin-13处理组相比,给予apelin-13和L-NAME共同处理后,糖尿病小鼠主动脉焦亡相关蛋白表达减少(NLRP3:48 %,P<0.05;caspase-1:46%,P<0.05;gasdermin D:75%,P<0.05)(表1,图4)。
3 讨论
Apelin是从牛胃的分泌物中分离并提取一种小分子活性肽,是G蛋白耦联受体APJ(putative receptor related to AT1)的内源性天然配体,在2型糖尿病的发生发展中起着重要的作用。并且apelin-13在血管内皮中分布尤为广泛[10],属于血管源性活性肽,其作用于APJ受体,可通过调节细胞坏死、凋亡、自噬和炎性反应等参与各种疾病的发展[7,11]。同时研究发现,糖尿病患者及动物血清中apelin浓度明显增加[12],那么apelin是否参与糖尿病血管结构损伤的发生发展呢?
表1 免疫组织化学染色观察小鼠主动脉eNOS、NLRP3、caspase-1和gasdermin D的表达
*P<0.05 compared with control group;△P<0.05 compared with diabetes group;#P<0.05 compared with the group treatment with apelin-13.

C57.control group; kkAy.diabetes group; the arrows indicated areas of positive staining;L.Lumen
本研究发现,与对照组小鼠相比,kkAy小鼠的随机血糖和糖化血红蛋白(HbA1c)值明显升高,说明kkAy小鼠具有典型的糖尿病特征,可作为糖尿病模型小鼠使用,apelin 处理后,糖尿病小鼠血糖无明显变化。Apelin处理可以明显降低糖尿病小鼠的收缩压,而L-NAME可以拮抗apelin降低糖尿病小鼠收缩压的作用。这些结果与报道一致[13],提示apelin可能通过eNOS/NO途径影响糖尿病小鼠的血管功能,进而影响糖尿病小鼠的血压。那么eNOS/NO是否也通过影响血管壁细胞的结构介导apelin对糖尿病小鼠血管功能的影响呢?
本研究通过HE染色观察apelin对血管结构的影响,结果发现:与糖尿病组小鼠相比,给予apelin及L-NAME处理后,糖尿病小鼠血管结构损伤无明显改变。这一结果与报道不尽相同[14],这可能是由于观察时间较短,从而不能观察到明显的结构改变。那么,apelin对糖尿病小鼠早期血管功能的影响是否存在其他机制呢?近年研究发现,高糖等刺激可以引起血管壁内皮细胞和平滑肌细胞发生焦亡,从而导致血管结构和功能损伤[15]。那么,apelin对小鼠血管功能的影响是否与血管壁内细胞焦亡有关呢?
本研究通过观察apelin对糖尿病小鼠主动脉壁细胞内NLRP3、caspase-1、gasdermin D三种蛋白的表达的影响,分析apelin对糖尿病小鼠主动脉血管细胞焦亡相关蛋白表达的影响及其与血管结构损伤的关系。
结果发现,糖尿病小鼠主动脉中焦亡相关蛋白的表达增多,外源性给予apelin-13后,可观察到焦亡相关蛋白(NLRP3、caspase-1、gasdermin D)的表达进一步增多,说明糖尿病小鼠体内增加的apelin-13可能是引起糖尿病小鼠血管壁细胞内焦亡相关蛋白表达增加的因素之一。内皮一氧化氮合酶及其催化产生的NO是apelin调节血管结构和功能的重要分子机制之一,那么eNOS/NO是否介导apelin引起的糖尿病血管细胞焦亡相关蛋白的表达呢?
本研究发现,apelin可以增加糖尿病小鼠主动脉中eNOS的含量,而当利用L-NAME抑制eNOS催化产生NO之后,apelin不再具有增加糖尿病小鼠主动脉壁细胞焦亡相关蛋白的表达(NLRP3、caspase-1、gasdermin D)的效应。这些结果提示,eNOS/NO介导了apelin对糖尿病小鼠主动脉壁细胞焦亡相关蛋白表达的过程。
综上所述,apelin增加糖尿病小鼠主动脉壁细胞焦亡相关蛋白的表达,其机制可能与上调内皮细胞中eNOS/NO途径有关。因此,apelin及其下游信号分子eNOS/NO途径导致的血管壁内细胞焦亡可能成为治疗糖尿病血管损伤的靶点。

