芳樟醇气相抗菌活性与作用机制
吴克刚,赵欣欣,段雪娟,柴向华,于泓鹏,刘晓丽,范宇婷
(1.广东工业大学轻工化工学院,广东 广州 510006;2.广州市香思馨情健康科技有限公司,广东 广州 510006;3.河南工业大学 河南粮食作物协同创新中心,河南 郑州 450001)
芳樟醇,又名沉香醇、胡荽醇、芫荽醇、沉香油醇、伽罗木醇、里那醇等,是一种无色液体,作为一种单离香料广泛存在于香紫苏精油、胡荽籽精油(芫荽油)、芳樟叶精油、芳樟木精油、黄樟精油等植物精油中。天然芳樟醇气味纯正、圆和、甜润、幽雅,具有类似铃兰、百合花样的香气[1],同时具有抗菌、抗病毒、镇静、驱虫和杀虫等功效[2-6],因而可将其应用于空气清新杀菌剂等领域。现用的消毒剂、杀菌剂和空气清新剂等基本上都是人工合成的物质,在消毒、杀菌、清新空气的同时也会对人体造成一定的危害,并且气味不理想[7],而芳樟醇具有绿色、安全、高效、留香等特点,符合当下的趋势。
目前,国内外学者对植物精油抗菌活性成分及其作用机制开展了大量研究,主要是从菌体微观形态、细胞膜通透性、新陈代谢等方面的变化来认识植物精油液相接触抗菌的作用机理[8-14],而关于芳樟醇的气相抗菌活性及其作用机制的研究不多。大肠杆菌(Escherichia coli)是人和动物肠道中最常见的一种细菌,作为细菌的模式生物被广泛用于科学研究。为此,本实验以大肠杆菌为供试菌,研究芳樟醇的气相抗菌活性,通过观察菌体微观结构、细胞膜通透性的变化来探讨其抗菌机制,为植物精油成分气相抗菌活性的研究提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌ATCC 25922由广东出入境检验检疫局检验检疫技术中心提供。将菌株于营养肉汤中37 ℃活化24 h,平板划线分离单个菌落,挑取单个菌落用麦氏比浊管配制成0.5麦氏单位(约1.5h 108CFU/mL)的菌悬液,备用。
营养琼脂、缓冲蛋白胨 广东环凯微生物科技有限公司;芳樟醇(98%,质量分数,下同) 阿拉丁试剂(上海)有限公司;百里香酚(99%)、丁香酚(99%)、茴香脑(99%)、柠檬醛(95%)、柠檬烯(90%)、香叶醇(98%)、香茅醇(99%)、香茅醛(99%)、香芹酚(95%)和大茴香醛(99%) 国药集团化学试剂有限公司;1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、丙烯酰胺和双丙烯酰胺 美国Sigma公司;牛血清白蛋白 广东 光华化工有限公司;蛋白酶K 北京普博欣生物技术科技有限公司;考马斯亮蓝G-250 上海伯奥生物科技有限公司;花生油 山东鲁花集团有限公司;Ezup柱式细菌基因DNA抽提试剂盒 生工生物工程(上海)有限 公司;其他试剂均为国产分析纯。
1.2 仪器与设备
KDC-160HR高速冷冻离心机 科大创新股份有限公司中佳分公司;FluoroMax-4荧光光谱仪 法国HORIBA Jobin Yvon公司;JSM-6360LV扫描电子显微镜 日本电子株式会社;LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司;S-3000N型扫描电子显微镜、H-7650型透射电子显微镜 日本日立公司;EM UC6超薄切片机 德国Leica公司;DDS-307T型电导率仪 上海智光仪器仪表有限公司;UV-2450紫外-可见分光光度计 日本岛津公司;HP6890气相色谱仪(配5973质谱检测器) 美国安捷伦科技有限公司。
1.3 方法
1.3.1 单离香料气相熏蒸大肠杆菌及最低抑菌浓度和最低杀菌浓度的测定
参考Lopez等[15]的气相挥发实验,在已冷却至室温的培养基上加入0.1 mL上述菌悬液,用三角玻璃涂棒涂匀,待菌液完全吸收后将培养板倒置,按设定的空间含量将各单离香料的稀释液(丙二醇稀释)滴加在各培养皿的皿盖中央,封口膜密封并于37 ℃的生化培养箱中倒置培养24 h,观察平板长菌情况。以完全不长菌的平板所对应的最低浓度为最低抑菌浓度(minimum inhibitory concentration,MIC)。完全不长菌的平板无菌更换新的培养皿皿盖继续培养24 h,仍然不长菌的平板对应的最低浓度为最低杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.2 大肠杆菌表面疏水性分析
采用ANS荧光探针法分析表面疏水性来了解大肠杆菌细胞壁完整性。用10 mL磷酸盐缓冲液(pH 7.4)收集经芳樟醇处理过的菌体,用分光光度计将各菌悬液调OD600nm至0.500f 0.005。参照Thennarasu等[16]的方法,取2.5 mL菌悬液和0.5 mL ANS溶液(终浓度为6.67 mmol/L) 加入反应试管中,振荡混匀,用荧光光谱仪在激发波长380 nm处测定发射波长400~600 nm范围内的荧光光谱,激发和发射狭缝宽度均为5 nm。
1.3.3 大肠杆菌超显微结构观察
取正常培养和经200 μL/L芳樟醇处理24 h的大肠杆菌含菌平板,参照Tyagi等[17]的方法固定样品,通过扫描电子显微镜和透射电子显微镜来观察大肠杆菌超显微结构。
1.3.4 电导率分析
取正常培养和经芳樟醇处理的大肠杆菌含菌平板,用无菌水收集菌体,用分光光度计将各菌悬液调OD600nm至1.000f 0.005,用电导率仪测各菌悬液电导率。
1.3.5 紫外吸收的测定
参考Hammer等[18]的方法,取10 mL OD600nm为1.0的菌悬液在11 000 r/min条件下离心10 min,取3 mL上清液,用紫外分光光度计在260 nm波长处测定OD值。
1.3.6 大肠杆菌DNA电泳分析
取1.5 mL OD600nm为0.5的菌悬液,按DNA提取试剂盒操作在8 000 r/min条件下离心2 min,弃上清液,提取菌体内的DNA,以Tris-硼酸缓冲液配制质量分数0.8%凝胶(加入0.06%的GoldView染料),潜水点样,100 V稳压电泳30 min,于紫外凝胶图像分析仪下观察DNA条带亮度的变化,拍照并分析结果。
1.3.7 可溶性蛋白质量浓度的分析
以牛血清白蛋白为标准蛋白绘制标准曲线,标准蛋白质含量和吸光度之间的回归方程为:y=6.376 4x(R2=0.991 2)。取10 mL OD600nm为1.0的菌液于7 000 r/min离心10 min。参照Bradford[19]的方法,取0.3 mL上清液并将其稀释至1 mL,加入5 mL考马斯亮蓝G-250显色液(含体积分数0.01%考马斯亮蓝G-250、4.7%乙醇、8.5%磷酸),振荡混匀,5 min后测其在595 nm波长处的吸光度,根据标准曲线计算出相应样品的蛋白质量浓度。
1.3.8 SDS-PAGE分析
取3 mL上述OD600nm为0.5的菌悬液,参考He Feng等[20]的方法,12 000 r/min离心10 min取沉淀物,悬于50 μL的TE缓冲液中,按体积比1∶1加入50 μL上样缓冲液,于沸水浴中煮沸5 min,12 000 r/min离心5 min,取50 μL上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)。
1.3.9 荧光光谱分析
参考Ye Xiaoli等[21]的方法,取3 mL上述OD600nm为0.5的菌悬液,在激发波长285 nm处测定发射波长在300~500 nm范围内的荧光光谱,激发和发射狭缝宽度均为5 nm,进行荧光光谱分析。
1.3.10 脂肪酸组成分析
取正常培养和经芳樟醇处理的大肠杆菌含菌平板,无菌水收集菌体,参照杜春明等[22]的方法制备样品。GC条件:程序升温(初始温度50 ℃,保持1 min;以 25 ℃/min的速率升温到200 ℃,保持1 min;再以 3 ℃/min的速率升温到230 ℃,保持18 min,进样口温度250 ℃);载气为高纯氦气,流速为1 mL/min;进样量为1 μL,分流比20∶1。质谱条件:电离方式为电子轰击,电子能量70 eV;离子源温度:230 ℃;四极杆温度: 150 ℃;扫描范围10~800 amu,进行脂肪酸分析。通过计算机检索,与质谱库提供的标准质谱图对照,对脂肪酸成分进行鉴定;用自动积分法算出各峰的峰面积,用面积归一化法计算各脂肪酸成分的相对含量。
1.4 数据处理与分析
每个样品重复3 次实验,用SPSS 20.0软件对实验数据进行分析,采用GraphPad Prism软件作图,其中电导率、可溶性蛋白质量浓度等以平均值±标准差表示。
2 结果与分析
2.1 芳樟醇对大肠杆菌气相抗菌活性的研究
2.1.1 芳樟醇气相抗菌活性与几种单离香料的对比
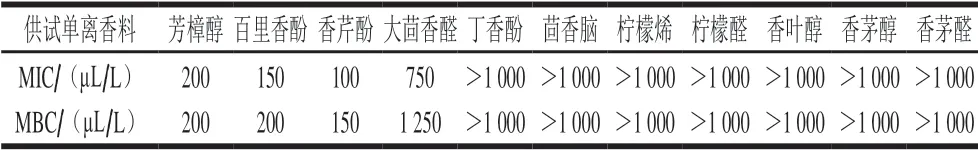
表 1 单离香料对大肠杆菌抗菌活性的比较Table 1 Comparison of antibacterial activity of isolate aroma compounds against E. coli
气相熏蒸法得到的各单离香料对大肠杆菌的MIC和MBC如表1所示。由实验结果可知,除丁香酚、茴香脑、柠檬烯、柠檬醛、香叶醇、香茅醇和香茅醛在1 000 μL/L时没有表现抗菌效果外,芳樟醇、香芹酚、百里香酚和大茴香醛对大肠杆菌均具较好的抗菌效果,抗菌能力大小依次为:香芹酚>百里香酚>芳樟醇>大茴香醛。芳樟醇的抗菌作用虽然稍弱于香芹酚和百里香酚,但优于其他几种单离香料。段雪娟[23]、王新伟[24]等采用直接接触法研究发现百里香酚和香芹酚对大肠杆菌具有很好的抗菌活性,但茴香脑、柠檬醛也具有较好的抗菌活性,这与本实验气相熏蒸法得到的结果有所不同,主要是因为精油成分的气相抗菌活性还与其溶解性、挥发速率等因素有关[25]。
2.1.2 溶剂对芳樟醇气相抗菌活性的影响

表 2 不同溶剂稀释的芳樟醇对大肠杆菌抑菌作用的比较Table 2 Comparison of antimicrobial activity of different concentrations of linalool in different solvents against E. coli
由表2可知,不同溶剂稀释的芳樟醇熏蒸对大肠杆菌的生长产生了不同的抑制效果,冰乙酸稀释的芳樟醇抑菌效果最强,当空间含量为100 μL/L时,就能完全抑制大肠杆菌的生长;其次为丙二醇和无水乙醇稀释的芳樟醇,当空间含量达到200 μL/L能完全抑制大肠杆菌的生长;然而以花生油为溶剂稀释的芳樟醇当空间含量达到250 μL/L时依然未显示抑菌效果。
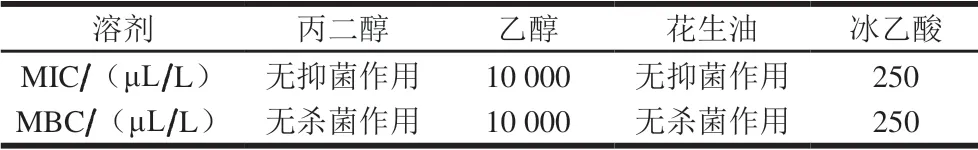
表 3 不同溶剂对大肠杆菌抗菌作用的比较Table 3 MIC and MBC of linalool in different solvents against E. coli
由表3可以看出,稀释溶剂冰乙酸对大肠杆菌具有较强的抗菌作用,空间含量达到250 μL/L时就能对大肠杆菌产生抑菌、杀菌作用;乙醇空间含量要达到10 000 μL/L 才能产生抑菌、杀菌效果;而丙二醇和植物油对大肠杆菌均没有显示出抗菌作用。用冰乙酸和乙醇作为稀释溶剂时会对芳樟醇的抗菌效果产生一定的干扰;植物油为溶剂时对芳樟醇的抗菌能力具有抑制作用,因此丙二醇作为芳樟醇的溶剂较为适宜。
2.2 芳樟醇对大肠杆菌细胞壁与细胞膜结构的影响
2.2.1 芳樟醇对细胞壁的影响
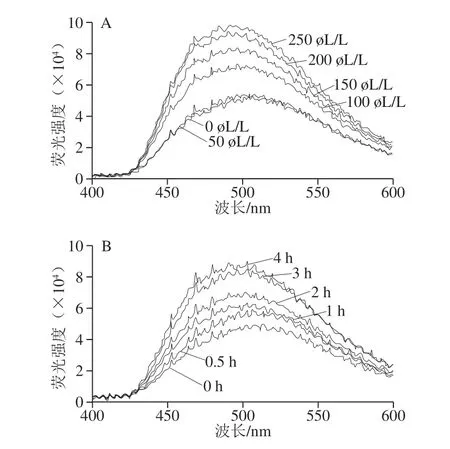
图 1 芳樟醇处理对大肠杆菌表面疏水性的影响Fig. 1 Effect of linalool treatment on surface hydrophobicity of E. coli
由图1可以看出,随着芳樟醇含量的增加和处理时间的延长其诱导的荧光强度均大幅度增加,同时最大荧光强度发生红移,说明芳樟醇气相处理导致大肠杆菌表面疏水性增加,也就是与探针ANS结合的疏水区域增多了,这表明芳樟醇破坏了大肠杆菌细胞壁,使得细胞膜上越来越多的脂类疏水性磷脂双分子层区域暴露出来。Thennarasu等[16]的研究也发现大肠杆菌经过缩氨酸处理后ANS荧光强度增强,最大吸收峰发生部分蓝移。
2.2.2 芳樟醇对大肠杆菌超显微结构的影响
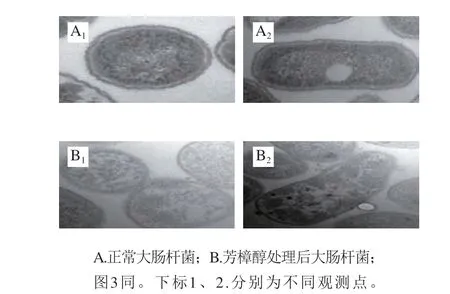
图 2 芳樟醇处理前后大肠杆菌的透射电子显微镜图(×60 000)Fig. 2 TEM images of E. coli before and after linalool treatment (× 60 000)

图 3 芳樟醇处理前后大肠杆菌的扫描电子显微镜图Fig. 3 SEM images of E. coli before and after linalool treatment
透射电子显微镜图显示正常大肠杆菌细胞壁与细胞膜结构完整、紧密相贴、胞浆浓密、均匀分布(图2A1和2A2);经芳樟醇处理后,菌体胞壁和细胞膜边缘模糊,出现溶解破裂,胞浆变得稀疏、不均匀分布,甚至出现局部凝结(图2B1和2B2)。扫描电子显微镜图显示正常的大肠杆菌呈完整的短棒状或短圆柱状,菌体饱满、充盈、表面圆润光滑(图3A);经芳樟醇处理后大肠杆菌菌体表面变得不光滑,呈现皱缩、干瘪状态 (图3B)。具有抗菌活性的植物精油成分,其由于疏水性更易作用于细胞膜,破坏细胞膜的完整性,从而使细胞膜的通透性大大增强,使细胞内的一些物质泄漏,并导致菌体死亡[26-27]。从实验结果来看,芳樟醇不仅破坏了大肠杆菌的细胞壁,也破坏了细胞膜,导致大肠杆菌胞内物质泄漏,从而呈现皱缩、干瘪状态。
2.3 芳樟醇对大肠杆菌细胞膜通透性的影响
2.3.1 芳樟醇对大肠杆菌胞内小分子物质泄漏的影响
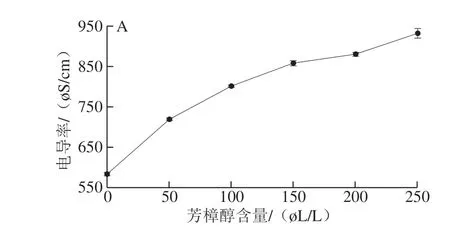
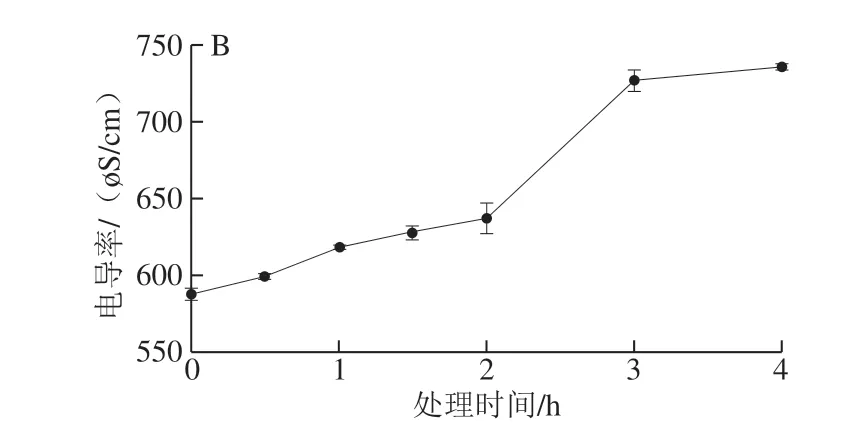
图 4 芳樟醇处理对大肠杆菌菌液电导率的影响Fig. 4 Effect of linalool treatment on electric conductivity of E. coli suspension
菌体的细胞壁损伤以及细胞膜通透性增加会导致一些钾盐、磷酸盐等小分子释放出,使菌液电导率升高。由图4可知,菌液的电导率随着芳樟醇含量增加和处理时间延长而增大。芳樟醇与大肠杆菌作用的前2 h内,电导率增加缓慢,2~3 h期间增加快速,之后趋于平缓。Kong Ming等[27]研究壳聚糖对大肠杆菌的抗菌作用也发现菌液电导率增加,细胞内物质泄漏现象。
2.3.2 芳樟醇对大肠杆菌核酸类物质泄漏的影响
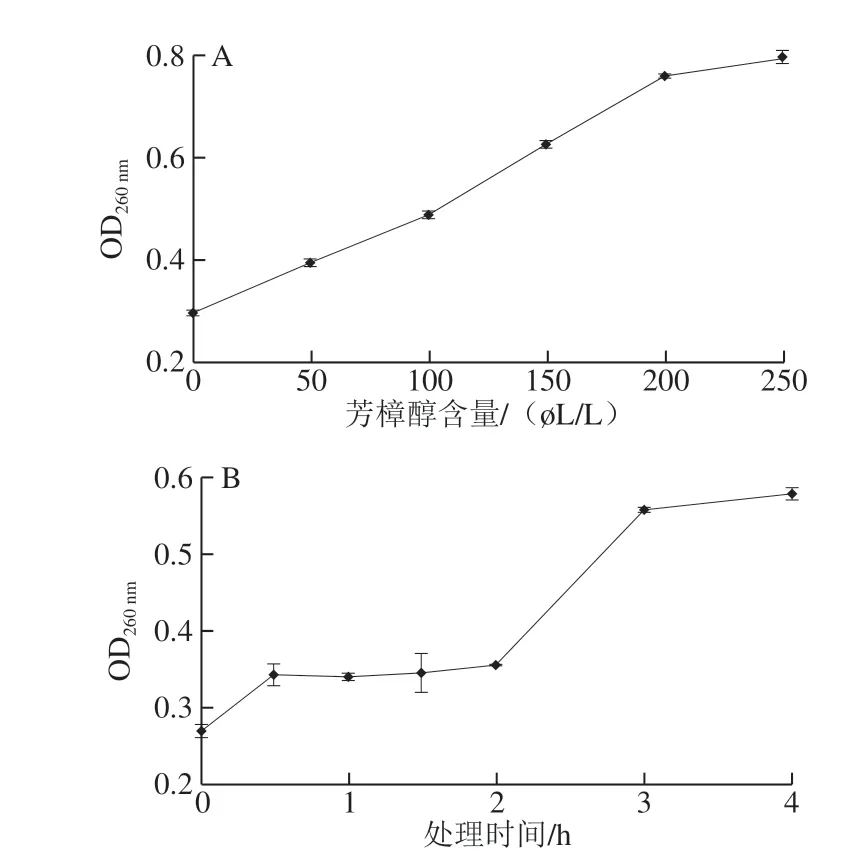
图 5 芳樟醇处理对大肠杆菌菌液OD260 nm值的影响Fig. 5 Effect of linalool treatment on OD260 nm of E. coli suspension
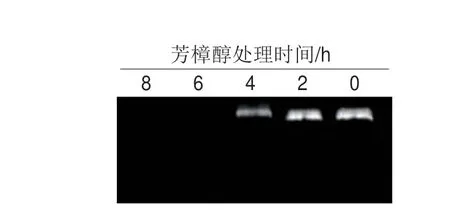
图 6 芳樟醇处理对大肠杆菌胞内DNA含量的影响Fig. 6 Effect of linalool treatment on DNA content of E. coli
细胞膜严重破损时不仅小分子泄漏,DNA、RNA等大分子物质也会大量外泄,导致菌液OD260nm升高。由图5可知,菌液OD260nm随着芳樟醇含量的增加和处理时间的延长而升高,芳樟醇含量超过200 μL/L后,OD260nm趋于稳定;芳樟醇作用前2 h内,OD260nm增加缓慢,2~3 h快速增加,之后趋于平缓。Devi等[9]研究丁香酚处理异变形杆菌时,也发现菌体表面被溶解和出现非选择性孔洞,导致核酸大分子物质泄漏。
如图6所示,在细菌总量相同的情况下,随着芳樟醇处理时间延长菌体内DNA量越来越少,以至于到6 h之后已经检测不到DNA,可能是在芳樟醇的长时间作用下,由于细胞膜严重破损导致DNA大量泄漏。
2.3.3 芳樟醇导致大肠杆菌蛋白质大分子物质泄漏的影响
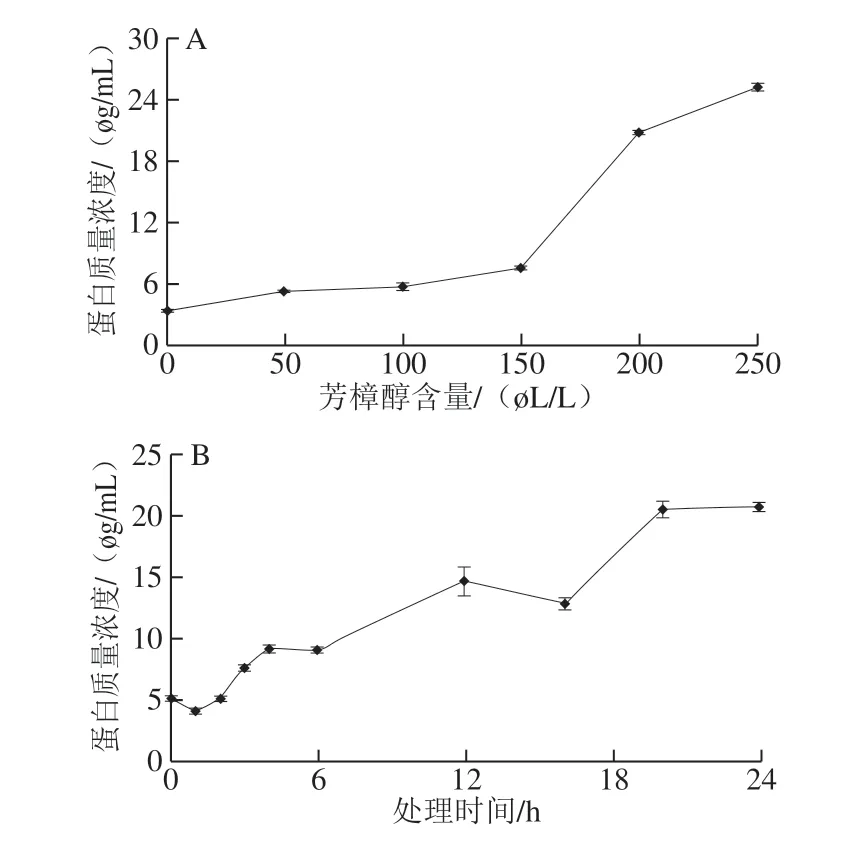
图 7 芳樟醇处理对大肠杆菌可溶性蛋白质量浓度的影响Fig. 7 Effect of linalool treatment on soluble protein content of E. coli
由图7可知,菌液中的可溶性蛋白质量浓度随芳樟醇含量增加和处理时间的延长而增大。在空间含量低于150 μL/L时,菌液可溶性蛋白质量浓度增加幅度较小,当含量达到MIC时,可溶性蛋白质量浓度迅速增加。可溶性蛋白质量浓度随处理时间的延长而逐渐增大,20 h之后可溶性蛋白质量浓度趋于稳定。这进一步证明芳樟醇处理后菌体细胞的通透性增强,造成可溶性蛋白质渗出。

图 8 芳樟醇处理对大肠杆菌菌体总蛋白质的影响Fig. 8 Effect of linalool treatment on total proteins of E. coli
如图8所示,随着芳樟醇与大肠杆菌作用时间延长,蛋白质条带逐渐减少,颜色逐渐变浅,部分蛋白质条带甚至消失。表明经过芳樟醇处理,菌体内部的蛋白质可能被部分分解或泄漏,而导致菌体内的总蛋白质含量和种类变少。Devi等[9]研究发现异变形杆菌经过丁香酚处理后膜的完整性破坏,蛋白质泄漏;钱丽红等[28]研究表明茶多酚能够影响金黄色葡萄球菌内蛋白质的表达,处理后大多数蛋白质条带变浅甚至消失。
2.4 芳樟醇对大肠杆菌菌体蛋白三级结构的影响
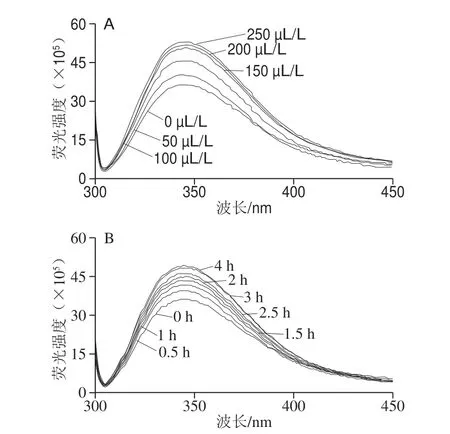
图 9 芳樟醇处理对大肠杆菌荧光强度的影响Fig. 9 Effect of linalool on fluorescence intensity of E. coli
大肠杆菌菌膜的主要成分为蛋白质,组成蛋白质的苯丙氨酸、酪氨酸和色氨酸残基可以产生荧光,当这些残基在蛋白质中的位置发生改变时,荧光强度也会发生改变,通过荧光强度和峰位的变化可以反映蛋白质三级结构的变化。如图9所示,大肠杆菌菌液荧光强度随着芳樟醇含量增加和处理时间延长呈不同程度的增强。表明芳樟醇与大肠杆菌膜蛋白发生反应,使大肠杆菌蛋白内源荧光强度变化而引起了蛋白质三级结构的改变,提高芳樟醇处理含量和延长处理时间有利于大肠杆菌蛋白分子充分伸展,暴露出更多的生色基团,导致荧光强度随之增强。Kong Ming等[27]的研究也证明抗菌物质能够影响大肠杆菌上膜蛋白结构,可能是与蛋白质发生相互作用。
2.5 芳樟醇对大肠杆菌脂肪酸组成的影响
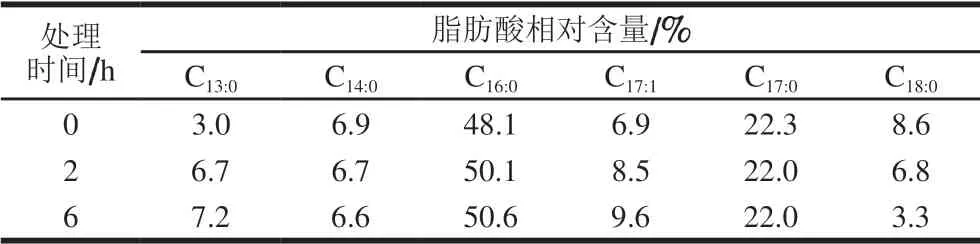
表 4 芳樟醇对大肠杆菌脂肪酸相对含量的影响Table 4 Effect of linalool vapor treatment time on fatty acid composition of E. coli
由表4可知,大肠杆菌经芳樟醇处理后,其菌体细胞脂肪酸的含量随着作用时间的延长呈现出规律性的变化,C13:0和C17:1相对含量随着处理时间的延长而增多,其中C13:0相对含量增加较为明显;C18:0相对含量随处理时间的延长而减少。吕飞[29]的研究也证明复合精油处理后酿酒酵母体内不饱和脂肪酸C14:1和C13:0相对含量明显升高。可见,大肠杆菌经芳樟醇气相处理后通过合成长链饱和脂肪酸减少、不饱和脂肪酸以及较短链脂肪酸增多来维持细胞膜的流动性,同时也提高了细胞膜的通透性,使胞内物质更易泄漏出来。
3 结 论
芳樟醇具有较强的气相抗菌活性,对大肠杆菌的MIC和MBC均为200 μL/L。大肠杆菌经芳樟醇气相熏蒸处理时,首先细胞壁的完整性受到破坏,使细胞膜更易暴露于芳樟醇,导致合成生物膜的长链饱和脂肪酸减少、不饱和脂肪酸以及较短链脂肪酸增多,使细胞膜流动性增加;同时,导致细胞膜蛋白三级结构发生改变,使细胞膜完整性被破坏。由于芳樟醇导致大肠杆菌细胞膜膜脂组成以及膜蛋白结构发生变化,使细胞膜的通透性增加,引起一些维持细胞正常生长的钾盐、磷酸盐等小分子以及蛋白质、DNA、RNA等生物大分子物质泄漏,最终导致大肠杆菌死亡。

