洞庭湖区南汉垸水体浮游植物群落结构特征及其影响因素
杨毓鑫, 杜春艳*, 钱 湛, 蒋昌波, 陈 宏, 余关龙, 李亚杰
1.长沙理工大学水利工程学院, 湖南 长沙 410114
2.洞庭湖水环境治理与生态修复湖南省重点实验室, 湖南 长沙 410114
3.湖南省环境保护河湖污染控制工程技术中心, 湖南 长沙 410114
4.湖南省水利水电勘测设计研究总院, 湖南 长沙 410007
浮游植物是水体中主要的初级生产者之一,也是水生态系统中物质循环和能量流动的驱动因子,对于维持水域生态系统平衡起着极其重要的作用[1]. 水环境的改变不仅会引起水质的变化,也会改变水体中生物群落的组成,其中浮游植物群落对环境变化的响应十分迅速,常被用来作为评估水体健康状况的指示性生物类群[2],其种类、优势种群和丰度等群落结构特征指标也被用于评价和检测水环境[3]. 影响浮游植物群落结构及分布特征的因素一般分为上行效应和下行效应,上行效应主要影响光照、温度、营养盐、水动力等因素,下行效应则通过浮游动物和滤食性鱼类的摄食等方面影响浮游植物群落分布[4-5]. 浮游植物种类组成和分布对环境变化具有指示作用,而环境条件的改变也会直接或间接地影响浮游植物的群落结构[6],但浮游植物群落与环境因子的关系复杂,在不同类型的水体中,影响浮游植物群落结构的环境因子各有差别[7-11].
洞庭湖是我国第二大淡水湖泊,对维系整个长江生态系统的平衡和安全发挥着重要作用,然而在自然和人类活动的双重影响下,洞庭湖的水生态环境日益恶化,尤其是湖区内堤垸(至1980年水利部停止围垦时止,湖区堤垸达278个)的水体富营养化严重,水生态环境堪忧,而且垸内沟渠、坑塘将垸内居民与洞庭湖相连,垸内水生态环境与洞庭湖湖区水生态环境相互影响. 近年来,有不少学者对洞庭湖湖区的浮游植物及水质特征进行了相关研究[12-14],而关于洞庭湖区堤垸内水体浮游植物和水生态的研究却未见报道. 因此,该研究选取了洞庭湖区污染较为严重的典型堤垸——南汉垸为研究对象,通过对南汉垸内水体的野外调查和采样监测分析,对浮游植物的群落结构特征及其与环境因子的相关性进行了研究,以期为洞庭湖堤垸内水体污染治理和生态修复提供参考,为整个洞庭湖区水生态安全整治和管理提供科学依据.
1 材料与方法
1.1 研究区域概况及采样点设置
南汉垸为洞庭湖的重点堤垸,位于湖南省益阳市南县西南部(29°04′N~29°18′N、112°12′E~112°18′E),包括武圣宫镇和厂窖镇2个行政镇,三面环水,藕池河中、西支与淞澧洪道流经其东西两侧,总面积96 km2,耕地面积超50 km2,湖泊面积5.33 km2,外部河洲4.67 km2,属亚热带湿润季风气候,气候温暖湿润,降水充足,降水量年际变化大,汛期南北洪水呈现顶托之势,垸内沟渠和内湖众多,丰富的水力资源为该区域农业发展(包括规模化养殖业、种植业等)提供了保障,同时也带来了不同程度的水体环境污染问题. 通过现场摸排并考虑水体功能和污染排放源,选取了11个具有代表性的采样点,采样时间为2017年11月和2018年6月. 11月为关泵封水期,垸内水体处于相对封闭状态,水体的表层流速小于0.1 ms,水体无明显流动;6月为开泵放水期,垸内水体处于流动状态,外河水体经泵站汇入渠道,再汇入外河. 采样点的具体信息见表1.

表1 采样点具体信息
1.2 样品采集与分析方法
浮游植物定性样品采用25#浮游生物采集网在水中呈“∞”缓慢拖网采集;浮游植物定量样品采用拉式采样器采集表层水样1 L,样品现场采用1.5%鲁哥试液固定,带回实验室,经沉淀48 h后,用虹吸法吸取上清液,浓缩至30 mL,用移液枪移取0.1 mL浓缩均液于计数框中,用显微镜(BX53,日本Olympus公司)进行鉴定和计数,浮游植物物种鉴定和计数等参考文献[15-16];现场检测WT(水温)、EC(电导率)、ρ(DO)、Turb(浊度)、pH和SD(透明度);取500 mL表层水样,于4 ℃保温箱内带回实验室,ρ(Chla)的分析方法参照HJ 897—2017《水质叶绿素a的测定 分光光度法》,ρ(NO3--N)、ρ(NH4+-N)、ρ(TN)、ρ(TP) 和ρ(CODMn)的分析方法参照《水和废水检测分析方法》第四版[17].
1.3 数据处理与分析
1.3.1综合营养状态指数评价
依据TN、TP、SD、CODMn和Chla的分析结果,运用综合营养状态指数法对南汉垸湖区生态系统健康状况进行评价,计算公式[18]:
(1)
式中,TLI(Σ)为综合营养状态指数,Wj为第j种参数的营养状态指数的相关权重,TLI(j)为第j种参数的营养状态指数,m为评价参数的个数.
参考《中国水资源公报》中湖泊(水库)富营养化评分与分类标准进行分级,同一营养状态下,指数值越高,其营养程度越严重:贫营养,TLI(Σ)<30;中营养,30≤TLI(Σ)≤50;轻度富营养,50
1.3.2优势种属
浮游植物优势种属根据y(优势度)来确定[19]:
y=fi·Pi
(2)
式中,fi为第i属的出现频率,Pi为第i属丰度占总丰度的比例. 当y≥0.02时,定义为优势属[20]. 优势种属的变化在一定程度上可直接反映水体污染程度和环境条件的改变.
1.3.3生物多样性分析
为了避免单一多样性指数造成结果偏差,利用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)和Margalef丰富度指数(d) 3个多样性指数来计算南汉垸内水体浮游植物的生物多样性,计算公式:
(3)
J=H′lnS
(4)
d=(S-1)lnS
(5)
式中,ni为样本中第i种浮游植物的个数,N为样本中所有浮游植物物种的个数,S为采样点的群落种数. 多样性指数评价标准参考文献[21].
浮游植物优势属与环境因子之间的DCA(去趋势对应分析)和RDA分析采用Canoco for window 4.5软件,通过Monte Carlo检验选出对浮游植物类群有显著影响的环境因子. 其中,物种数据采用藻类丰度指标,按照该物种在各样点频度>12.5%,相对密度≥1%的条件进行筛选,环境数据除pH外都进行lg(x+1)转换[22].
该研究其他分析和作图在SPSS 22.0和Origin 2017中完成.
2 结果与分析
2.1 水环境因子特征
不同时期水环境因子的变化如表2所示. 由表2可见:6月南汉垸水体处于轻度富营养和中度富营养水平之间;除采样点4以外,11月南汉垸水体处于中度富营养水平和重度富营养水平之间. 对2017年11月和2018年6月的环境因子进行独立样本T检验,发现WT、Turb和ρ(NH4+-N)差异显著(P<0.05), 而SD、pH、EC、ρ(DO)等因子差异不显著(P>0.05).

表2 南汉垸各时期水环境因子变化
注: 1) 表示独立样本T检验,P<0.05;数据为平均值±标准差.
为了辨识南汉垸水体水质污染的主导因子,对12项水环境因子进行PCA分析. 按照特征值大于1的原则提取出4个主成分,其累计方差贡献率达85.88%,说明主成分因子能够表征这些指标整体的水环境污染状况,且KMO(Kaiser-Meyer-Olkin)系数为0.632,大于0.60,说明样本复合数据结构合理的要求[23],适合进行因子分析. 旋转后的因子载荷率(见表3)表明,与PC1相关的主要水质指标是ρ(TN)、ρ(TP)、ρ(NH4+-N)、ρ(CODMn)和ρ(NO3--N),表征了水体的营养盐状况. 与PC2相关的是WT和Turb,表征了水体的温度变化和浑浊状况. 其他主成分因子与PC1相比重要性较低,结合旋转后的因子载荷率判断主成分因子与水环境状况之间的相关性大小,筛选出ρ(TN)、ρ(TP)和ρ(NH4+-N)为水质的主要污染因子.
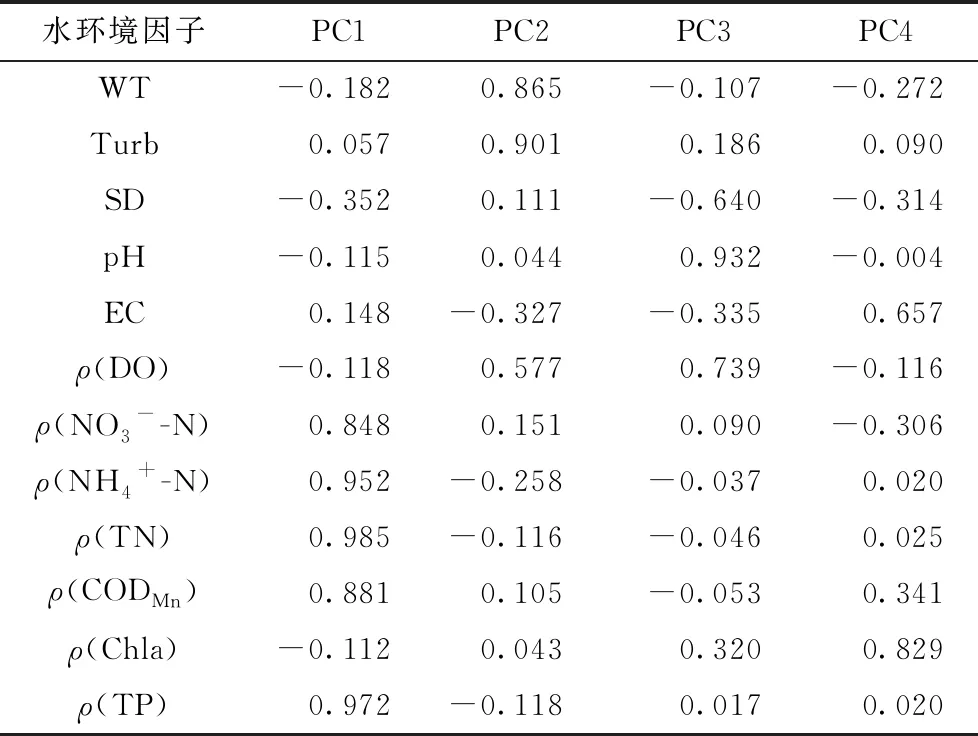
表3 水环境因子旋转后的因子载荷率
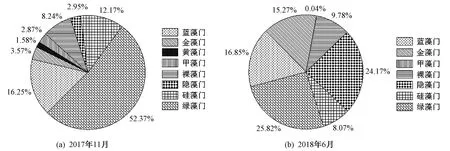
图1 南汉垸各时期浮游植物丰度分布Fig.1 Abundance of phytoplankton in different periods of Nanhan Polder
2.2 浮游植物的群落结构
2.2.1浮游植物的种类组成及优势属
调查期间,共鉴定出浮游植物8门62属,其中绿藻门种类最为丰富,为29属;硅藻门、蓝藻门和裸藻次之;甲藻门、隐藻门、金藻门和黄藻门最少. 从时间差异来看,浮游植物种类略有变化,其中11月浮游植物种类较多(见表4).
按照浮游植物某个种属的优势度y≥0.02,则达到优势地位,称之为优势种属. 两次采样的优势种属(括号内数字为优势度)包括绿藻门的衣藻(Chlamydomonasspp., 0.13)、鼓藻(Cosmariumspp.,0.09)、卵囊藻(Oocystisspp., 0.04)和新月藻(Closteriumspp., 0.02);蓝藻门的平裂藻(Merismopediaspp., 0.03)、鱼腥藻(Anabaenaspp., 0.05)和隐球藻(Aphanocapsaspp., 0.05);硅藻门的直链藻(Melosiraspp., 0.05)、针杆藻(Synedraspp.,0.02);隐藻门的隐藻(Cryptomonassp., 0.04);金藻门的锥囊藻(Dinobryonspp., 0.05);裸藻门的裸藻(Euglenaspp., 0.04).
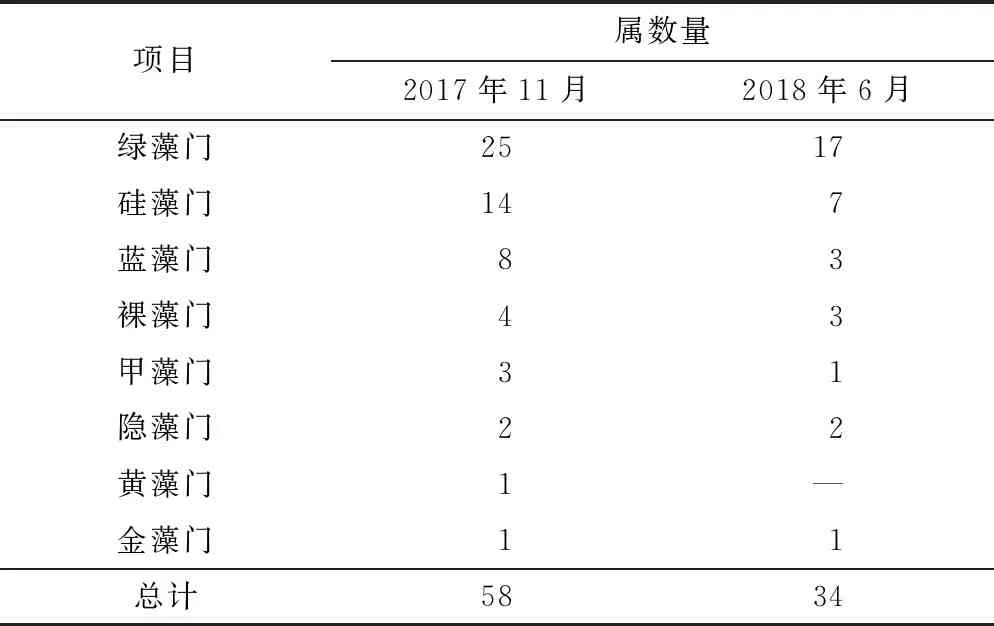
表4 浮游植物种类数
2.2.2浮游植物的丰度变化
由图1可见,南汉垸11月的浮游植物丰度为8.34×106~3.02×108L-1,平均丰度为7.92×107L-1,绿藻门、蓝藻门和硅藻门的丰度占比超过80%. 6月浮游植物的丰度为1.13×106~2.04×107L-1,平均丰度为6.08×106L-1. 与11月相比,6月绿藻门的丰度占比减少较大,仅占总丰度的25.82%;隐藻门的丰度占比大幅增加,仅次于绿藻门,占总丰度的24.17%;此外,黄藻门没有出现在此期间,甲藻门的丰度占比几乎可以忽略不计;不同门类浮游植物的丰度分布更为均匀.
2.2.3浮游植物的多样性特征
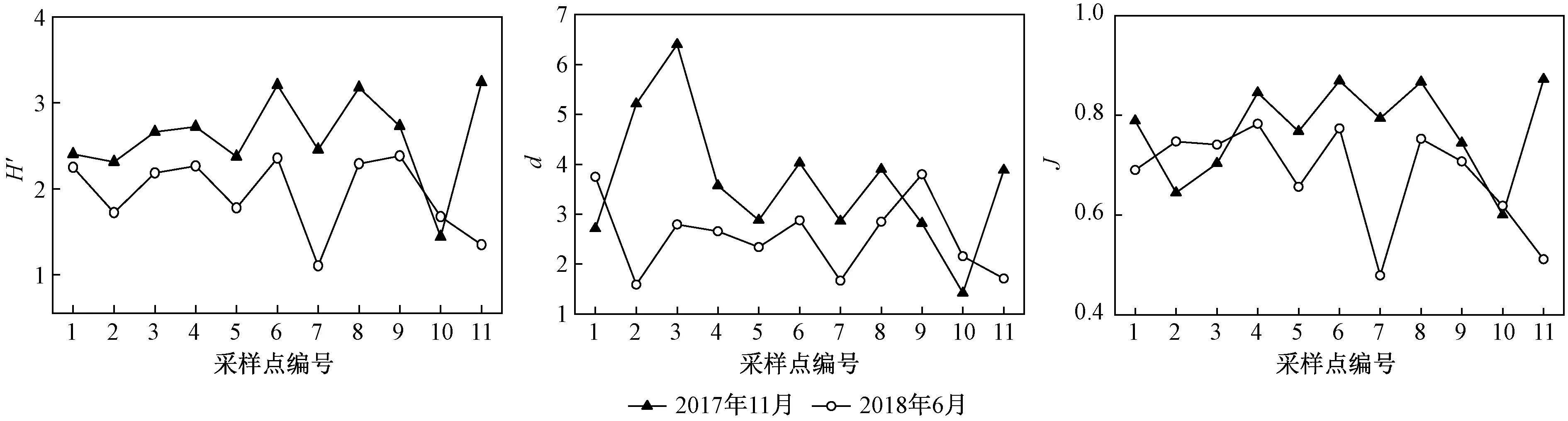
图2 南汉垸浮游植物多样性分布特征Fig.2 Distribution characteristics of phytoplankton diversity of Nanhan Polder
由图2可见:南汉垸水体浮游植物的Shannon-Wiener多样性指数(H′)的变化范围为1.10~3.24,11月各采样点的多样性指数普遍高于6月,11月仅以养殖业为主的6、8和11号采样点为轻污染,大部分采样点的多样性评价为α-中污染或β-中污染;Margalef丰富度指数(d)波动较大,变化范围为1.42~6.40,由于11月的浮游植物物种数显著高于6月,所以11月的Margalef丰富度指数较高,其中3号采样点最高,10号采样点最低;Pielou均匀度指数(J)的波动范围为0.48~0.87,其中11月6、8和11号采样点最高,仅6月7号采样点的评价为中污染.
2.3 浮游植物与环境因子的关系
对物种数据进行DCA分析,结果显示,排序轴中梯度最大值<2,故对数据进行RDA分析[24]. 浮游植物代码见表5,RDA统计结果如表6所示,总典范特征值为0.698. 该研究中两个环境排序轴和两个物种排序轴的相关系数均为0,且蒙特卡罗检验(Monte Carlo test)结果中第1轴和全部轴P<0.05,表明排序结果是可靠的;环境因子与物种数据的前两个排序轴的相关系数分别为0.898和0.845,拟合程度较好.
表5 RDA分析中浮游植物物种代码
图3反映了南汉垸浮游植物丰度与环境因子之间的关系,从轴1看,主要的相关因子是WT、ρ(NH4+-N) 和ρ(TN),相关系数分别为0.764、-0.506 和0.401;从轴2看,主要的相关因子是pH,相关系数为0.512. 轴1的特征值达0.499,轴1和轴2的物种-环境关系累积百分数为80.1%,说明轴1和轴2能解释大多数浮游植物分布. 浮游植物优势物种集中分布在第2和第3象限,与WT呈显著负相关,与ρ(NH4+-N)、pH及ρ(TN)呈显著正相关,其中隐球藻、锥囊藻、裸藻、直链藻和衣藻位于两排序轴的中心位置,对南汉垸水体具有较强的适应性.

表6 浮游植物丰度与环境因子的RDA统计结果
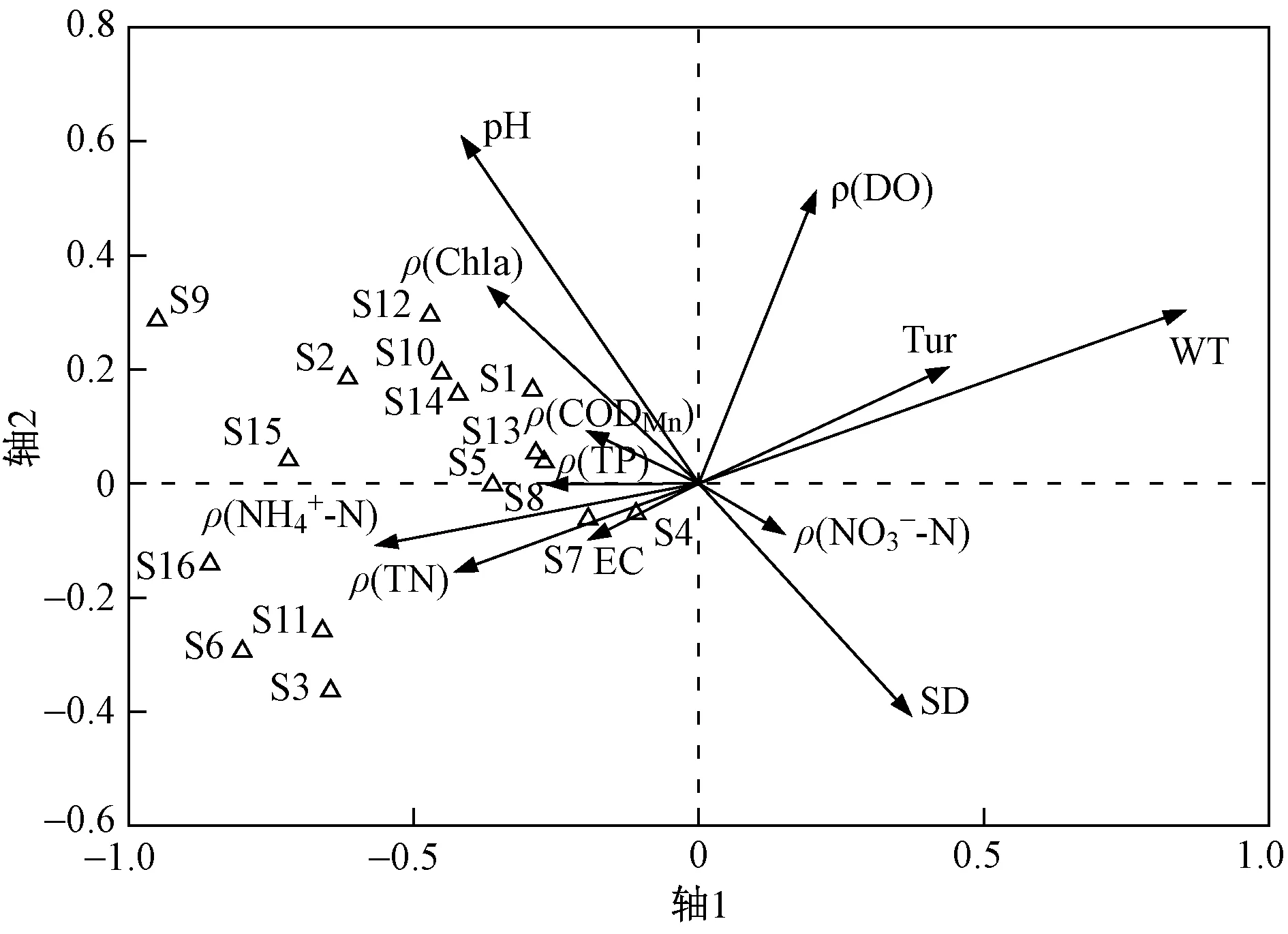
图3 浮游植物丰度与环境因子的RDA分析Fig.3 Redundancy analysis of phytoplankton abundance to environmental factors
3 讨论
3.1 浮游植物的群落结构特征及营养状态评价
通南汉垸不同时期浮游植物的调查显示,6月以绿藻门和隐藻门占绝对优势,其次是蓝藻门;11月以绿藻门和蓝藻门占绝对优势,造成这种差异的原因可能是6月处于开泵放水期,水体处于流动更新状态,而隐藻是急流水体中的优势门类[25];11月处于关泵封水期,水体基本处于静止状态. 汪星等[13]研究结果显示,洞庭湖的浮游植物以绿藻门为主,硅藻门与蓝藻门次之,与该研究浮游植物群落结构组成基本一致.
浮游植物丰度和相关水环境因子都能反映水体的富营养化程度,综合富营养状态指数评价与浮游植物丰度评价结果基本一致. 参照湖泊富营养化浮游植物丰度评价方法[26],6月的南汉垸水体均处于中营养状态,11月的浮游植物丰度普遍高于6月,其中6、8、9和11号采样点处于重富营养化状态. 营养盐对浮游植物的种类组成及分布有着较重要的影响,6、8和11号采样点主要从事鱼类养殖,而11号采样点有大量生活污水排放,人工投肥和生活污水为浮游植物的生长提供了足够的营养盐,从而削弱了浮游植物之间的竞争强度[27],浮游植物丰度显著增加.
3.2 浮游植物群落结构与环境因子的相关性
研究[28-30]表明,pH、温度、营养盐浓度、SD、化学需氧量和水动力条件等都能对浮游植物群落组成及分布产生影响. 该研究中RDA结果显示,WT、pH、ρ(NH4+-N) 及ρ(TN)是影响洞庭湖区南汉垸浮游植物群落结构组成及分布的主要环境因子.
温度能通过控制光合作用的酶促反应及呼吸作用的强度直接影响藻类的生长,且温度对浮游植物生物及群落结构的影响机理已有大量报道[31-32],并已基本达成共识,即随着WT升高,伴随着喜温浮游植物,尤其是蓝藻、绿藻开始大量繁殖,浮游植物丰度也随之升高. 然而该研究中,6月的浮游植物物种数及丰度均低于11月,RDA结果却显示浮游植物丰度与WT呈负相关,其原因可能是,6月为开泵放水期,外河水体流入致使沟渠水位升高,对浮游植物丰度具有稀释作用,水体流速加快,而浮游植物的水平分布受水流的影响很大,较快的水流不利于浮游植物丰度的积累.
氮、磷是浮游植物生长最重要的营养物质,也是生长限制元素,营养盐的不足或过量都会影响浮游植物的生长和群落结构[33-35]. 李利强等[12]研究表明,洞庭湖浮游植物的生长主要受到氮〔特别是ρ(NH4+-N)〕的限制,添加NH4+-N能显著促进浮游藻类生物量的增加. 南汉垸位于洞庭湖区西北部,垸内水体与淞澧洪道及藕池河中、西支相连,农业生产活动以种植业和养殖业为主,存在生活污水及垃圾未进行集中收集和处理而直接排放的现象,而农药化肥和生活污水是ρ(TN)和ρ(NH4+-N)的主要贡献者,且有研究[36]表明浮游植物倾向吸收水体中的铵态氮来合成细胞所需要的氨基酸等物质,故ρ(TN)和ρ(NH4+-N) 能成为南汉垸浮游植物群落结构组成与分布的主要限制因子. 除了温度和营养盐,pH也对浮游植物有着重要影响,浮游植物对过高或过低的pH十分敏感[37]. 陈立婧等[38]研究表明,pH通过调节水体中的可利用碳源,影响浮游植物的光合速率和种间竞争,且认为碱性环境更有利于浮游植物光合作用,促进浮游植物生长繁殖,这与该研究中pH与浮游植物丰度呈正相关的结果一致.
由表6可见,该研究环境因子对浮游植物丰度解释了56.0%,表明还有其他因子对浮游植物丰度的变化产生了重要影响,因此南汉垸的浮游植物群落结构及丰度的变化不仅受WT、pH及营养盐的影响,还可能受到流域的水生植物及鱼类[27,39]、光照强度[40]、土地利用类型[41]、水动力[42]等条件的影响.
3.3 浮游植物多样性分析及水质评价
整体而言,11月浮游植物多样性指数高于6月,多样性指数越高,群落结构越稳定,水质状况也越好. 其中,由于6号采样点所在沟渠于2018年5月进行了沟渠清淤,其多样性指数显著低于同时期(6月)其他采样点. 钟继承等[43]研究表明,底泥疏浚对浮游植物群落多样性产生了影响,疏浚后初期生物群落多样性指数显著低于未疏浚时期,与该研究结果一致. 换水率与浮游植物生物量和营养浓度密切相关[44],10号采样点位于新码头电排渠与藕池河的接口处,仍有较大的流量,换水率较高,生物多样性指数显著低于同时期(11月)的其他采样点. 综上,南汉垸浮游植物多样性评价介于轻污染与β-中污染之间,但局部采样点的多样性指数较低,多样性评价为α-中污染,这与该采样点人类干扰有明显的关系. 此外,PCA结果表明,ρ(TN)、ρ(TP)和ρ(NH4+-N)为南汉垸水体的主要污染因子. 基于南汉垸目前的水环境情况,应加强乡镇农业面源污染的控制及管理,构建生活污水处理设施,杜绝生活污水的肆意排放,控制氮、磷等营养盐的输入;同时,建立长效监管机制,加强区域内水污染综合治理及其水生态修复工程,防止水质进一步恶化.
4 结论
a) 洞庭湖南汉垸浮游植物调查共鉴定出8门62属,主要隶属于绿藻门、硅藻门及蓝藻门;优势物种以绿藻门的衣藻和鼓藻为主;11月的浮游植物物种数及丰度显著高于6月. 另外,综合富营养状态指数评价与浮游植物丰度评价的结果一致,11月的水体营养状态普遍高于6月.
b) PCA结果表明,ρ(TN)、ρ(TP)和ρ(NH4+-N)为南汉垸水体的主要污染因子. 浮游植物多样性评价表明,南汉垸整体上介于轻污染与β-中污染之间,局部采样点评价为α-中污染. 总的来看,11月的多样性指数高于6月,群落结构更稳定,水质状况更好.
c) RDA结果显示,洞庭湖区南汉垸浮游植物群落结构分布受水环境因子影响较为明显. 整体上,南汉垸浮游植物群落结构分布与pH、ρ(NH4+-N)及ρ(TN)呈正相关,与WT呈负相关,其他因子对浮游植物群落结构也有一定的影响和限制作用.

