《肝胆肿瘤分子诊断临床应用专家共识》解读*
程家敏 曾珍 陆荫英
肝胆肿瘤是中国最常见的恶性肿瘤之一,早诊困难,临床可根治性切除率较低,且治疗方式数年来进展缓慢,严重影响该类患者的疗效和预后。因此,对肝胆肿瘤的早期筛查及创新疗法研究迫在眉睫。《肝胆肿瘤分子诊断临床应用专家共识》是中国肝胆肿瘤分子诊断领域的第一个标准共识,该共识为肝胆肿瘤的早期诊断、疗效评估、预后预测提供进一步规范和指导。近期美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)肝胆肿瘤诊疗指南、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)肝胆肿瘤诊疗指南以及国家卫生健康委员会《原发性肝癌诊疗规范(2019年版)》、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)《原发性肝癌诊疗指南(2020)》都进行了进一步更新。本共识解读将结合这些最新的诊疗指南及临床数据,提炼共识要点、详解共识中存在的争议,并对共识涉及的分子标志物的最新进展进行解读。加深医务人员对于本共识的理解,同时推广并规范分子生物学诊断技术的临床标准化应用,使更多患者从中获益。
1 诊断相关的主要分子标志物
1.1 临床应用的血清学分子标志物
血清甲胎蛋白(α-fetoprotein,AFP)是目前临床上应用最广泛和特异性最强的肝细胞癌(hepatocellular carcinoma,HCC)标志物。甲胎蛋白≥400 μg/L超过1个月,排除妊娠、生殖腺胚胎癌和活动性肝病后,诊断HCC的敏感性为17%,特异性为99%[1]。对于甲胎蛋白阴性(<20 μg/L)HCC 患者,甲胎蛋白异质体(AFP-L3)的检测敏感性为12%~21%,特异性为97%~98%[2]。研究发现,脱-γ-羧基凝血酶原(desγ-carboxy-prothrombin,DCP)≥40 mAU/L 对于诊断早期HCC 的敏感性和特异性分别为74%和86%[3]。DCP 的高敏感性可以有效补充AFP 和AFP-L3 的不足,所以共识建议在临床HCC筛查、诊断中联合使用AFP、AFP-L3和DCP。
《原发性肝癌诊疗规范(2019年版)》、CSCO《原发性肝癌诊疗指南(2020)》中均提到可以使用血浆游离核糖核酸(microRNA)作为HCC患者诊断及筛查的参考指标。利用7 种血浆miRNA 的表达水平建立的HCC 诊断模型灵敏度较AFP 提高约30%,其对于AFP 阴性患者仍能做出准确的诊断(敏感度77.7%,特异度84.5%)[4]。目前基于循环miRNA模型的HCC检测试剂盒已经过多中心临床实验验证(n=1 812),并获国家药品监督管理局三类医疗器械注册证,进入临床应用。除此之外,处于探索阶段的血清学分子标志物有高尔基蛋白73(Golgi protein,GP73)、磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)、循环肿瘤细胞DNA(circulating tumor DNA,ctDNA)突变、ctDNA 甲基化和端粒酶逆转录酶(telomere reverse transcriptase,TERT)启动子区变异。ctDNA、ctDNA 甲基化和TERT启动子区变异测序成本较高,且到目前为止缺乏大规模临床试验结果论证,共识仅建议作为肝胆肿瘤患者诊断及筛查的参考指标。
胆道肿瘤缺乏高特异性的分子标志物,共识推荐使用血清学糖类抗原CA19-9、CA125及癌胚抗原CEA联合检测,结合影像学特点作为胆管细胞癌(cholangiocarcinoma,CCA)临床诊断的标志物;使用血清学糖类抗原CA19-9 检测,结合影像学特点作为胆囊癌(gallbladder carcinoma,GBC)临床诊断的标志物。
1.2 临床应用的病理组织学分子标志物
肝癌的分子病理诊断需要合理使用免疫组织化学染色标志物对HCC、CCA、混合型HCC-CCA 以及转移性肝癌进行鉴别诊断。肝细胞抗原(hepatocyte paraffin antigen,HepPar-1)、精氨酸酶-1(arginase-1,Arg-1),GPC-3和AFP特异性较好,推荐作为HCC诊断的免疫组化标志物。除此之外低分子角蛋白(cytokeratin,CK)8、CK18、多克隆CEA(pCEA)和CD10 也是常用的标志物。在HCC 的早期诊断方面,联合应用GPC-3、热休克蛋白-70和谷氨酰胺合成酶具有重要诊断价值,这3个免疫标志物中2项阳性则考虑为HCC。CCA 的主要组织学诊断标志物包括CK7、CK19、热休克蛋白70、黏蛋白-1。
2 治疗相关的标志物
肝胆肿瘤存在很大的异质性,HCC、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)、肝外胆管癌(extrahepatic cholangiocarcinoma,ECC)和GBC在分子水平及临床表现都具有很大差异。HCC发病机制复杂涉及多条信号通路,比如VEGF/VEGFR/PDGFR/FGFR、EGFR/IGF/HGF/c-MET、PI3K/AKT/mTOR等;胆道肿瘤中的变异更多样:ICC更可能发生IDH1/2突变和FGFR融合,ECC更常见KRAS,P53和SMAD4突变,而GBC的ERBB2扩增频率很高[5]。随着精准医疗的发展,近期HCC的免疫联合治疗及CCA的靶向治疗崭露头角。
2.1 靶向治疗相关的分子标志物
结合最新的指南发布和临床研究进展,表1对共识内靶向治疗相关的分子标志物进行了汇总及更新。
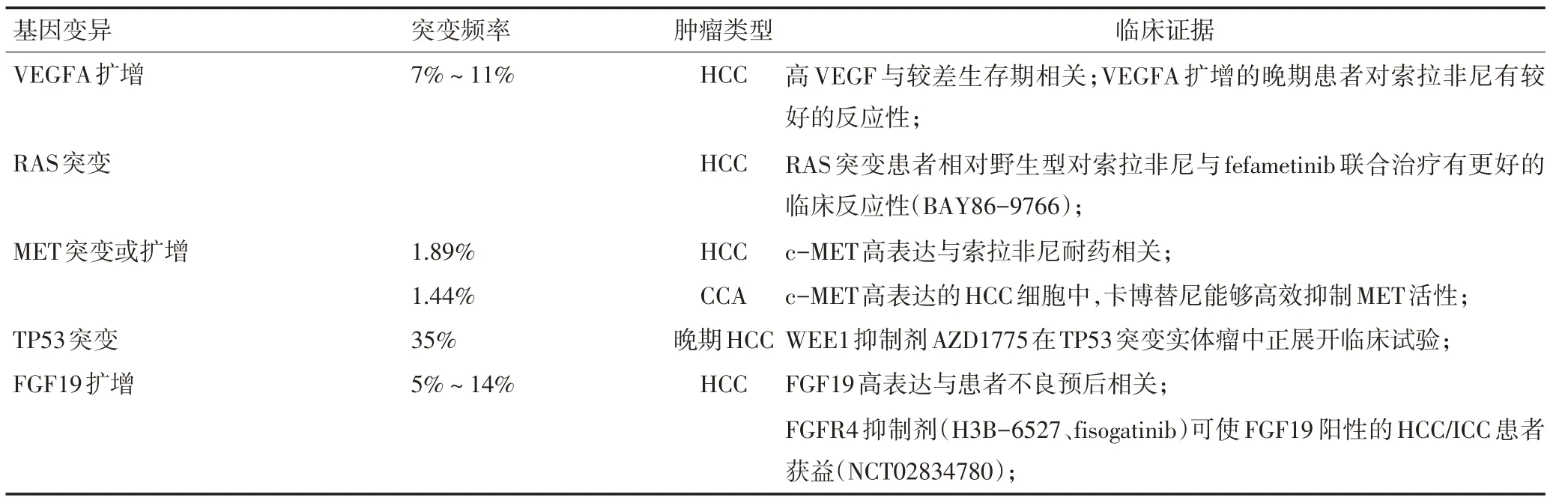
表1 肝胆肿瘤(潜在)靶向治疗相关标志物
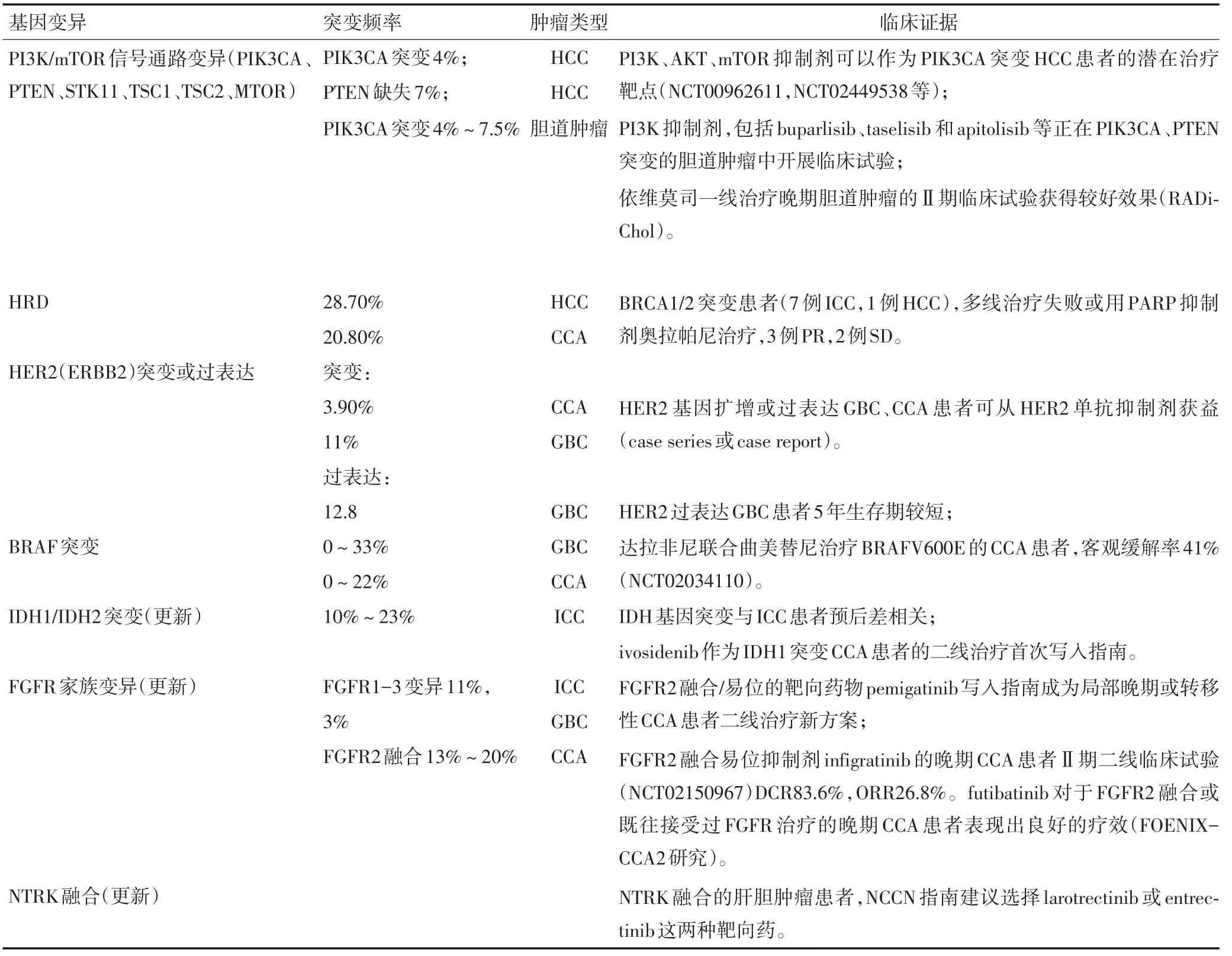
表1 肝胆肿瘤(潜在)靶向治疗相关标志物(续表1)
共识更新点:
更新一:FGFR 的靶向药物pemigatinib 获美国食品药品监督管理局(FDA)批准上市(2020年4月17日)并被写入指南,成为携带FGFR2融合/重排的局部晚期或转移性CCA患者后线治疗新方案。
2020年Lancet Oncology 刊出FIGHT-202 研究的数据[6]:pemigatinib 治疗存在FGFR2 融合/重排患者的客观缓解率为35.5%,疾病控制率为82%,且耐受性好,不良反应可控。
更新二:ivosidenib作为IDH1突变CCA患者的二线治疗方案首次写入指南。
2020年Lancet Oncology 刊出ivosidenib 治疗晚期胆管癌Ⅲ期临床试验(ClarlDHy 试验)的数据:ivosidenib显著提高IDH1突变胆管癌患者的无进展生存期2.7个月,延长总生存期至10.8个月,降低63%疾病进展或死亡风险[7]。
更新三:NTRK融合阳性的肝胆肿瘤患者,NCCN指南建议选择larotrectinib或entrectinib这两种靶向药。
2019年V4版NCCN肝胆肿瘤诊疗指南新增FDA批准的泛瘤种NTRK基因融合药物larotrectinib或entrectinib。
2.2 免疫治疗相关的分子标志物
肿瘤免疫治疗相关的常见分子标记标志物包括程序性细胞死亡配体-1(programmed cell death-ligand 1,PD-L1),肿瘤突变负荷(tumor mutation burden,TMB),微卫星不稳定(microsatellite instability,MSI)/错配修复缺陷(mismatch repair deficient,dMMR),其中MMR相关基因包括MLH1、MSH2、MSH6、PMS2。
目前PD-L1在肝胆肿瘤中的应用尚未见明确结论。近期FDA 批准当患者伴有高肿瘤突变负荷(TMB-H,即≥10个突变/Mb)时,帕博利珠单抗可用于治疗不可切除或转移性成人及儿童泛实体瘤。但目前泛瘤种TMB 尚未写入肝胆指南。NCCN 肝胆指南指出,对于不可切除或转移性胆道肿瘤(包括GBC、ICC、ECC)推荐MSI/dMMR 检测,并推荐MSI-H/dMMR的胆道肿瘤患者使用帕博利珠单抗。
争议:
争议一:大量临床试验表明,组织中PD-L1表达阳性是免疫检查点抑制剂疗效评估和患者预后的重要分子标志物,但对于PD-L1检测阳性标准,不同癌种的不同抗体有不同的判断标准。目前,研究数据对该结果存在争议,肝胆肿瘤中尚无明确结论。
PD-L1表达的评估受到检测所用抗体的克隆多样性、肿瘤和浸润细胞的不同评分方法以及取样组织的生物异质性的影响。由于免疫细胞的肝硬化微环境,HCC中PD-L1表达状态非常复杂。目前研究表明,PDL1 在HCC 中的表达较低,且在不同PD-L1 染色抗体(22C3、28-8、SP142、SP263 和EIL3N)中呈异质性[8]。Keynote224和Checkmate 040中检测方法和评价标准也有差异[9-10]。综上所述,PD-L1表达在HCC中的应用还有待临床试验/研究证据的进一步积累。
争议二:特定基因的突变可能影响肿瘤细胞逃避免疫监视的能力,如STK11/LKB1,B2M的杂合性缺失,Wnt/CTNNB1,PTEN 基因突变,POLE 的激活突变等,可预测免疫治疗的免疫应答率,但尚需进一步的临床验证[11]。
争议三:免疫超进展预测标志物(11q13 扩增、MDM2、MDM4、ctDNA 丰度等)及免疫治疗超进展发生率等在肝胆肿瘤中还需要进一步研究观察。
共识更新点:
更新一:“T+A”用于晚期HCC治疗已被指南列为一线推荐方案
2020年,IMbrave150 PhaseⅢ临床实验结果公布,与目前标准治疗方案索拉非尼相比,“T+A”免疫联合治疗显著延长了患者的总生存期和无进展生存期,“T+A”免疫联合治疗组12个月生存率达到67.2%,突破了HCC 治疗十多年来的瓶颈[12]。基于IMbrave150的优异数据,2020年V1版NCCN肝胆指南更新,将阿替利珠单抗+贝伐珠单抗纳入一线推荐优选方案,V4版将证据等级由2A 升级为1 级推荐。2020年新版CSCO指南将“T+A”方案列为1A类专家推荐。ESMO指南也第一次提及到“T+A”方案,这个方案可能考虑作为一线推荐。
更新二:ESMO 删除了O 药作为一线治疗和K 药作为二线治疗的推荐方案:
基于CheckMate 459[13]和KEYNOTE-240[14]研究,ESMO 删除O 药作为一线治疗和K 药作为二线治疗的推荐方案。
更新三:TMB
FDA已批准高肿瘤突变负荷(TMB-H,即≥10个突变/Mb)的患者,可将帕博利珠单抗用于治疗不可切除或转移性成人及儿童实体瘤。TMB成为MSI-H/dMMR后,第2个不限癌种的免疫治疗的生物标志物,预示不用考虑肿瘤类型,仅依据生物标志物进行免疫治疗的范围再次扩大。
2.3 专家推荐意见
1)目前已明确列入指南的肝胆肿瘤靶向治疗相关分子标志物包括:胆管癌FGFR2融合/易位,胆管癌IDH1 突变,肝胆肿瘤NTRK 基因融合。免疫治疗相关分子标志物包括已写入指南的胆道肿瘤MSI-H/dMMR 以及获FDA 批准尚未写入指南的TMB≥10 个突变/Mb。
2)除上述分子标志物外,常规靶向治疗药物(索拉非尼、仑伐替尼、瑞戈非尼等)和免疫治疗药物(PD-1单抗、PD-L1单抗、CTLA-4单抗等),在临床实践中,不推荐在靶向治疗或/和免疫治疗前常规行基因筛查检测。为HCC耐药后治疗以及联合治疗提供参考依据,可结合临床实际情况或临床试验,进行RAS、MET、HRD、VEGFA等基因检测;对CCA/GBC患者个体化靶向治疗新方案的探索,可进行ERBB2、BRAF、HRD、PI3K/mTOR、FGF19等基因检测;探索免疫治疗有效的分子诊断标志物,可进行组织学或血清学PD-L1、TMB、MSI等检测。以上这些标志物的检测,仅为肝胆肿瘤靶向和/或免疫治疗提供临床参考。
3 肝胆肿瘤分子标志物检测的质量控制
血清肿瘤标志物检测技术应用广泛,相对较为成熟。病理免疫组织化学方面,受检测平台、检测方法以及主观判断差异等影响,相对具有挑战。以PDL1表达的评估为例,检测抗体、评分方法以及取样组织都会影响评分。
二代测序操作步骤多、程序复杂,对质控有严格要求。针对肿瘤样本,由于样本种类多样、样本质量差别较大、肿瘤异质性、低频突变等,对实验室检测带来了较大挑战,同时对检测单位的软硬件实力也提出了更严格的要求,包括具有严格分区设计的高标准实验室、配套的仪器设备等;具有全面的二代测序及其实验室质量管理知识的实验室负责人或技术负责人及相应的“干、湿实验”团队成员,尤其注意“湿实验”团队成员应包括病理医(技)师人员,负责对组织检测样本进行病理复核,明确肿瘤类型和肿瘤细胞含量,保证样本符合检测要求等;产品项目经过性能验证和性能确认以及标准操作程序的建立;定期参加室间质量评价或能力验证来评估实验室检测能力等[15-16]。
4 结语
近年来,肝胆肿瘤的临床治疗取得了很大进步,HCC免疫联合治疗、CCA FGFR2融合/易位及IDHI突变的靶向治疗等临床试验的数据为肝胆肿瘤尤其是晚期患者的治疗带来了新的希望。但与此同时,如何提高肿瘤患者的早期检出率及提高多线治疗后进展患者的临床获益,仍是肝胆肿瘤诊治亟需解决的问题。这些都需要将基础研究领域的成果与临床实践相结合,同时开展多中心、大规模临床试验,以循证医学的原则指导临床实践,推动肝胆肿瘤诊治的深化发展。
FDA 已批准了基于二代测序的Foundation One CDx(324个基因)用于多癌种、多位点、多个药物的伴随诊断,以及MSK-IMPACT(468个基因)用于肿瘤基因检测(补充诊断),但在国内尚未有多癌种、多基因大panel 检测试剂的获批。随着国内靶向治疗、免疫治疗相关标志物临床证据的积累,二代测序多基因检测可能为肝胆系统肿瘤诊断提供更多信息,也为其后线治疗选择提供更多参考。

