恶性肿瘤患者免疫检查点抑制剂导致肝损伤的临床处理2例*
王作林 杨华夏 陈明 张宇 张新伟 肖建宇 潘战宇 姜战胜
1 病例摘要
病例1:患者女性,64岁,体质量60 kg。主因“确诊尿路上皮癌1周”于2020年6月就诊于天津医科大学肿瘤医院。外院MRI显示:右侧输尿管盆段、壁内段明显增厚、狭窄,恶性可能;右侧髂血管旁、腹膜后多发肿大淋巴结,考虑转移可能。胸部CT 无异常。超声:左侧颈部及锁骨上窝淋巴结肿大,考虑转移。病理(颈部淋巴结穿刺)提示:高级别尿路上皮癌。临床诊断及分期:右侧输尿管癌,腹腔、颈部、锁骨上淋巴结转移,Ⅳ期。无治疗禁忌证。2020年6月给予免疫治疗联合化疗:白蛋白紫杉醇200 mg d1,5+奈达铂140 mg d1+信迪利单抗200 mg d1。
2020年7月6日第2次入院,2020年7月7日肝功能检查发现异常:谷丙转氨酶(ALT)182 U/L,谷草转氨酶(AST)152 U/L,总胆红素(TBIL)82 μmol/L,直接胆红素(DBIL)72.7 μmol/L。由于该患者为化疗联合免疫治疗,首先考虑化疗药物导致肝损伤,给予常规保肝药物治疗:异甘草酸镁100 mg qd、谷胱甘肽1.2 g qd、丁二黄腺苷蛋氨酸1 g qd;2020年7月9 日复查肝功能发现所有指标均有下降:ALT 143 U/L,AST 119 U/L,TBIL 60 μmol/L,DBIL 52.8 μmol/L,继续原方案保肝治疗。2020年7月12日复查肝功能提示各项指标未见明显下降,TBIL略有升高:ALT 70 U/L,AST 113 U/L,TBIL 61.5 μmol/L,DBIL 53 μmol/L。此时考虑免疫治疗所致肝损伤,于2020年7年13 日开始给予甲泼尼龙120 mg qd 治疗。2020年7月16 日复查肝功能显示所有指标均明显下降:ALT 28 U/L,AST 69 U/L,TBIL 31.8 μmol/L,DBIL 30.2 μmol/L。考虑到肝功能接近正常,于2020年7月16日进行激素减量,泼尼松60 mg po qd(每3 日减少5 mg);同时开始第2 个疗程治疗:白蛋白紫杉醇200 mg d1,5+奈达铂140 mg d1,停用信迪利单抗免疫治疗。2020年7月27日复查肝功能均恢复正常:ALT 17 U/L,AST 14 U/L,TBIL 10.2 μmol/L,DBIL 9.4 μmol/L。具体见表1,图1。
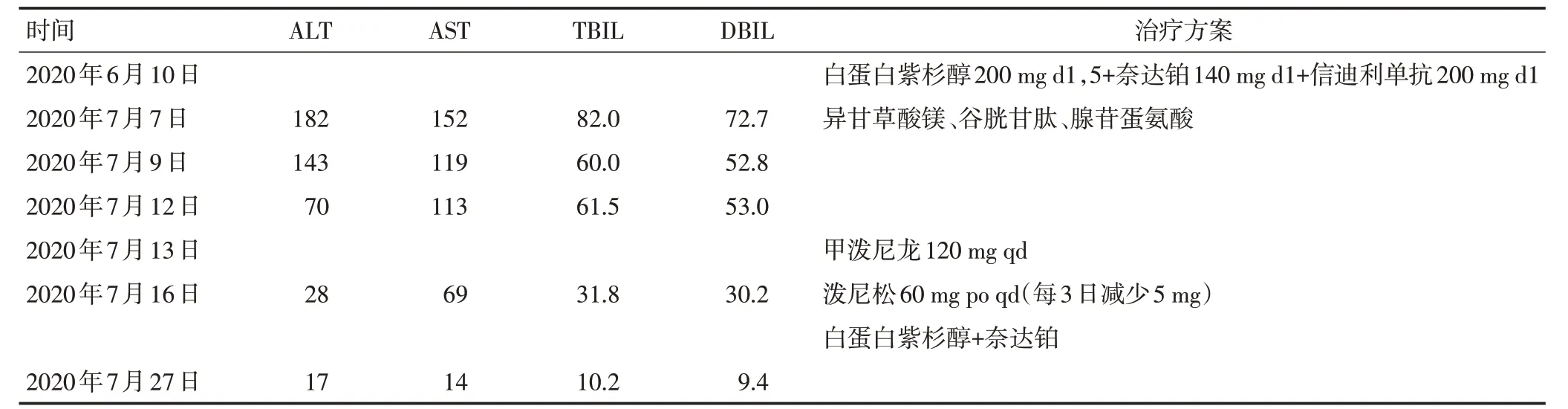
表1 病例1患者肝功能变化及用药情况
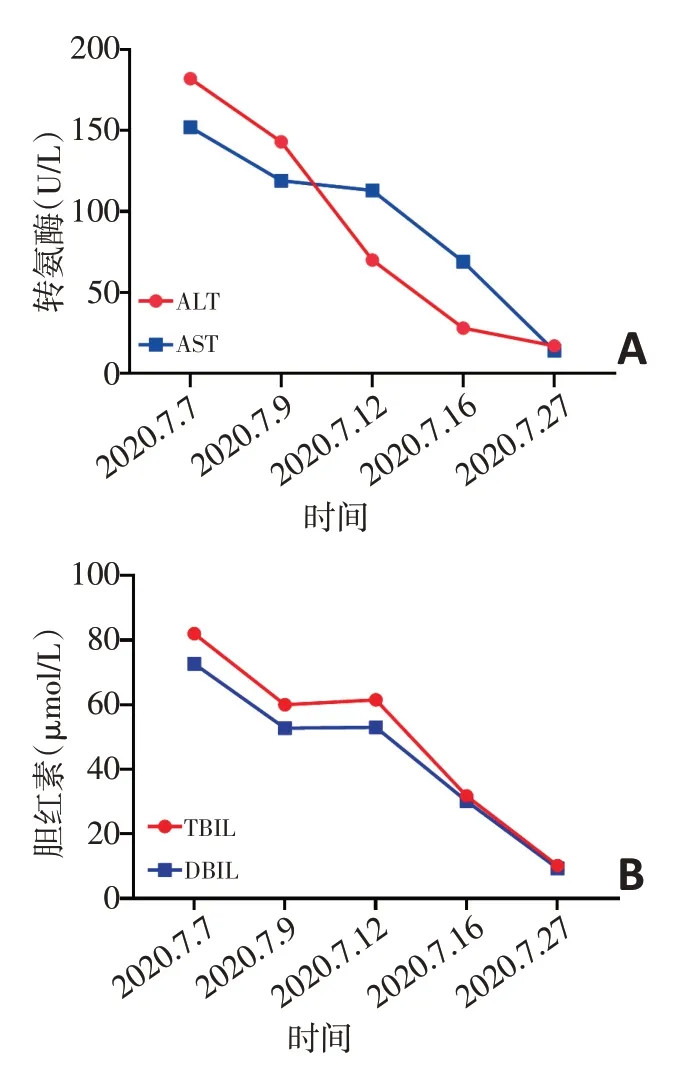
图1 病例1患者肝功能变化及用药情况
病例2:患者男性,68岁,体质量70 kg。主因“确诊小细胞肺癌2天”于2019年9月就诊于天津医科大学肿瘤医院。外院CT显示:左肺门占位性病变,考虑左肺上叶中央型肺癌(小细胞型)伴纵隔1L、2/3A、4L、10L及11区淋巴结转移。上腹CT、脑MRI未见异常。发射型计算机断层扫描(ECT)显示:胸骨、多发肋骨可以异常浓聚,考虑骨转移。气管镜病理:小细胞癌;免疫组织化学:Syn(+)、CD56(+)、TTF-1(++)、Napsin A(-)、P63(-)、Ki-67(90%)。临床诊断及分期:左肺小细胞癌淋巴结、骨转移,广泛期。未见治疗禁忌证,2019年9月27日给予免疫治疗联合化疗:依托泊苷180 mg d1~3+卡铂700 mg d1+信迪利单抗200 mg d4。
出院后2周后患者出现周身黄染,2019年10月就诊于当地医院,查肝功能显示重度异常:ALT 1 048 U/L,AST 812 U/L,TBIL 66.6 μmol/L,DBIL 55.5 μmol/L。当地医院考虑化疗药物导致肝损伤,暂不考虑免疫治疗相关,给予常规保肝药物:异甘草酸镁100 mg qd、谷胱甘肽1.2 g qd、双环醇50 mg tid。2019年10月17日复查肝功能显示转氨酶下降、胆红素上升:ALT 692 U/L,AST 344 U/L,TBIL 117.9 μmol/L,DBIL 102.5 μmol/L。此时当地医院判断不宜继续按照普通药物性肝损伤治疗,而是免疫治疗导致的肝损伤,于2019年10月17日开始给予甲泼尼龙80mgqd治疗。2019年10月20日复查肝功能显示转氨酶略有下降,胆红素继续上升:ALT 280 U/L,AST 142 U/L,TBIL 148.4 μmol/L,DBIL 127 μmol/L。2019年10月21日考虑给予激素加量:甲泼尼龙120 mg qd,同时给予麦考酚酯0.5 g qd。2019年10月25日复查肝功能发现胆红素仍继续升高:ALT 107 U/L,AST 176 U/L,TBIL 263.3 μmol/L,DBIL 255.3 μmol/L。2019年10月30日第2次就诊于天津医科大学肿瘤医院,体检可见周身及巩膜黄染,查肝功能发现胆红素显著升高:ALT 73 U/L,AST 194 U/L,TBIL 375.9 μmol/L,DBIL 199.2 μmol/L。临床判断患者为激素耐药型免疫治疗肝损伤,在未停用激素的情况下给予人免疫球蛋白解救治疗:甲泼尼龙120 mg qd+人免疫球蛋白20 g qd d1~5。2019年11月2日复查肝功能发现所有指标均明显下降:ALT 69 U/L,AST 94 U/L,TBIL 240.9 μmol/L,DBIL 120.2 μmol/L。继续给予免疫球蛋白2天,甲强龙减量至60 mg qd。2019年11月5日(人免疫球蛋白停用2天后)复查肝功能显示胆红素继续下降:ALT 59 U/L,AST 85 U/L,TBIL 159.2 μmol/L,DBIL 72.3 μmol/L。2019年11月9日复查肝功能:ALT 38 U/L,AST 33 U/L,TBIL 92 μmol/L,DBIL 40.2 μmol/L,考虑疗效明显,甲强龙减量至30 mg qd。2019年11月14日复查肝功能:ALT35U/L,AST32U/L,TBIL86.1μmol/L,DBIL 37.5 μmol/L。2019年11月15日于天津医科大学肿瘤医院出院后,激素减量方案:泼尼松口服(20 mg qd 7 d,10 mg qd 7 d,5 mg qd 7 d)。2019年11月23日复查肝功能:ALT 38 U/L,AST 29.8 U/L,TBIL 54.12 μmol/L,DBIL 26 μmol/L。2019年12月2日复查肝功能:ALT 36.2 U/L,AST 27.4 U/L,TBIL 37.43 μmol/L,DBIL 17.8 μmol/L。继续定期复查,2020年1月8日恢复正常。具体见表2,图2。
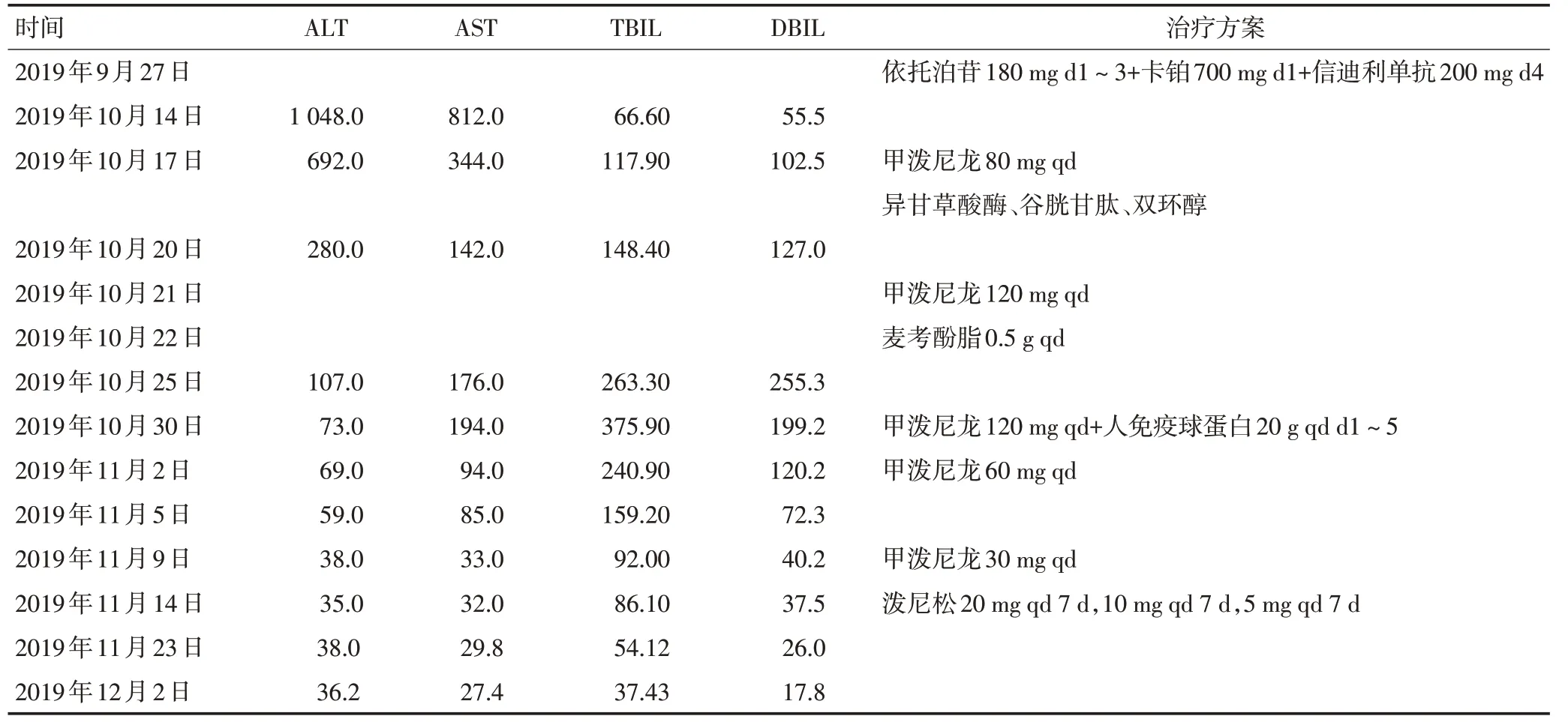
表2 病例2患者肝功能变化及用药情况
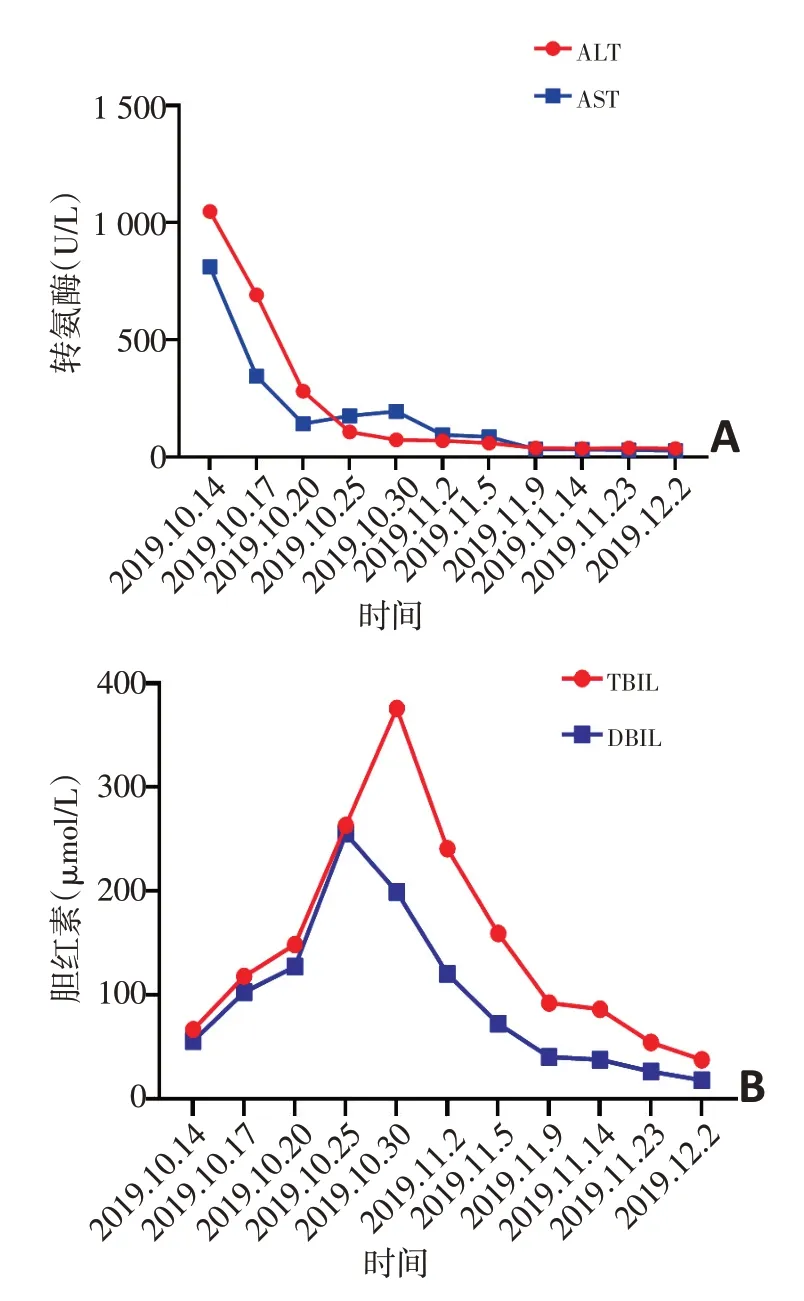
图2 病例2患者肝功能变化及用药情况
2 讨论要点
1)免疫治疗肝损伤的分级及处理策略;2)免疫治疗联合化疗出现药物性肝损伤时如何判断是化疗药物导致的还是免疫治疗导致的;3)免疫治疗肝损伤治疗过程中激素的起始剂量及减量策略;4)免疫治疗肝损伤出现激素耐药后的处理策略;5)免疫治疗肝损伤中保肝药物的使用。
3 临床讨论
姜战胜副主任医师(中西医结合科):目前,各指南/共识对于免疫治疗导致肝损伤的分级标准未统一,欧洲肿瘤医学协会会议(ESMO)和美国国立综合癌症网络(NCCN)/美国临床肿瘤学会(ASCO)指南未将胆红素升高纳入诊断分级标准之内;肿瘤免疫治疗学会(SITC)的4级不良反应标准较低[1];中国临床肿瘤学会(CSCO)指南较为全面。按照CSCO ICIs 相关的不良反应管理指南(2019版)[2]的建议,免疫治疗导致的肝脏损伤分级依据转氨酶及胆红素的数值分为4 级:1 级,AST 或ALT<3 倍正常值上限(ULN)、TBIL<1.5 倍ULN;2 级,AST 或ALT 3~5 倍ULN、TBIL 1.5~3.0 倍ULN;3 级,AST 或ALT 5~20 倍ULN、TBIL 3~10 倍ULN;4 级,AST 或ALT>20 倍ULN、TBIL>10倍ULN。本研究的2 例患者,病例1 的肝损伤分级为3 级(转氨酶升高达2 级,胆红素升高达3 级);病例2 的肝损伤分级为4 级(病程之初转氨酶升高达4级,胆红素从2级升至4级)。根据指南给予相应的治疗建议:1 级可以继续免疫治疗,每周监测1次肝功能,如肝功能稳定,适当减少监测频率。2级需暂停免疫治疗,给予泼尼松0.5~1.0 mg/kg口服,如肝功能好转,缓慢减量,总疗程至少4周。泼尼松减量至≤10 mg/d,且肝脏毒性≤1级,可重新免疫治疗。3级暂停免疫治疗,静脉给予甲泼尼龙1~2 mg/kg,待肝脏毒性降至2级后,可等效改换口服的泼尼松并继续缓慢减量,总疗程至少4周。3天后如肝功能无好转,考虑加用麦考酚脂(500~1 000 mg,2次/d)。泼尼松减量至≤10 mg/d,且肝毒性≤1 级,可重新给予免疫治疗,治疗期间每1~2天检测肝功能。4级一旦出现需要永久停用免疫治疗,处理原则同3级。对于基线存在肝转移的患者,可在相当于2级肝脏不良反应以内的肝功能水平进行免疫治疗;当发生免疫治疗相关肝脏损伤,ALT/AST 升高超过基线50%,并持续1周以上,需永久停止免疫治疗。另外需要注意的是:在处理肝脏不良反应时不推荐使用英夫利昔单抗;如果麦考酚脂效果欠佳,可选用他克莫司;必要时请肝脏病专家会诊,进行肝脏CT或超声检查。
张新伟主任医师(生物治疗科):目前,免疫治疗联合方案在临床应用日益广泛,包括化疗联合、抗血管药物联合等。对于化疗联合免疫治疗后出现的肝损伤是化疗引起还是免疫治疗引起的无法进行精准的诊断和鉴别诊断。在信迪利单抗单药治疗的1 项小样本的肺癌新辅助治疗临床研究中发现,转氨酶升高的发生率为5%(2/40),但都是≤2级的;未报道胆红素异常升高事件[4]。另外1 项信迪利单抗联合培美曲塞+卡铂的临床研究中也未发现≥3 级的免疫治疗导致的肝损伤事件[4]。日本的1 项临床研究总结了202例ICIs单药治疗的患者,结果发现所有级别和≥3 级的免疫性肝损伤发生率分别为8.4%和4.0%[5]。复旦大学中山医院的1 项病理研究显示[6]:单药ICIs治疗的肝损伤表现较轻,8例(8/10)出现轻度肝损伤,2 例(2/10)出现轻-中度肝损伤。在使用ICIs 及抗血管TKI 联合治疗的患者中,肝损伤较为严重,其中4例(4/11)出现中-重度肝损伤,肝细胞桥接坏死、大片坏死,汇管区中-重度炎性病变,部分小胆管上皮变性,伴显著界面性肝炎。单药治疗、联合治疗中各有2 例发生死亡,其中联合治疗组中有1 例发生急性多发性肝炎,肝组织大片凝固性坏死,肝功能不可逆损伤,最终患者因多系统免疫失调,多器官衰竭而死亡。与单用ICIs相比,联合使用ICIs及抗血管TKI有可能造成肝细胞的叠加损伤,引起严重肝损伤的可能性更高。
杨华夏副主任医师(风湿免疫科):ICIs通过解除免疫检查点的免疫刹车作用,激活机体的自身免疫,达到杀灭肿瘤细胞的作用。然而过度激活的免疫系统也会攻击人体正常的器官,引起相关的免疫不良反应可以累及全身的各个器官系统,引起一系列免疫系统异常激活的临床表现,称之为ICIs相关不良反应(immunocheckpoint inhibitors related adverse effects,irAEs)[7]。基于其免疫损伤及炎症激活的发病机制,目前治疗irAEs的基本策略是以糖皮质激素为基础的治疗,对于重症患者或激素抵抗患者需要考虑联合免疫抑制剂和生物制剂治疗。
糖皮质激素包短效、中效及长效多种剂型,对于irAEs的处理多使用中效的口服泼尼松或静脉甲泼尼龙。对于明确诊断irAEs 的患者,早期使用糖皮质激素是关键。在具体使用原则上,通常按照受累脏器,严重程度、病程缓急等因素考虑激素用量。对于急进性病程、可能导致重要脏器的功能衰竭的临床情况如重症肝损、重症肺炎、暴发性心肌炎或横贯性脊髓炎患者,推荐尽早使用激素冲击治疗(静脉甲泼尼龙1 g/d,3~5 d)。对于3~4 级irAEs,推荐大剂量的激素治疗(甲泼尼龙1 mg/kg/d~2 mg/kg/d 或其等效剂量)。激素治疗起效3~5 d 后开始减量。减量速度相比传统自身免疫病更快。整个激素使用的疗程一般超过4 周,对免疫性肺炎和肝炎患者而言,可以6~8周或更长时间[8]。
对于重症irAEs 或激素抵抗的患者,需加用免疫抑制剂、生物制剂及其他免疫调剂治疗。可选择的药物包括吗替麦考酚酯[9]、他克莫司、抗胸腺细胞球蛋白(antithymocyte globulin,ATG)[10]、人免疫球蛋白等。此外,生物制剂如TNFα单抗、IL-6单抗、IL-1受体抑制剂、CD20 单抗等也引起靶向抑制炎症或清除自身免疫细胞的作用被选择性应用于部分患者[11]。对于肝损伤患者而言,TNFa 单抗因为可能的肝毒性不推荐用于ICIs导致的肝损伤。
陈明主任医师(消化内科):药物性肝损伤(druginduced liver injury,DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药(TCM)、天然药(NM)、保健品(HP)、膳食补充剂(DS)及其代谢产物乃至辅料等所诱发的肝损伤[12]。推荐采用RUCAM量表对药物与肝损伤的因果关系进行综合评估,将药物与肝损伤的因果相关性分为5级:极可能:>8分;很可能:6~8分;可能:3~5分;不太可能:1~2分;可排除:≤0 分。DILI 的临床分型主要有4 种:1)固有型和特异质型;2)急性DILI和慢性DILI;3)肝细胞损伤型、胆汁淤积型、混合型和肝血管损伤型;4)DILI 相关肝脏良性和恶性肿瘤。DILI 的基本治疗原则是:1)及时停用可疑肝损伤药物,尽量避免再次使用可疑或同类药物;2)应充分权衡停药引起原发病进展和继续用药导致肝损伤加重的风险;3)根据DILI 的临床类型选用适当的药物治疗;4)肝衰竭/亚急性肝衰竭等重症患者必要时可考虑紧急肝移植。目前,无证据显示2 种或2 种以上抗炎保肝药物对DILI 有更好的疗效,因此暂不推荐2种或2种以上抗炎保肝药物联用。常用药物包括:N-乙酰半胱氨酸、异甘草酸酶、双环醇和熊去氧胆酸[12]。
免疫治疗导致的肝损伤不同于传统的DILI,致病原因主要是由于过度激活的免疫系统对肝脏造成损伤,机制可能类似于自身免疫性肝炎。但是,与自身免疫性肝炎不同的是,目前报道的肿瘤免疫治疗引起的肝损伤患者中,自身抗体通常是阴性的;而且,特发性自身免疫性肝炎的免疫损伤机制通常是永久存在的,而肿瘤免疫治疗所引起的免疫性肝损伤在撤药后可以消失[13]。免疫治疗导致的肝损伤在分级中仅注重ALT/AST 和TBIL 的水平,未关注碱性磷酸酶、γ-谷氨酰转肽酶等肝脏相关指标;在临床实践中,建议结合上述2项指标,按照DILI的分型,在糖皮质激素治疗的基础上选择恰当的保肝药物治疗。最后建议在条件允许的情况下,尽量给予患者行肝脏穿刺以协助病理诊断和临床分型。
肖建宇副主任医师(放射科):免疫治疗导致肝损伤影像学表现取决于肝脏不良反应的严重程度,通常情况下表现正常。在严重肝损伤的患者中,CT显示类似于其他常见病因引起的急性肝炎表现,即轻度肝肿大、肝实质减弱、门脉周围水肿和门脉周围淋巴结病等。肝脏超声可见门静脉周围回声,伴或不伴有胆囊壁水肿[3]。本研究第1 例患者出现肝脏损伤后查超声未见异常;第2 例患者查肝脏超声、MRI均未见明显异常。
潘战宇主任医师(中西医结合科):本研究的2例免疫治疗肝损伤患者,由于均采用PD-1抗体—信迪利单抗联合化疗的方案,在肝损伤一开始均是按照普通药物性肝损伤处理,但效果欠佳;按照免疫治疗导致肝损伤进行处理后开始好转。不同之处是病例1为激素敏感型,病例2为激素抵抗型,人免疫球蛋白解救治疗后起效。结合上面几位讨论专家的意见,病例1 的肝损伤分级在初诊时应为转氨酶升高达2级,胆红素升高达3 级,在给予保肝药物3 天后转氨酶异常下降到1级,胆红素异常下降到2级;在保肝6天后发现除了ALT 外,其他3 项指标均未下降,进而按照免疫性肝损伤给予激素治疗(2 mg/kg)后疗效显著。需要注意的是该病例在给予激素的时候由于其肝损伤已降为2 级,应该可以考虑泼尼松1 mg/kg 治疗。不过临床上也在大剂量激素起效后3 天果断进行激素减量,将静脉甲泼尼龙改为泼尼松。病例2的肝损伤确诊时转氨酶升高达4 级,胆红素升高达2级,给予常规保肝治疗后ALT和AST均下降,但DBIL持续上升,按照免疫性肝损伤进行处理时激素起始剂量不足(甲泼尼龙80 mg),胆红素未见好转后调整剂量为(甲泼尼龙120 mg)+麦考酚脂后仍持续升高至4 级,直到采用人免疫球蛋白(20 g qd,5 d)后胆红素才开始逐渐下降,而且可以发现在免疫球蛋白停药后,胆红素仍在持续下降,直至恢复正常,是1例非常成功的针对激素耐药的解救治疗案例。不足之处为2 例患者均未进行肝脏活检,CSCO 指南提出对于严重程度分级为4 级的肝损伤患者,需考虑行肝活检,以判断预后,肝穿刺活检病理最常见表现为小叶性肝炎,与自身免疫性肝炎无法鉴别。多数病例为广泛小叶病变,罕见病例表现为门静脉炎症和胆管炎[14]。另外需要注意的是,在一般的肝损伤中,胆酶分离往往提示肝功能极度恶化、危及生命的紧急情况,但是在irAEs 的范畴内是否具有相同的临床意义尚未明确,病例2的转归具有代表性。
对于免疫治疗导致肝损伤治疗中激素的使用问题,一项研究[15]回顾性分析21 例免疫治疗导致肝损伤在3级或3级以上的患者,其中13例使用激素(SG)治疗,8例未使用激素(NSG),肝损伤缓解的中位时间在SG组为49天,NSG组为24天(P=0.62)。进一步分析发现在胆红素水平高和凝血酶原水平降低的情况下,应该要给予激素治疗。免疫治疗导致的肝损伤在恢复后能否再恢复免疫治疗也备受关注,有研究提示[16],102例发生免疫治疗导致肝损伤≥3级的黑色素瘤患者中,31例接受ICIs治疗;其中15例(48%)出现任何级别的irAEs,仅6 例(19%)患者需要中断ICIs,因免疫治疗肝损伤导致再停药4 例。上述提到的研究中有8 例(4 例为SG/4 例为NSG)患者再使用ICIs,均未再观察到肝炎复发[15-16]。结合上述提到的CSCO 指南,对于≤3 级的不良反应是可以再使用的,一旦发生4级肝损伤,应是永久停药。
4 结语
综上所述,对于免疫治疗肝损伤患者首先要进行分级,如果为2级或3级均需暂停免疫治疗,4级患者需永久停用。在免疫治疗联合化疗时出现的肝损伤,如果无法判断是免疫治疗直接导致的肝损伤,可以先给予常规保肝治疗,但是在3天的时间窗内如果未见明显疗效,尤其是在合并胆红素异常升高的情况下,应按照免疫治疗导致的肝损伤给予激素治疗。激素治疗按照不同的分级可以选择口服或静脉,但是起始一定要足剂量,以免在后续治疗疗效欠佳时无法解释是激素耐药还是剂量不足。激素治疗期间应每2~3 天复查1 次肝功能,大剂量激素起效后可以考虑减量,激素使用的疗程控制在4~6 周。当激素耐药时,需考虑使用其他免疫抑制药物,麦考酚脂、他克莫司为免疫性肝损伤的备选药物,人免疫球蛋白在可及性、安全性何疗效方面也可作为解救治疗的重要选择。肝损伤恢复后,关于免疫治疗再挑战的问题,虽然多数数据表明是安全可行的,但仍需谨慎使用,需做好与患者和家属的沟通工作。本研究虽然阐述2 例成功解救免疫治疗导致肝损伤的病例,但仍应高度重视免疫治疗相关不良反应的诊断、多学科会诊鉴别诊断、激素治疗和其他免疫抑制药物的使用。

