槐杞黄对OVA 诱导哮喘模型大鼠嗜酸性细胞凋亡及免疫调节因子的影响
伍旭明 许亚萍
哮喘是常见的肺部疾病,主要表现为慢性炎症以及气道组织重构。研究者用生物标记法研究气道炎症的相关表型有嗜酸性细胞激活[1]、白三烯分泌[2],以及中性细胞激活[3]。气道炎症细胞如嗜酸性细胞、肥大细胞、T 淋巴细胞等浸润导致气道高反应性,黏液分泌增多和气道阻力。研究证明,气道炎症与Th1/Th2 免疫失衡相关,在气道受到刺激物刺激时炎症因子2 型辅助性T 细胞(Th)反应被激活,嗜酸性细胞和肥大细胞以及Th2 型细胞因子如IL-5 等大量分泌,致使气道炎症加剧[4]。近年研究表明,辅助性T 细胞17(Th17)及其相关因子在哮喘气道炎症的发生发展中亦发挥着关键的作用。槐杞黄颗粒可有效改善咳嗽变异性哮喘(CVA)患儿体液免疫和细胞免疫,同时可调节Th1/Th2 的细胞免疫平衡,降低哮喘非急性发作期患儿IgE,改善肺功能,有助于提高CVA患儿免疫功能,改善愈后,降低复发率[5-7]。研究发现,槐杞黄可一定程度改善卵蛋白(OVA)诱导的哮喘模型大鼠气道白介素(IL-13)、嗜酸性粒细胞(EOS)分泌,因而改善气道炎症[8-9]。还可能通过调节Th17 细胞,进而影响白介素(IL-17)介导的中性粒细胞炎症,提高哮喘治愈率[10]。为进一步研究槐杞黄对抗EOS性气道炎症的作用,本研究从Th1/Th2 以及Th17 免疫途径出发,通过复制哮喘模型大鼠,观察槐杞黄对炎症反应中炎症细胞、促炎细胞及相关细胞凋亡因子的作用,观察槐杞黄对哮喘模型大鼠的影响,报道如下。
1 实验材料
1.1 动 物 清洁级SD 大鼠60 只,雄性,体质量(200±20)g,浙江省医学科学院动物中心提供,动物许可证:SCXK(浙)2014-0001,动物伦理批件号:1408003。实验动物在12h 日光12h 黑夜,26℃室温,60%湿度环境下饲养,大鼠自由饮水采食。所有实验操作符合3R 原则(减少、替代、优化)给予人道关怀。
1.2 主要试剂 槐杞黄颗粒(批号20161201,启东盖天力药业有限公司)。醋酸地塞米松片(批号140309,浙江仙琚制药股份有限公司)。Albumin Egg(Sigma A5253 Grade Ⅱ,CAS#A8040,上海泽衡生物科技有限公司);大鼠免疫球蛋白E(IgE),大鼠白介素5(IL-5),大鼠白介素3(IL-3),大鼠粒细胞-巨噬细胞(GM-CSF),大鼠白介素17(IL-17)(批号20150402B,均购自上海源叶生物科技有限公司)。瑞士吉姆萨染色液(批号150630,杭州滨和微生物试剂有限公司)。Trizol[SK1312,生工生物工程(上海)股份有限公司]。GoScriptTMReverse Transcription System(A5000/A5001)。Power SYBR Green PCR Master Mix and Power SYBR Green RT-PCR Reagents Kit。甘油醛-3-磷酸脱氢酶(GADPH)、B 淋巴细胞瘤-2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、人核因子κB(NF-κB)酶联免疫检测试剂盒,批号150328,均购自生工生物工程(上海)股份有限公司。
1.3 仪器 PARI TurboBOY N(BR 060400;PARI GmbH,德国)。医用超声雾化器(BSE2A,北京亚都医药科技有限公司)。Sartorius 纯水仪,arium 611VF,购自德国赛多利斯公司。电子分析天平,AB104-N,购自梅特勒-托利多仪器(上海)有限公司。全波长酶标仪,购自Power Wave xs。
2 实验方法
2.1 分组及哮喘动物模型建立 60 只SD 大鼠适应性饲养1 周后,采用随机数字表法分成正常对照组、模型组、地塞米松组、槐杞黄组、槐杞黄联合地塞米松组,每组12 只。参照文献[11]方法,并在此基础上进行改进,建立哮喘模型大鼠。致敏:在第1 天和第7天时,模型组和给药组大鼠腹腔注射10%卵清白蛋白和氢氧化铝粉末致敏液1mL。
2.2 给药 大鼠致敏第14 天起,地塞米松组、槐杞黄组、槐杞黄联合地塞米松组大鼠给予相应药物,槐杞黄给药剂量为0.4g·100g-1·d-1,地塞米松给药剂量0.1g·100g-1·d-1,连续给药15 天。正常对照组及模型组大鼠按每只每天给予生理盐水2mL。模型组、给药组大鼠在给药的同时采用0.1%卵清蛋白溶液进行激发,激发时间30min/次,每天1 次,连续激发15天,以模型组和用药组大鼠出现明显点头样呼吸、呼吸急促、呛咳、行动迟缓、腹肌明显收缩、嘴唇发绀、全身瘙痒,甚至大小便失禁、反应迟钝、俯伏不动等表现为造模成功。正常对照组不做处理。
2.3 观察指标
2.3.1 自主活动观察 观察造模及给药前后大鼠的精神状态、体质量、活动、毛发色泽、呼吸道症状、进食、死亡等情况。
2.3.2 血清指标测定 末次激发1h 后,用10%乌拉坦(1300mg/kg,即1.3mL/100g)腹腔注射麻醉大鼠,腹腔下静脉取血5mL,4℃放置1~2h,4℃3000r/min离心10min。取适量血清,测定血清IgE、IL-3、IL-5、IL-17 及GM-CSF 水平。
2.3.3 肺泡灌洗液(BALF)白细胞及嗜酸性细胞百分比 取血后,气管插管,结扎右肺门根部,行左肺支气管肺泡灌洗,用生理盐水3mL/次灌洗支气管肺泡,来回冲洗2 次,灌洗2 次,合并2 次BALF,4℃2000r/min 离心10min。取150μL BALF 液用白细胞稀释液1∶2 稀释,显微镜下计数白细胞数。重悬BALF 液离心后的沉淀,制备3 张涂片,以吉姆斯液染色。每个标本计数400 个白细胞,并计数其中嗜酸性粒细胞(EOS)、单核细胞(MAC)、淋巴细胞(LYM)、中性粒细胞(NEU)个数,计算各类白细胞百分比。
2.3.4 肺组织病理 肺泡灌洗后,取未灌洗的肺组织用10%甲醛溶液固定48h 以上,用乙醇梯度脱水,常规石蜡包埋,0.4μm 切片,烤片脱蜡,行HE 染色,观察肺组织病理变化。
2.3.5 实时定量逆转录-聚合酶链反应(qRT-PCR)测定肺组织Bcl-2/Bax 及NF-κB mRNA 相对表达水平 取新鲜肺组织适量,加1mL Trizol 从肺组织提取Total RNA。利用2μL 测定核酸纯度,A260/280 在1.8~2.1 之间则提取的RNA 纯度较好。所得的RNA保存于-80℃超低温冰箱。用反转录试剂盒,将反转录混合液加入RNA 模板混合液中,涡旋混匀,25℃下孵育5min,42℃下孵育60min,70℃下孵育15min。cDNA 样品放入-20℃保存备用。用定量试剂盒进行扩增定量,观察基因相对表达量。引物均由生工生物工程(上海)股份有限公司合成。引物序列如下:GAPDH:上游5'-GACATGCCGCCTGGAGAAAC-3',下游5'-AGCCCAGGATGCCCTTTAGT-3';NF-κB:上游5'-GCATTCTGACCTTGCCTATCT-3',下游5'-CTCCAGTCTCCGAGTGAAGC-3';Bcl-2:上游5'-GGCATCTTCTCCTTCCAGC-3',下游5'-CCCAGCCTCCGTTATCC-3';Bax:上游5'-CCCACCAGCTCTGAACAGTTC-3',下游5'-CCAGCCACAAAGATGGTCACT-3'。
2.4 统计学方法 应用SPSS 19.0 统计软件分析数据,实验数据以均数±标准差()表示,采用单因素方差分析,P<0.05 为差异有统计学意义。
3 实验结果
3.1 各组大鼠血清IgE、IL-5、IL-3、GM-CSF 及IL-17 水平比较 模型组大鼠血清IgE、IL-5、IL-3、GMCSF 及IL-17 水平明显高于正常对照组(P<0.05 或P<0.01);与模型组比较,地塞米松组、槐杞黄组和槐杞黄联合地塞米松组大鼠血清IgE 水平显著降低(P<0.05 或P<0.01);槐杞黄联合地塞米松组大鼠血清IL-5、IL-3、GM-CSF 及IL-17 水平显著低于模型组(P<0.05 或P<0.01)。见表1。
表1 各组大鼠血清IgE、Il-5、Il-3、GM-CSF 及IL-17 水平比较()
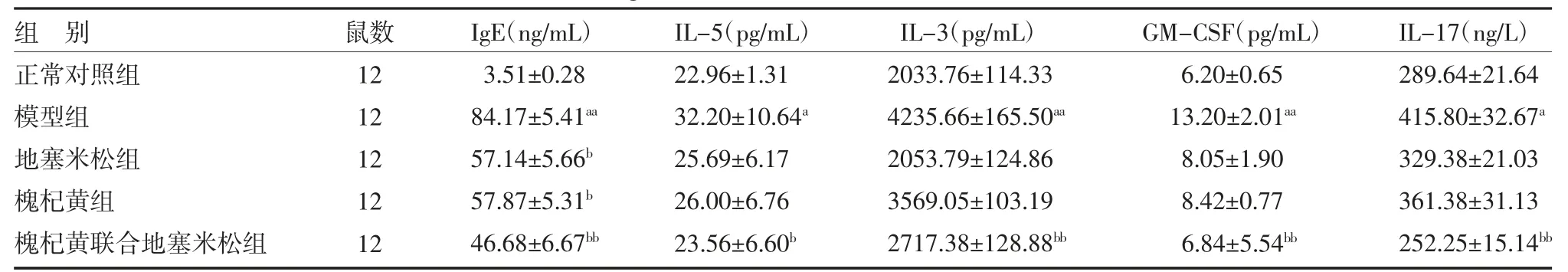
表1 各组大鼠血清IgE、Il-5、Il-3、GM-CSF 及IL-17 水平比较()
注:正常对照组为正常大鼠,予生理盐水;模型组为哮喘模型大鼠予生理盐水;地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 地塞米松混悬液;槐杞黄组为哮喘模型大鼠予0.4g·100g-1·d-1 槐杞黄颗粒混悬液;槐杞黄联合地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 槐杞黄+0.1g·100g-1·d-1 地塞米松混悬液;IgE 为免疫球蛋白lgE;IL-5 为白介素5;IL-3 为白介素3;GM-CSF 为粒细胞-巨噬细胞集落刺激因子;IL-17 为白介素17;与正常对照组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01
表2 各组大鼠肺泡盥洗液白细胞总数及各类白细胞百分比比较()
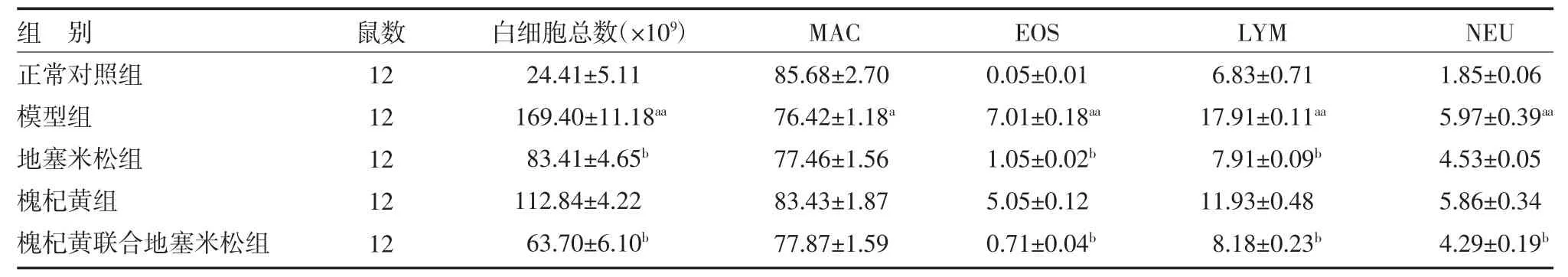
表2 各组大鼠肺泡盥洗液白细胞总数及各类白细胞百分比比较()
注:正常对照组为正常大鼠,予生理盐水;模型组为哮喘模型大鼠予生理盐水;地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 地塞米松混悬液;槐杞黄组为哮喘模型大鼠予0.4g·100g-1·d-1 槐杞黄颗粒混悬液;槐杞黄联合地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 槐杞黄+0.1g·100g-1·d-1 地塞米松混悬液;MAC 为单核细胞;EOS 为嗜酸粒细胞;LYM 为淋巴细胞;NEU 为中性粒细胞;与正常对照组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05
3.2 各组大鼠肺泡盥洗液(BALF)白细胞总数及各类白细胞百分比比较 模型组大鼠BALF 白细胞总数及EOS、LYM、NEU 比例明显高于正常对照组(P均<0.01),MAC 百分比低于正常对照组(P<0.05);与模型组比较,地塞米松组大鼠BALF 白细胞总数及EOS、LYM 比例降低(P 均<0.05),槐杞黄联合地塞米松大鼠BALF 白细胞总数及EOS、LYM、NEU 比例显著低于模型组(P 均<0.05)。见表2。
3.3 各组大鼠肺组织Bcl-2/Bax 及NF-κB mRNA表达水平比较 模型组大鼠肺组织Bcl-2/Bax mRNA、NF-κB mRNA 相对表达量明显高于正常对照组(P<0.01,P<0.05);与模型组比较,地塞米松组、槐杞黄组以及槐杞黄联合地塞米松组大鼠肺组织Bcl-2/Bax mRNA 相对表达量均显著降低(P 均<0.01);槐杞黄组以及槐杞黄联合地塞米松组大鼠肺组织NFκB mRNA 相对表达量显著低于模型组(P<0.05)。见表3。
3.4 肺组织病理 各组大鼠肺组织病理切片HE 染色结果可见,正常组大鼠肺组织肺泡壁结构正常,无增生无增厚,肺泡壁周围无炎症细胞浸润,气道壁较薄,气道壁周围无炎症细胞浸润(见图1A)。模型组大鼠肺组织肺泡壁增生,肺组织被大量炎症细胞浸润,气道周围炎症细胞浸润明显,气道壁明显增厚(见图1B)。地塞米松组及槐杞黄组大鼠肺组织可见肺泡壁及气道周围炎症细胞浸润的现象有所缓解,肺泡壁及气道壁较模型组大鼠薄(见图1C、D)。槐杞黄联合地塞米松组大鼠肺组织可见肺泡壁及气道周围炎症细胞浸润的现象明显缓解,肺泡壁及气道壁较模型组大鼠明显薄(见图1E)。
表3 各组大鼠肺组织Bcl-2/Bax 及NF-κB mRNA 表达水平比较()

表3 各组大鼠肺组织Bcl-2/Bax 及NF-κB mRNA 表达水平比较()
注:正常对照组为正常大鼠,予生理盐水;模型组为哮喘模型大鼠予生理盐水;地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 地塞米松混悬液;槐杞黄组为哮喘模型大鼠予0.4g·100g-1·d-1 槐杞黄颗粒混悬液;槐杞黄联合地塞米松组为哮喘模型大鼠予0.1g·100g-1·d-1 槐杞黄+0.1g·100g-1·d-1 地塞米松混悬液;Bcl-2 为B 淋巴细胞瘤-2 蛋白;Bax 为Bcl-2 相关x 蛋白;NF-κB 为核转录因子κB;与正常对照组比较,aP<0.05,aaP<0.01;与模型组比较,bP<0.05,bbP<0.01
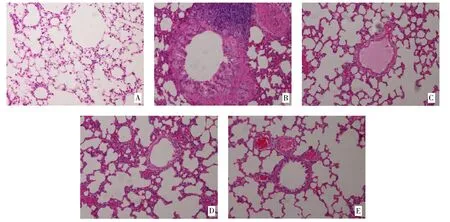
图1 各组大鼠肺组织病理(HE 染色×20)
4 讨论
免疫-炎症反应是哮喘发病主要机制之一,T 细胞被抗原激活,活化的辅助性T 细胞(主要是Th2 细胞)产生的白细胞介素进一步激活B 淋巴细胞,后者合成特异性IgE,并结合于肥大细胞和嗜碱性粒细胞等表面的IgE 受体。若变应原再次进入体内便可引起体内免疫反应,导致平滑肌收缩、黏液分泌增加、血管通透性增高和炎症细胞浸润等。研究表明,IL-17 在哮喘患者的外周血、支气管黏膜、肺组织、支气管BALF 和诱导痰中表达量增加[12-14]。Th17 细胞可分泌炎症细胞因子IL-17F、IL-6 以及TNF-α 等,加重炎症反应[1]。本实验中,OVA 诱导的哮喘模型大鼠可见BALF 白细胞总数、EOS、LYM 以及NEU 比例明显升高,血清IgE 及IL-17 显著上升,肺组织病理显示肺泡壁及气道壁增厚,组织周围炎症细胞浸润明显。给予地塞米松、槐杞黄及两药合用可明显降低哮喘模型大鼠BALF 白细胞总数、EOS、LYM 以及NEU 比例,可降低血清IgE 及IL-17 水平,减少肺泡壁及气道壁增厚程度和组织周围炎症细胞浸润现象。
EOS 由骨髓多能干细胞分化,通过内皮细胞上的粘附分子及对应配体进入组织,后经趋化因子激活[1]。EOS 被发现在哮喘模型鼠的血、肺组织、BALF和胸腔淋巴结中数量明显升高[15]。IL-3、IL-5 和GMCSF 可调节EOS 生成以及激活[16]。此外,EOS 的凋亡减少是除EOS 生成之外另一个使EOS 增多的原因之一,EOS 凋亡程度还影响着哮喘支气管气道炎症的发展。Bcl-2 为抑制细胞凋亡基因,Bax 为促进细胞凋亡基因,被公认为细胞凋亡的重要调控基因[17],两者的比例决定了细胞在受到凋亡信号刺激是否发生凋亡[18]。本实验中,OVA 诱导哮喘模型大鼠血清IL-3、IL-5 和GM-CSF 明显升高,肺组织Bcl-2/Bax mRNA 比例显著升高。槐杞黄联合地塞米松干预明显下调哮喘模型大鼠血清IL-3、IL-5、IL-17 和GMCSF 水平,以及肺组织Bcl-2/Bax mRNA 表达。
NF-κB 与多种免疫性和炎症性疾病密切相关,包括哮喘气道炎症,其可调节多种细胞因子、粘附分子以及趋化因子的转录,并可调节炎症细胞凋亡[19]。活化的NF-κB 促进各炎症因子的表达增强,引起肺内中性细胞浸润,使得肺部大量积聚、粘附、浸润并释放大量氧自由基、蛋白酶等炎症介质损伤肺组织[20]。本实验中,OVA 诱导的哮喘模型大鼠肺组织NF-κB mRNA 相对表达量明显高于正常对照组大鼠(P<0.05),槐杞黄及槐杞黄联合地塞米松可使哮喘模型大鼠肺组织NF-κB mRNA 相对表达量降低,缓解哮喘模型大鼠气道炎症,起到保护肺组织的作用。
综上所述,槐杞黄辅助治疗可能通过纠正OVA诱导哮喘模型大鼠Th1/Th2 以及Th17 免疫失衡,促进EOS 凋亡,下调哮喘促炎因子NF-κB 表达,以达到缓解哮喘模型大鼠气道炎症的作用。

