DON暴露对断奶仔猪小脑组织脂质过氧化反应、神经递质分泌及钙稳态的影响
朱 雷,曹 利,冉 梦,王中正,2, 陈晓芳,李 玉,冯士彬,吴金节,王希春
(1.安徽农业大学 动物科技学院,合肥 230036;2. 安徽省铜陵市农业委员会,安徽铜陵 244000)
脱氧雪腐镰刀菌烯醇(DON),又名呕吐毒素,主要是由禾谷镰刀菌产生的一种B型单端孢霉烯[1]。据检测报告数据显示,2017年国内各省市区域的玉米、玉米副产物全价饲料等1 034个饲料原料及配合饲料样品的DON超标率分别达到1.23%、6.67%及1.76%[2]。在另一调查中,全国21个省市检测的659份饲料及饲料原料样品中,霉菌毒素污染水平呈现出区域差异,整体受DON毒素污染最为严重[3]。以往的研究结果表明,DON对动物机体具有免疫毒性、神经毒性及细胞毒性等多种毒性作用[4]。有学者发现,DON暴露可以影响雏鸡脑部的脂质过氧化水平,神经递质分泌以及扰乱钙稳态的平衡,此外,DON还可以改变雏鸡脑部的形态结构[5-7]。另外其他研究表明,DON还可以影响体外培养仔猪海马神经细胞的神经递质分泌、改变脂质过氧化及钙稳态的状态[8-9]。低水平的DON可以影响猪脑脊髓液中多巴胺的浓度[10],而高水平DON则可使初产猪皮质中5-羟色胺及下丘脑多巴胺浓度增加,同时减少下丘脑中去甲肾上腺素及脑桥中多巴胺的含量[11]。在小脑神经研究方面,也有学者发现DON可使断奶仔猪小脑的部分神经递质分泌异常[12]。目前,关于饲料中DON对断奶仔猪神经毒性的研究大多集中在大脑组织及神经细胞的体外毒性方面,对小脑组织的研究较少。因此,本研究旨在通过断奶仔猪DON体内暴露试验,探索其对仔猪小脑组织的毒性作用,为进一步丰富和完善DON的神经毒性机理提供试验依据。
1 材料与方法
1.1 试验动物
“杜×长×大”三元杂交断奶仔猪,由安徽省青阳县五星畜牧种猪场提供。
1.2 主要试剂和仪器
禾谷镰刀菌菌种由南京农业大学动物医学院中毒病实验室惠赠;多咪静注射液,购自美国辉瑞制药有限公司;ELISA试剂盒,均购自上海源叶生物科技有限公司;Ca2+测定试剂盒,购自北京利德曼生化股份有限公司;RIPA裂解液及BCA蛋白浓度测定试剂盒,均购自碧云天生物技术研究所;β-actin抗体,购自北京锐抗生物科技有限公司;Calmodulin(CaM)、CaMKⅡ、CaMKⅡ(Phospho Thr305)抗体,均购自美国ImmunoWay;二抗购自碧云天生物技术研究所;Trizol RNA 提取试剂,购自大连宝生物工程有限公司;StarScriptⅡ First-strand cDNA Synthesis Mix,购自北京康润诚业生物技术有限公司(GenStar);SybrGreen q-PCR mastermix,购自广州柏仕达新材料有限公司;PierceTMECL Western-blot Substrate,购自美国Thermo有限公司。
1.3 试验动物的分组与饲养管理
选取15头21日龄平均体质量为(6.87± 0.41)kg的临床检查健康的“杜×长×大”三元杂交断奶仔猪,随机分为3栏,每栏5头,分别饲喂基础饲粮(对照组)、低剂量DON饲粮(DON质量分数为1 mg·kg-1)、高剂量DON饲粮(DON质量分数为2 mg·kg-1)。试验期为60 d。自由采食,自由饮水,每天观察仔猪的采食和健康状况,消毒免疫程序严格按照猪场管理方案进行。
1.4 样品采集与处理
在第60天时,每栏选5头仔猪,麻醉后经前腔静脉放血致死,仔细剥离头骨并迅速取出完整的脑,并置于冰上分离出小脑组织。取部分小脑组织加入一定量生理盐水,置于冰上进行匀浆, 3 000 r·min-1离心10 min,取上清液保存于 -80 ℃冰箱内,用以检测脂质过氧化指标、神经递质含量及Ca2+浓度;剩余部分组织装入冻存管,保存于液氮,用以检测钙调蛋白通路相关基因蛋白的表达情况。
1.5 检测指标和方法
1.5.1 氧化与抗氧化性能指标的测定 分别用猪超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮(NO)、丙二醛(MDA)ELISA检测试剂盒进行测定,操作过程严格按照试剂盒说明书进行。
1.5.2 神经递质及钙离子浓度的测定 分别用猪5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)、乙酰胆碱(ACH)和γ-氨基丁酸(GABA)ELISA检测试剂盒及Ca2+测定试剂盒进行测定,操作过程严格按照试剂盒说明书进行。
1.5.3 qRT-PCR 法检测组织中CaM和CaMKⅡmRNA基因相对表达水平 将组织样本分别用液氮研磨粉碎,加入 1 mL Trizol试剂,在碎冰上进行匀浆处理,离心取上清液,加入500 μL酚氯仿,振荡混匀,静止5 min,置于离心机中,4 ℃离心10 min,取上清并加入700 μL异丙醇,混匀,4 ℃ 12 000 r·min-1离心10 min,去上清,取白色沉淀,用φ=75%乙醇洗涤1次,置于超净台上风干,溶于50 μL DEPC处理水中,电泳检测。用反转录试剂盒将提取的 RNA 反转录成 cDNA。根据GenBank中序列,运用Primer 5.0软件设计目的基因和内参基因的特异性上、下游引物序列。相关基因的引物序列见表1。

表1 CaM、 CaMKⅡ 目的基因和 18S内参基因引物参数Table 1 Parameters of primer for CaM, CaMKⅡ and 18S genes
1.5.4 Western-blot法检测组织中钙调通路中相关蛋白的表达水平 称取0.1 g冻存的小脑组织,加入1 mL RIPA裂解液,14 000 r·min-1离心10 min收集上清,备用。收集的上清液用BCA蛋白浓度测定试剂盒测定蛋白浓度,按照每孔蛋白总量为50 μg计算蛋白上样量,分装后的蛋白加入Loading Buffer(5×),100 ℃水浴 5 min,存于4 ℃,备用。安装胶板,配12%的分离胶及15%的浓缩胶,加样后将电压调至80 V开始电泳,待样品跑至两胶分界线时将电压调至120 V,待样品跑至胶板底部时终止电泳。随后切下所需凝胶将条带转移至PVDF膜上。将印有蛋白的膜置于50 g·L-1的脱脂牛奶中,置于水平摇床上室温孵育 4 h进行封闭。随后4 ℃孵育一抗过夜。次日TBST清洗后,室温孵育二抗 45 min,TBST清洗后滴加显影液使用凝胶成像系统成像,并用Quantity one软件对条带进行灰度分析。
1.6 数据处理
试验数据均以“平均值±标准差”表示,使用SPSS 20.0软件中的ANOVA过程进行数据分析,多重比较采用LSD法;使用Adobe Photoshop CS4软件合成图片;柱形图使用GraphPad Prism 5.0 软件 制作。
2 结果与分析
2.1 仔猪小脑组织中脂质过氧化指标的检测
由表2可见,与对照组相比,高剂量组SOD活性极显著降低(P<0.01),与低剂量组相比,高剂量组SOD活性显著降低(P<0.05)。与对照组相比,试验组的GSH-Px活性均极显著降低 (P<0.01),且高剂量组极显著低于低剂量组 (P<0.01)。与对照组相比,试验组的NO浓度均极显著升高(P<0.01);与低剂量组相比,高剂量组NO浓度极显著升高(P<0.01)。各组间MDA浓度无显著差异(P>0.05)。

表2 DON对小脑中脂质过氧化指标活性的影响Table 2 Effect of DON on activities of lipid peroxidation indexes in cerebellum
注:同行进行相比,数据后不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著但未达极显著(0.01
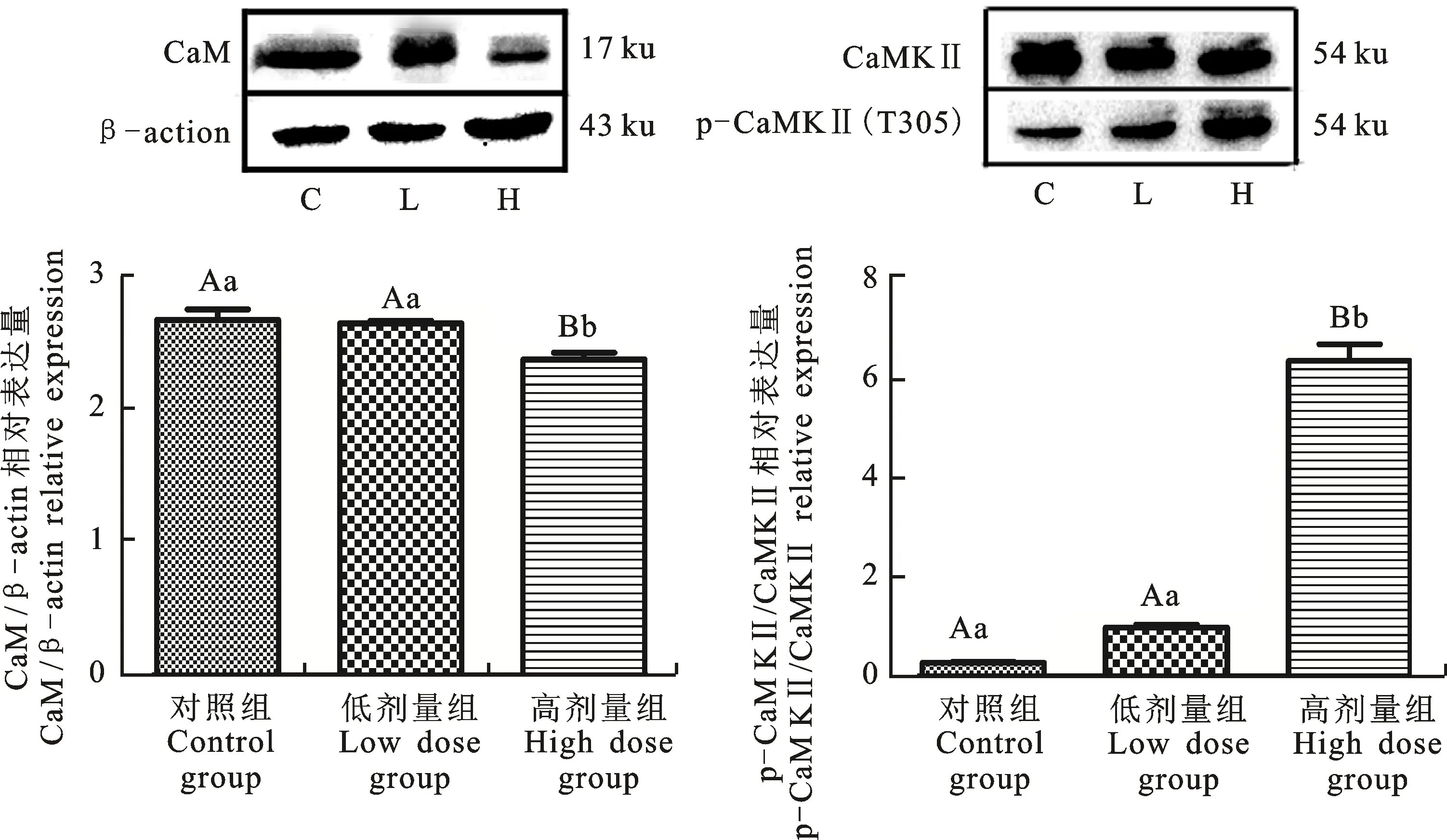
Note: In the same row of the different groups,the data with different superscripts of uppercase letters indicate significance atP<0.01,the data with different superscripts of lowercase letters indicate significance at 0.01 由表3可知,与对照组相比,高剂量组5-HT浓度极显著升高(P<0.01),且高剂量组显著高于低剂量组(P<0.05)。各组间NE和GABA浓度无显著性差异(P>0.05)。与对照组相比,试验组DA含量均极显著降低且呈剂量依赖型(P<0.01)。与对照组相比,试验组ACH含量均极显著降低(P<0.01);与低剂量组相比,高剂量组ACH含量极显著降低(P<0.01)。与对照组相比,试验组钙离子浓度均极显著上升(P< 0.01);与低剂量组相比,高剂量组钙离子浓度呈极显著上升(P<0.01)。 表3 DON对小脑中神经递质及Ca2+浓度的影响Table 3 Effect of DON on concentrations of neurotransmitters and Ca2+ in cerebellum 由图1可知,高剂量组CaMmRNA表达量极显著低于对照组和低剂量组(P<0.01)。与对照组相比,随饲粮中DON含量的增加,仔猪小脑中CaMKⅡmRNA基因相对表达量均极显著降低(P<0.01)。 如图2所示,高剂量组CaM蛋白水平极显著低于对照组和低剂量组(P<0.01),而高剂量组CaMKⅡ蛋白磷酸化水平极显著高于对照组和低剂量组(P<0.01)。对照组与低剂量组之间差异不显著(P>0.05)。 图1 DON对小脑中CaM和 CaMKⅡ mRNA 相对表达量的影响Fig.1 Effects of DON on relative expression of CaM and CaMKⅡ mRNA in cerebellum C为对照组 C is control group;L为低剂量组 L is low dose group;H为高剂量组 H is high dose group 玉米为仔猪饲料中的重要成分之一,饲粮一旦保存不当,如遇到潮湿、高温等环境,则极易产生DON。研究表明,DON对动物具有神经及细胞毒性作用,可使雏鸡脑组织[7]及体外培养的仔猪海马神经细胞[9]发生脂质过氧化及细胞损伤,本试验使用的断奶仔猪饲粮中DON质量分数为 1 mg·kg-1,该质量分数为国家标准中的最高限量,将其作为试验低剂量组进行DON对断奶仔猪小脑组织和细胞损伤作用的研究。 当动物出现氧化应激时,机体产生导致细胞和组织损伤的促氧化剂,与此同时,机体也将产生相应的抗氧化剂进行平衡,如SOD、GSH-Px等[13]。此外,NO也可通过细胞膜的脂质过氧化作用从而导致神经细胞的损伤,若NO含量过多最终会造成脑损伤[14]。本试验中所检测的MDA为脂质过氧化的最终产物,综合以上指标可说明机体发生脂质过氧化的程度。研究表明,DON可使仔猪海马细胞中SOD及GSH-Px含量显著降低,而使MDA的含量极显著升高[9]。此外,3 mg·kg-1DON可使断奶仔猪血清中GSH-Px含量显著降低[15]。在本试验中,DON使断奶仔猪小脑组织中GSH-Px及SOD显著下降,而NO及MDA显著升高,说明DON诱导仔猪小脑组织出现脂质过氧化现象,并对脑组织细胞产生一定毒性作用。 神经递质为动物机体中传导神经冲动的重要物质。其中ACH尤为重要,它可在突触间进行传递,传导神经冲动。有研究显示,ACH在低浓度时,神经间的兴奋传递被抑制,神经细胞的生长和分化均受到影响,从而导致神经系统的生长发育迟缓[16]。此外,DON导致动物产生呕吐反应,可能是由于其作用在肠嗜铬细胞(EC)细胞而诱导5-HT的局部释放[17]。NE则对急性应激反应具有快速的反应,是交感神经肾上腺素的核心组成成分[18]。已有学者研究表明,DON可使猪下丘脑、额叶和小脑中引起NE及5-HT的增加和DA的减少[12]。同时还可使猪血清及脑部5-HT浓度的升高从而改变猪的摄食行为并出现拒食和呕吐现象[19-20]。本试验中断奶仔猪小脑组织中5-HT含量显著升高,而DA、ACH含量下降,说明DON影响仔猪小脑组织中各种神经递质的分泌,对小脑的神经传导产生一定影响,而NE并未出现显著变化,说明长期饲喂含DON饲粮对断奶仔猪机体产生慢性毒性作用而非急性。 在动物机体中,Ca2+是一种非常重要的物质,它可以调节神经递质的释放,影响细胞内钙稳态。作为Ca2+释放传感器的CaM在脑中含量丰富[21],过氧化氢酶(CAT)、SOD及大多数神经递质的释放过程均是受Ca2+与CaM结合所调控[22]。但Ca2+浓度较高则会产生细胞毒性,导致神经细胞凋亡和坏死[23]。此外,CaMKⅡ是一种多聚体丝氨酸—苏氨酸激酶,为神经递质释放的必需物质[24],其最初通过结合钙化钙调蛋白(Ca2+/CaM)激活,该蛋白质的磷酸化则有助于确定细胞膜的兴奋性及细胞Ca2+稳态[25]。研究表明,DON可使体外培养的仔猪海马细胞中Ca2+含量极显著升高[9]。本试验中,试验组断奶仔猪小脑组织中Ca2+含量上升,但CaM基因及蛋白的表达量均降低,同时CaMKⅡ磷酸化程度升高导致其基因与蛋白含量降低,说明DON对小脑的钙稳态造成一定程度的影响,具有一定的神经毒性作用。 综上所述,通过体内暴露试验,DON可影响断奶仔猪小脑组织脂质过氧化反应,改变神经递质的分泌,同时扰乱钙调通路相关基因与蛋白的表达水平,引起钙稳态失衡。上述结果表明 DON可对仔猪产生一定的神经毒性作用。2.2 断奶仔猪小脑组织中神经递质及Ca2+浓度的检测
2.3 仔猪小脑组织中钙调通路相关基因mRNA表达量的影响
2.4 DON对仔猪小脑组织中钙调通路相关基因蛋白表达水平的影响

3 结论与讨论

